| JACS & Angew,“萌”教授再发两篇精彩全合成 | 您所在的位置:网站首页 › 甲基的构型 › JACS & Angew,“萌”教授再发两篇精彩全合成 |
JACS & Angew,“萌”教授再发两篇精彩全合成
|
JACS & Angew,“萌”教授再发两篇精彩全合成
在16走过,17加油的新年时节,加州大学伯克利分校(UC Berkeley)化学系年青的合成化学家、Phil S Baran的高徒Thomas J. Maimone教授(X-MOL读者赠雅号——“萌”教授,点击阅读相关)再次奉献了两篇非常精彩的天然产物全合成,一如既往的简洁高效,都是12步以内,并且可以克级制备,下面分别学习介绍。
Thomas J. Maimone教授。图片来源:University of California, Berkeley 首先是JACS上的全合成:伪莽草毒素(+)-Pseudoanisatin的不对称合成。
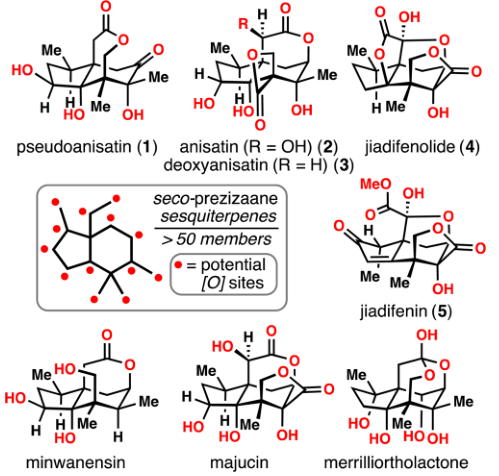
图1. (+)-Pseudoanisatin及同家族天然产物的结构。图片来源:JACS (+)-Pseudoanisatin的结构如图1所示,属于八角属倍半萜,同属的还有明星分子jiadifenolide等。(+)-Pseudoanisatin具有5-6并环的结构,同时还具有桥环的内酯环,分子中有六个氧原子,是高度氧化的倍半萜。
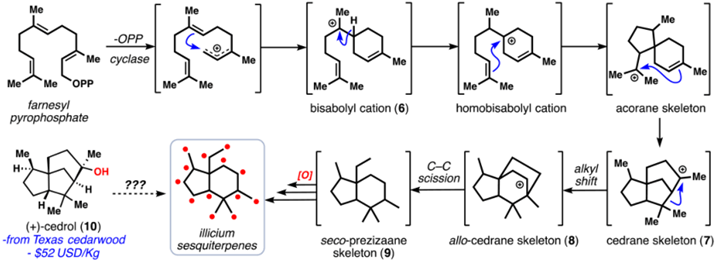
图2. 生源合成假说。图片来源:JACS 如图2所示,对于这种5-6并环的骨架,生源合成途径很可能是从十五个碳单位的法尼基焦磷酸酯出发,经由碳正离子关环、碳碳键迁移以及氧化得到。作者注意到该结构和廉价易得的手性原料雪松醇cedrol(1公斤52美元)有相似之处,于是设想怎么从雪松醇出发合成(+)-Pseudoanisatin。
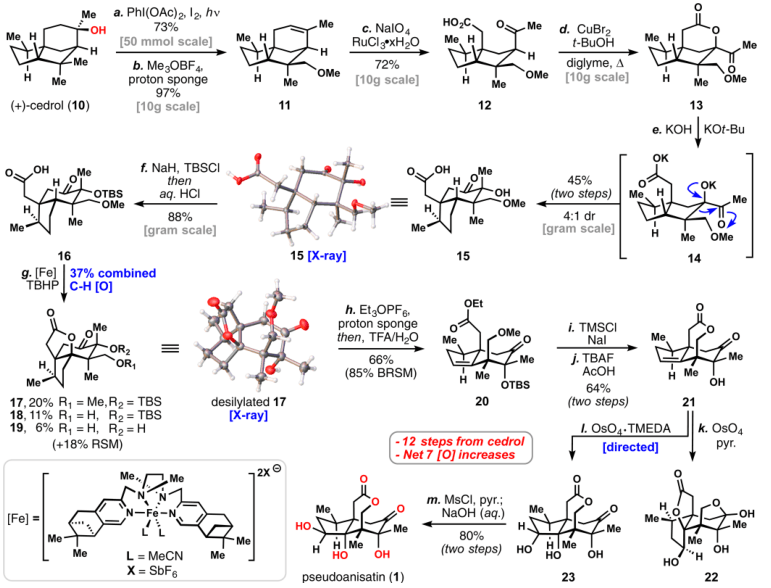
图3. (+)-Pseudoanisatin的合成路线。图片来源:JACS 具体合成路线如图3所示,从(+)-cedrol出发,在醋酸碘苯、碘并光照的条件下选择性地对叔醇5位的甲基碳氢键官能团化,形成四氢呋喃结构,再在Me3OBF4和质子海绵的条件下甲基化并消除,打开了四氢呋喃环得到化合物11,产率优秀并且可以10克规模制备。化合物11在催化量水合三氯化钌和5当量高碘酸钠条件(原位生成四氧化钌)下切断碳碳双键得到化合物12,再在溴化铜并加热的条件下形成六元环内酯得到化合物13,碱性条件下打开内酯并发生碳碳键迁移得到5-6并环化合物15,并由单晶确定其结构。TBS保护三级羟基得到16,再利用美女化学家M. Christina White教授(点击阅读相关)的铁催化碳氢键氧化形成桥头五元环内酯化合物17,打开内酯并消除得到化合物20,TMSCl和碘化钠(原位生成TMSI)条件下脱去甲氧基上甲基并原位内酯化,TBAF、醋酸条件下脱去TBS保护得到化合物21,再在OsO4-TMEDA复合物条件下,三级羟基诱导碳碳双键双羟化得到化合物23,如果不加入TMEDA,双羟化的选择性不对,会发生酯交换并半缩酮化得到产物22(这是jiadifenolide类型的结构)。从化合物23出发,Ms保护二级羟基并碱性条件下发生取代反应,实现了二级羟基构型翻转得到目标产物(+)-Pseudoanisatin。 整体路线12步,非常的简洁高效,关键反应就是碱性条件下碳碳键迁移的扩环反应、铁催化的碳氢键氧化反应、羟基导向的双羟化反应等。 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):
Oxidative Entry into the Illicium Sesquiterpenes: Enantiospecific Synthesis of (+)-Pseudoanisatin J. Am. Chem. Soc., 2016, 138, 16616-16619, DOI: 10.1021/jacs.6b11739 “萌”教授的另一篇Angew则是利用两次烯丙基化反应,总共10步完成了倍半萜内酯(+)-Mikanokryptin的全合成。 如图4所示,(+)-Mikanokryptin是8,12-愈创木内酯型天然产物,具有潜在的生物活性,分子中具有5-7-5并环结构,其中七元环上具有连续的手性中心,五元环内酯环具有环外双键。如图1B所示,作者希望通过两次烯丙基化反应构建其中的7-5并环,进而完成目标产物的全合成。
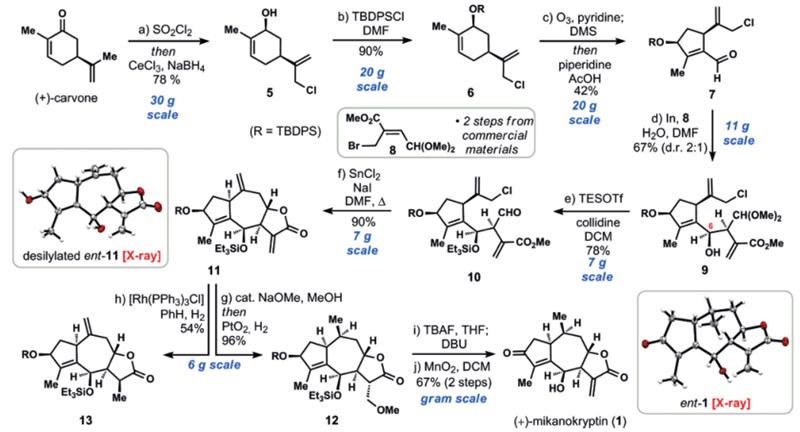
图4. (+)-Mikanokryptin的结构及合成策略。图片来源:Angew. Chem. Int. Ed. 具体合成路线如图5所示:从商业可得的手性原料香芹酮(+)-carvone出发,在磺酰氯条件下发生氯代,接着Luche还原,以78%的收率得到烯丙醇化合物5。TBDPS保护烯丙位羟基得到化合物6,吡啶存在条件下并且控制反应时间选择性臭氧化切断六元环上三取代双键,接着在哌啶/醋酸条件下发生分子内缩合反应得到α,β-不饱和醛化合物7,再在金属铟条件下和化合物8(8由简单化合物出发经Baylis-Hillman反应和溴代反应合成)发生烯丙基化反应,该反应中一当量水的加入非常关键,可能用来阻止原位的内酯化,水太多或太少都会使产率降低,最终以2:1的非对映选择性得到化合物9,TESOTf和collidine条件下保护烯丙位羟基并脱去了缩醛保护基得到化合物10。化合物10再在氯化亚锡、碘化钠条件下发生第二个烯丙基化反应,并原位内酯化得到三环化合物11(原文有条件筛选,其它条件会得到八元环产物或者没有关上五元环内酯的产物),并由单晶确定其结构和立体化学。从11出发,作者尝试了在[Rh(PPh3)3Cl]条件下氢化七元环的环外双键,但只得到了五元环环外双键被氢化的产物13,于是先在甲醇钠/甲醇条件下对不饱和内酯发生Michael反应,再在二氧化铂条件下氢化掉七元环环外双键得到化合物12,TBAF脱去TES和TBDPS两个硅保护基,并在DBU条件下发生β-位消除又得到五元环内酯的环外双键,最后在二氧化锰条件下氧化左边五元环上的烯丙位羟基,以2步67%的总收率得到了最终的目标产物(+)-Mikanokryptin,可以克级规模制备,并由单晶确定了其结构和立体化学。
图5. (+)-Mikanokryptin的合成路线。图片来源:Angew. Chem. Int. Ed. Maimone课题组在这篇Angew的全合成中,利用两次烯丙基化反应为关键步骤,总共10步,以6%的总收率简洁高效地完成了倍半萜内酯(+)-Mikanokryptin的全合成,值得一提的是,该路线还可以克级规模大量制备,这为同家族的其它天然产物的全合成和相关生物活性的研究打下了坚实的基础。 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):
A Double Allylation Strategy for Gram-Scale Guaianolide Production: Total Synthesis of (+)-Mikanokryptin Angew. Chem. Int. Ed., 2017, 56, 1624-1628, DOI: 10.1002/anie.201611078 导师介绍 Thomas J. Maimone教授 http://www.x-mol.com/university/faculty/41 X-MOL有机领域学术讨论QQ群(450043083) 如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载! 点击分享 收藏 取消收藏 评论: 0 |
【本文地址】