| 认识抗体 | 您所在的位置:网站首页 › 什么是半抗原物质组成 › 认识抗体 |
认识抗体
|
Ig可以分为两种类型: 分泌型Ig(Secretory Immunoglobulin,sIg):存在于血清体液及分泌液中,具有抗体的各种功能。
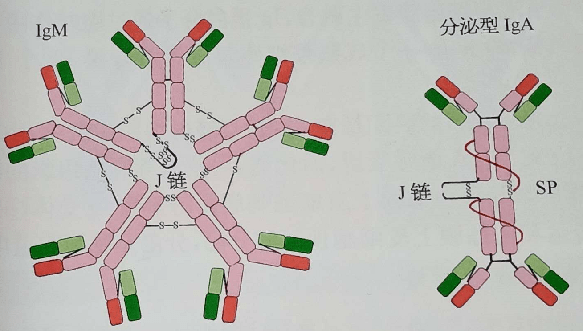
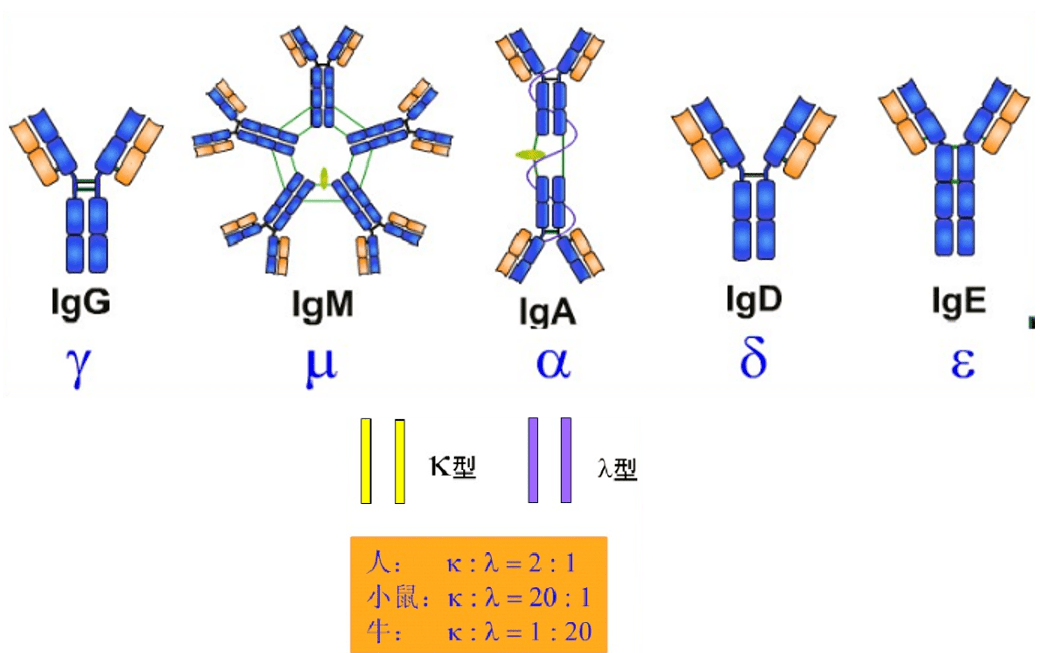
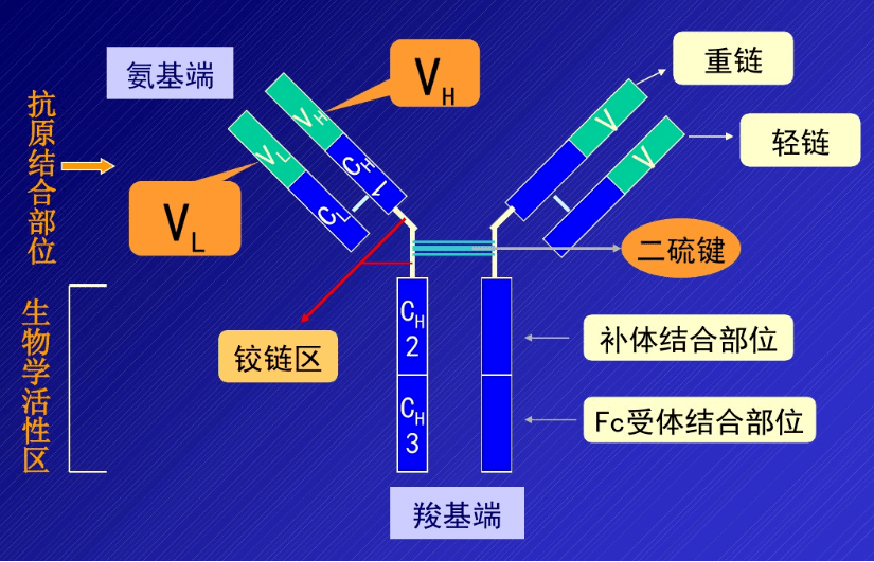
J链将单体IgA和IgM分子连接为二聚体和五聚体。SP作为pIgR的胞外段,与新合成的双体IgA结合,辅助其分泌到粘膜表面,并保护sIgA铰链区。 sIgA分泌型免疫球蛋白A。 02 免疫球蛋白基本结构 重链和轻链 1 重链:含450-550个氨基酸残基,分子量约为55/75Kd。根据H链抗原特异性的差异可将其分为5类, μ 链γ链α链δ链和ε链 ,由他们组成的Ig分别称为Ig M A G D E,IgG有四个亚类, IgG1-IgG4;IgA有两个亚类IgA1和IgA2。其他的未发现有亚类。 2 轻链:大约由213个氨基酸残基组成,分子量约24KD, L链共有2型:kappa(κ)和lambda(λ)。同一个天然Ig分子上L链的型总是相同的。每一抗体单位仅能有κ或λ轻链,但同一个体内可分别存在带有κ或λ链的抗体分子。
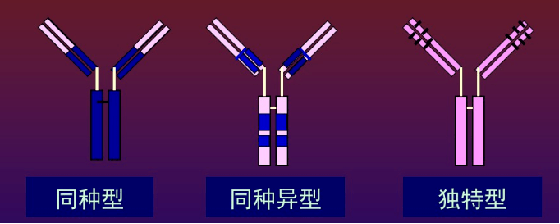
03 免疫球蛋白的类型 免疫球蛋白的类型,根据抗原特异性,Ig分为3类:同种性,同种异型,独特型。 1、同种型 isotype 同种型是指同一种属每个个体都具有的抗原特异性。即同一物种内所有Ig共同具有的抗原性,其抗原决定簇主要位于C区。 分类:根据重链C区的不同,将抗体分为Ig M A G D E五类 亚类:同一类抗体,其重链C区抗原特异性仍有差异。编码重链C区的基因有9个,各自编码μ 、 γ1 γ2 γ3 γ4、α1 α2、 δ和ε IgG( γ )可分为4个亚类, IgG 1 2 3 4 IgA( α )可分为2个亚类, IgA1 IgA2 IgM可分为2个亚类, IgM1 IgM2 分型,免疫球蛋白的型和亚型 型:根据免疫球蛋白轻链C区抗原特异性的不同,可分为κ或λ型。决定Ig型的抗原特异性差异决定于L链的恒定区CL的氨基酸组成、排列和空间构型的不同,分为κ或λ两型。 人L链的的κ型:λ型约为2:1(小鼠则为20:1) 亚型:按λ轻链恒定区(C2)个别氨基酸的差异由可可分为λ 1 2 3 4四个亚型 编码轻链基因中,有1个编码κ轻链C区的基因节段,有4个编码λ轻链C区的基因节段。 2、同种异型allotype 是指同一种属不同个体之间其免疫球蛋白分子所具有的不同抗原特异性 主要反映在Ig分子的CH 和CL上的一个或数个氨基酸的差异,是由不同个体的遗传基因决定,又称同种异型遗传标志。
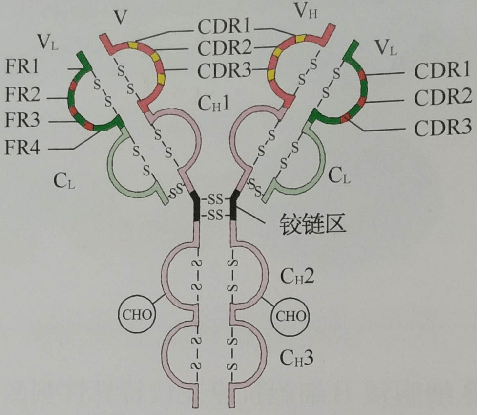
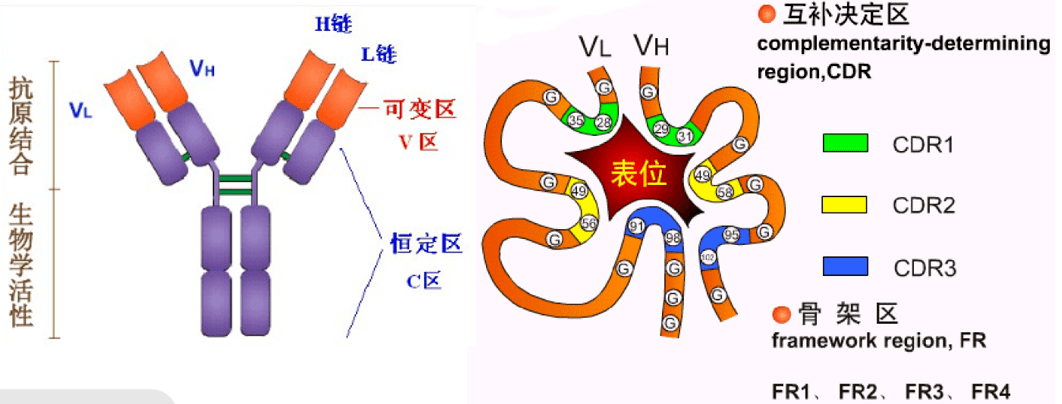
3、独特型idiotype 指在同一个体内,不同B细胞克隆所产生的免疫球蛋白分子V区以及T B细胞表面抗原受体V区,所具有的抗原特异性标志。与抗体分子的结合部位有关的抗原决定簇被称为独特型。 独特型抗原决定簇由Ig超变区特有的氨基酸序列和构型决定。 人体内具有数目庞大的不同的独特型决定簇。在一定条件下,可刺激机体产生抗独特型抗体。 04 可变区和恒定区 通过对IgH链或L链的氨基酸序列比较分析,发现其氨基酸(N-末端)氨基酸序列变化很大,称此区为可变区,而羧基末端(C-末端)则相对稳定,变化很小,称此区为恒定区。 1可变区(variable region)V区,氨基酸的组成和序列多变, 位于L链靠近N端的1/2和H链靠近N端的1/4或1/5。 H和L链的可变区称为VH 、VL 高变区hypervariable region HVR或互补决定区CDR 骨架区frame work region FR,氨基酸组成和顺序变化小 互补决定区 CDR参与抗原结合部位的组成 2.恒定区(constant region)C区,氨基酸组成和顺序相对稳定, 位于L链靠近C端的1/2和轻链靠近C端的3/4或4/5区域, H链和L链的恒定区分别称为CH和CL。
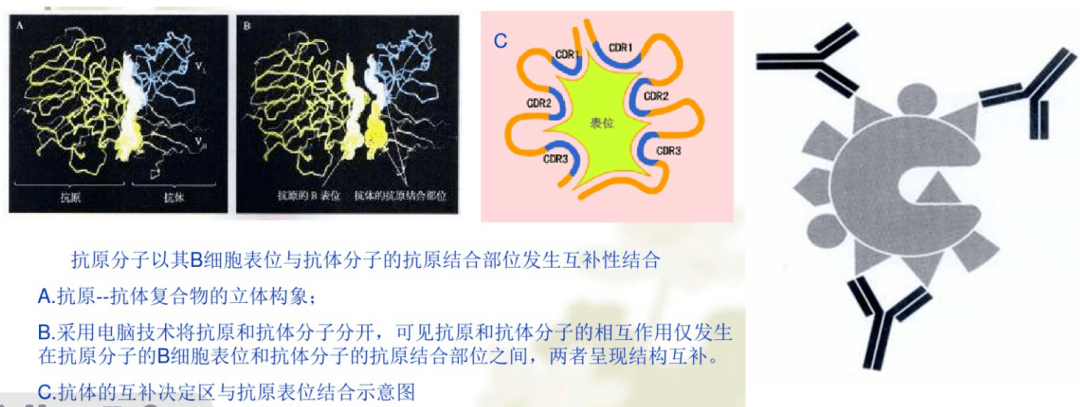
抗体的互补决定区与抗原表位结合
05 抗原表位 抗原表位又称为抗原决定簇(AD),是指抗原分子中决定抗原特异性的特殊化学基团,因而表位代表了抗原分子上的一个免疫活性区,负责与抗体分子或免疫细胞表面的抗原受体结合。严格来说,抗体的特异性是针对表位而不是针对完整的抗原分子的。 抗原通过抗原表位与相应的淋巴细胞表面的抗原受体结合,从而激活淋巴细胞,引起免疫应答。抗原也借表位与相应抗体或致敏淋巴细胞特异性结合发挥免疫效应。抗原表位的性质数目和空间构型决定抗原的特异性。
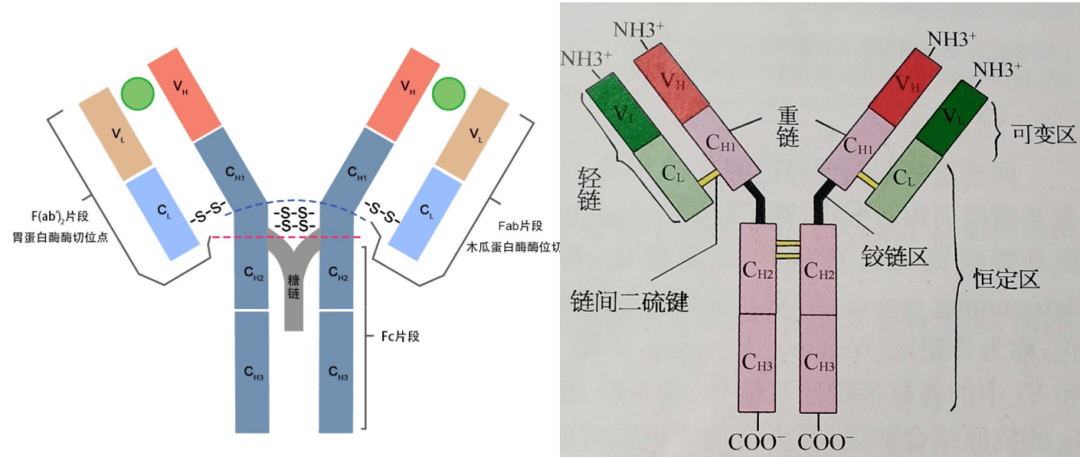
06 铰链区 位于CH1和CH2之间,含有丰富的脯氨酸,因此易伸展弯曲,而且易被木瓜蛋白酶、胃蛋白酶等水解,该区链接抗体的Fab段和Fc段,使两个Fab段易于移动和弯曲,进而可与不同距离的抗原表位结合。IgE和IgM无铰链区。
免疫球蛋白形成Y型或T型结构,两个抗原结合区域通过CH1及CH2间的柔性铰链区连接在一起,连到负责起效应的具有保守结构的FC区域。在哺乳动物中这种免疫球蛋白的结构相对比较保守。 抗体的FC区域由重链的CH2及CH3构成,介导抗体依赖的细胞毒效应(ADCC)及补体依赖的细胞毒效(CDC)。 07 二硫键 形成:二硫键是很多蛋白质立体bai结构中不可或缺的组成部分。 二硫键属于共价键,是由一条多肽链内或二条多肽链中的2个半胱氨酸残基经脱氢氧化生成,所以有链内和链间的二硫键。几乎可以在所有的胞外肽类和蛋白质分子中发现这些共价键。 二硫键的形成和半胱氨酸有关,半胱氨酸(Cys)的侧链有一个非常活跃的反应性巯基。此基团中的的氢原子可很容易地被自由基和其他基团取代,因而易与其他分子形成共价键。通常情况下,半胱氨酸的巯基很不稳定,极易氧化形成二硫键,当一个半胱氨酸的硫原子与位于蛋白质不同位置的另一半胱氨酸的硫原子形成共价单键时,一个二硫键就形成了。形成二硫键的实质是两个游离的巯基氧化后形成硫—硫共价键。从化学机理上讲是个自由基反应。 断键:在生物化学的领域中,通常系指在肽和蛋白质分子中的半胱氨酸残基中的键。此键在蛋白质分子的立体结构形成上起着一定的重要作用。为了确定蛋白质的一级结构,首先必须将二硫键打开,使成为线状多肽链。为此,需要在2-巯-乙醇、二硫苏糖类、巯基乙酸等的硫化合物与尿素那样的变性剂同时存在下使之发生作用,使还原成SH基(为了防止再氧化通常用适当的SH试剂将该基团烷基化)或是在过甲酸的氧化作用下衍生成-SO3H基或是采用在氧化剂共存下用亚硫酸的作用诱导成-S-SO3H基的方法。
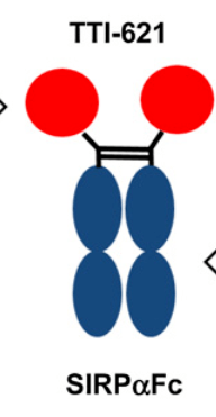
例如,TTI621, Sirpα后面接FC,FC可以形成二硫键,是一个二价的 免疫球蛋白(抗体)结合抗原表位(抗原决定簇)的个数成为抗原结合价,每个单体的Ig都有2个抗原结合位点(Y字形两臂的顶端处),故为双价。 有些Ig可以2个或者2个以上结合在一起,例如分泌型IgA就是二聚体,抗原结合价为4价;五聚体的IgM理论上为10价,但由于立体构型的空间位阻,一般只能结合5个抗原表位,故为5价。 08 免疫球蛋白功能区
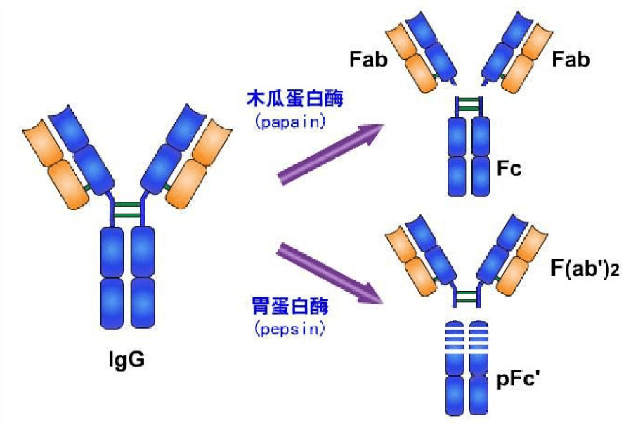
09 免疫球蛋白的水解片段 1 木瓜蛋白酶水解片段 裂解部位:铰链区二硫键连接的两条重链的近N端。可得三个片段: 2个相同的Fab段即抗原结合片段 1个Fc段,可结晶片段 2个相同的Fab段即抗原结合片段 1个Fc段,可结晶片段 2 胃蛋白酶水解片段 裂解部位: 铰链区二硫键连接的两条重链的近C端。可得2个片段 1个F(ab)2片段 Fc段被裂解为若干小分子片段,即pFc’。
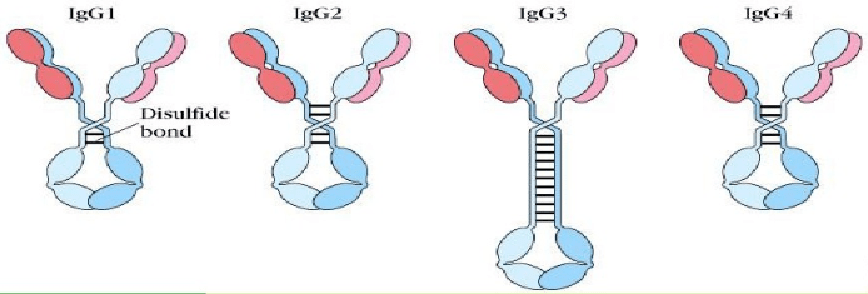
10 免疫球蛋白的其他成分 1 连接链(joining chain ,J链):连接单体Ig分子使其成为多聚体,由浆细胞合成,富含半胱氨酸的多肽链。将IgM连成五聚体,将IgA连成二聚体 2 分泌片secretory piece,SP 是一种含糖的肽链,由粘膜上皮细胞合成和分泌。结合到IgA二聚体上,是分泌IgA分子上的一个辅助成分,有保护和运转作用。 11 IgG分子的4种亚型 IgG 有4种不同的亚类,IgG1 2 3 4,重链顺序上略有不同,功能活性上有相应差异。 IgG3的铰链区最长,IgG2铰链区较短,4种亚类的IgG分子在血清中的浓度不同所发挥的生物学特性不同。 IgG是血液中含量最多的免疫球蛋白,占血清总Ig的75%-80%,半衰期最长(23天),对血液中大多数传染性介质具有较强的免疫性,并且是唯一一种通过胎盘对婴儿提供体液免疫的抗体。
IG4分子的铰链区较短,且其与FCyRI (CD64)之外的FcγRs结合较弱。IgG4分子不能引起CDC和NK细胞介导的ADCC,但是能引起巨噬细胞介导的ADCP。 来源:Of Studies/医药速览 2023-02-15 编辑人:💧Transparent返回搜狐,查看更多 |
【本文地址】
| 今日新闻 |
| 推荐新闻 |
| 专题文章 |