| 纳米抗体在诊断和治疗方面应用的优势 | 您所在的位置:网站首页 › nbs试剂的作用 › 纳米抗体在诊断和治疗方面应用的优势 |
纳米抗体在诊断和治疗方面应用的优势
|
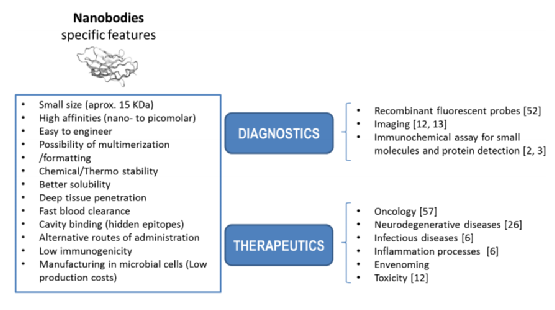
纳米抗体是纳米级别大小的物质,能够提高传统的单克隆抗体理化性能,同时保持其特异的识别位点。本文详述了纳米抗体的主要优势,以及如何调整它们的特征以适用于特定功能 (图2)。
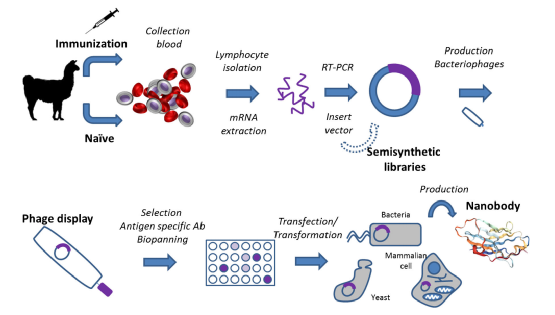
图2:Nbs的独特特点及在诊断和治疗领域的应用 从这个意义上讲,用重组技术获得Nbs的一个主要优点是几个标签可以融合到它们的三级结构中,如His标签,甚至是绿色荧光蛋白(GFP)等荧光标签[8]。此外,纳米抗体还可以大规模生产,产量很高。其结构中缺少轻链,使其具有低免疫原性,在耐热性、展开可逆性、蛋白水解性和高溶解性方面具有更好的稳定性[9,10]。纳米抗体比传统的IgG(150kDa)或其相应的Fab片段(55kDa)或scFV(28kDa)更小(15kDa),后者可以通过化学方法或重组方法制备。这些片段的稳定性较低可能是与相应的IgG相比亲和力较低的原因。这一稳定性低的特点可以被Nbs克服,因为它们具有更高的稳定性和保持纳摩尔范围内亲和参数的能力[11]。 虽然,Nbs目前的应用领域主要与诊断和治疗目的有关[3,12,13],但也被用于生物化学机制的研究以及结构生物学研究。关于诊断,据报道Nbs是一种有效的体内(诊断试剂盒)和体外应用工具(例如用于成像,主要通过添加不同的标签来帮助监测)。另一方面,靶向抗原特异性在治疗应用上是一种非常实用的治疗优势;例如,Nbs是治疗如癌症这类疾病的潜在候选药物,并显示出跨越血脑屏障的潜力[6]。 纳米抗体产品:纳米抗体生产的主要挑战之一是选择和确定制备的最佳工艺。获得包含所需遗传信息的文库对于生成具有高特异性和亲和性的Nbs至关重要。抗原特异化的Nbs可以通过免疫库、天然库或合成库产生[7]。 免疫文库是产生Nbs最常见的选择。它们需要对骆驼科动物(如骆驼、单峰骆驼、美洲驼或羊驼)进行主动免疫。通过抗原诱导免疫产生体外Nbs需要在免疫后从分离的淋巴细胞中提取mRNA[14]。一旦特定序列被扩增并插入到克隆载体中,利用噬菌体显示技术或使用诸如细胞表面显示、mRNA/cDNA显示或MS光谱鉴定等其他方法进行筛选以分离最合适的Nbs[7]。进行这种筛选最常用的策略是基于噬菌体显示选择。主要包括从淋巴细胞中分离mRNA,然后通过PCR扩增成熟Nb序列的编码序列,再加入限制性内切酶位点,将不同的片段插入噬菌体克隆载体中。随后,VHH文库通过感染噬菌体表达系统而产生。最后,需要进行抗原特异性噬菌体选择。选择最合适的克隆后,得到相应的可溶性VHH(图3)。选择最合适的噬菌体展示Nbs是至关重要的。这一步通常使用体外测试(即噬菌体ELISA),结合你要测定的Ag。鉴定阳性噬菌体通常需要两到三轮筛选。但是,如果Nb选择的特异性标准较高,则获得定制Nb所需的轮数可能会增加。在选择之后,相应的Nbs将通过表达系统在体外进行生产。目前这类文库的主要优点在于预期的特异性是由Ag的抗原性决定的。此外,与传统的多克隆抗体和单克隆抗体相比,噬菌体显示技术制备Nbs的速度较快,成本较低。
图3:利用噬菌体展示技术的纳米抗体生产过程 从原始库中选择Nb是通过利用宿主动物本身的自然免疫多样性,而无需免疫[2,12]。因而,需要大量的血液来增加遗传多样性。显然,当寻找识别低免疫原性靶点的特定Nbs时,这种策略是最合适的。此外,这是一种比前一种更为普遍的定向方法,允许从抗原较少的化合物中产生Nbs。在任何情况下,这一过程的成功都取决于采集的血样数量,应考虑到只能获得高特异性的Nbs。其他依赖于半合成/合成库的策略主要基于保持Nbs的共同保守结构和随机改变相应的CDR序列。准备这些类型的库所能引起的多样性程度比依赖于原始库的方法要高。这是因为它们能够在选定的CDR区域引入不同的氨基酸。因此,这些种类的文库被认为是一种可以替换包括动物免疫在内的传统方法的新方法。 关于Nb的获得,可以使用多种不同的表达模式,包括细菌、酵母、真菌、昆虫细胞、哺乳动物细胞,甚至植物宿主[15]。应用最广泛的表达系统是大肠杆菌,它在不同的细胞空间中表达蛋白质。使用这种表达宿主的主要优点是它能够产生可溶性的功能性Nbs,并且生产成本低廉。但是,其与酵母菌或真菌等生物表达系统相比,产量不是很高。另一种常见的用于产生Nbs的方法是利用哺乳动物细胞。这是为治疗目的生产Nbs时最合适的选择,尽管它们的成本、较长的时间要求和复杂的处理过程,使得它不能成为首选方案。其他可能的方法包括使用酵母和真菌,这已经成功地被应用,但生产过程仍然复杂。 此外,与传统单克隆抗体相比,Nbs可以在不同的生物体中表达,这是一个优势,因为它允许插入定制的标签,以低成本和大规模生产。 纳米抗体的独特特征 纳米抗体的独特特性与传统抗体相比具有一些显著的优势,这是值得我们注意的。因为它们结合了单克隆抗体的理想特性和小分子药物的一些有益特性。 ❆它们能结合多种表位,显示在毫微摩尔甚至皮摩尔范围内的亲缘关系。这意味着Nbs的亲和力与传统单克隆抗体相当或优于传统单克隆抗体,达到皮摩尔亲和力常数范围[16,17]。他们已经进化到显示出高度的特异性和亲和力,仅仅呈现出3个CDR而不是6个出现在传统的抗体中[17]。晶体学研究已经报道了[18],Nbs抗原结合环显示一个更大的结构库。此外,CDR3区域通常比单克隆抗体的VH区域长。 ❆程序化或多值化的可能性。考虑到Nbs的小尺寸及其单体性质,可以对其进行基因工程改造,以获得可融合的模块化,从而形成一个新的结构,实现多特异性和多功能性。出于治疗目的,双价和双特异性Nbs是一种非常有吸引力的形式。双价性使得Abs能够以极大的亲和力与多组分的Ags结合,而双价性包括同时与两种不同类型的Ag结合[20,21]。这些类型的免疫抗体可以通过分子工程来生产,在大多数情况下可以得到嵌合抗体。这种选择对于治疗应用和延长这些免疫试剂的半衰期特别有吸引力。他们是高度稳定和可溶性的。 ❆Nbs具有最佳的生物物理和生化特性。Nbs具有最佳的生物物理和生化特性,包括溶解度、耐热性和蛋白水解抗性。CDR3环的折叠和骨架-2区域的亲水性使其在水溶液中溶解度高,且不易聚集[22]。此外,它们具有很高的构象和热稳定性。因此,Nbs在37°C条件下1周后仍保持充分的结合能力[23],热展开行为常被阐述为在90°C条件下长时间孵育后完全可逆[24]。除了耐热性,Nbs在蛋白酶、促溶剂和极端pH的条件下是稳定的[25]。此外,他们可以定制,以绕过细胞内蛋白水解。这种行为,连同它们调节目标活性的能力,使它们成为破坏细胞内Ag活性的完美药剂,产生功能性敲除。为了实现这一目标,已经开发出了内含子,它是重组的Ab片段或Nbs,已在细胞内表达为目标细胞内蛋白。它们对于对抗细胞内病原体或治疗神经退行性疾病非常有用[26]。蛋白水解抗性及其在极端条件下的稳定性也使其适用于其它给药途径(如,口服)。关于将Nbs用于诊断目的,Nbs在高有机溶剂浓度或pH或温度极值下的高稳定性为检测小分子或蛋白质开辟了广泛的应用[27]。这是由于这些物理特性允许使用更有效的固定化方法用于生物传感目的、在预浓缩步骤后在低浓度下分析污染物的可能性,甚至允许一个增加生物识别的动力学在高温下工作。 ❆深层快速的组织渗透,快速的血液清除。由于组织内的被动细胞间扩散速率依赖于分子大小,且与分子大小呈近似反比,因此与传统单克隆抗体(150 kDa)相比,15 kDa单价Nb的穿透性更好。考虑到Nbs可被设计用来修饰或中和致癌分子,将其重定向到特定的细胞间室,或在肿瘤细胞表面表达它们以触发免疫应答[28],这一特性对靶向肿瘤非常有用。由于治疗通常需要高剂量和频繁使用特定的治疗药物,目前已经开发了几种方法来延长HCAbs的半衰期。包括添加聚乙二醇[29],结合白蛋白,或融合到传统Ab的Fc片段。然而,值得指出的是,在某些特定应用中,这种具有Nbs特征的药物能够被肾脏快速清除,极大的避免了毒性作用。此外,由于Nbs体积小,人们对其跨越血脑屏障的能力寄予厚望[3,6]。 ❆识别隐藏的表位。传统Abs的结晶学研究表明,在大多数情况下,抗原结合面是平的或凹的[30]。相反,Nbs常与裂隙和空腔结合(见[31])。缺少可变轻链(VL)与显示扩展的CDR1和更暴露的CDR3的VHH区域相平衡。这些结构的变化允许标准的绑定架构,如平面和空腔,但也包括绑定突出的环路或缝隙的可能性[32]。因此,Nbs的这一特性及其较小的尺寸促进了与传统VH-VL对所不能达到的新表位的相互作用,这也解释了Nb结合和中和传统抗体难以命中的靶点的能力。 ❆免疫原性。骆驼的VHH结构域与人类VH结构域具有高度的同源性,这意味着到目前为止,它们还没有表现出任何意想不到的免疫原性反应,这可能是临床应用的一个潜在问题[2],这可能会成为临床应用的一个潜在问题。然而,仅在长期治疗的情况下,首先将框架2区域人性化是一个安全的选择,以获得与人类VHs相比具有高度同源性的氨基酸序列。考虑到该基因仅包含约380对碱基对,通过直接定点突变就可以实现Nbs的人源化[33]。 ❆生产成本。单克隆抗体是一种大的多聚体蛋白,通常经过翻译后修饰。因此,它们的生产需要复杂的仪器,只有在真核生物系统中才能实现。此外,为了达到临床疗效的治疗,这些分子必须给予大剂量。所有这些要求的结果导致需要使用非常大的哺乳动物细胞培养和漫长的筛选和纯化步骤,造成非常昂贵的生产成本,并限制了它们作为治疗药物的生产。Nbs是解决单抗生产成本问题的一个很好的选择。由于完全恢复了免疫特异性,Nbs可以在微生物系统(如细菌、酵母菌、真菌)中很容易表达,并且可以从展示文库中快速选择。此外,通过使用测序技术,它们对于高通量筛选特别容易管理。所有这些生产和选择的优势导致更低的制造价格。 纳米抗体作为诊断和治疗工具的应用 1 蛋白质和微生物的检测 大多数商业诊断测试是基于某些特定疾病相关的蛋白质的检测,大部分依靠抗体的使用。然而,在某些情况下Ab可能会失去稳定性和生物识别特性。考虑到Nbs一旦固定在固体支架中,其在长时间内具有抗性和稳定性,Nbs可以作为一种很好的替代品[34]。 近年来,基于Nbs的侧流法测定血浆中丛锥虫的感染[35]。检测是通过确定一个经过生物湮没后的特定的生物标志物。免疫接种是用锥虫分泌体的混合物进行的。该选择是通过观察分泌体化合物纳米抗体的MS鉴定做出的。分泌体化合物纳米抗体是由所产生的Nbs结合而成的,在诊断和治疗应用方面具有突出的特点,并可寻找55至70 kDa之间的单个蛋白带的出现。该条带与孔雀鱼的丙酮酸激酶相对应。随后,研制了ELISA试剂盒,并在血浆中进行了成功的检测。最后,建立了基于Nbs的侧流法测定寄生虫血症,灵敏度(79.2±16.2),特异性(91.9±8.8)。采用LFA法和ELISA法测定血浆LOD分别为220 ng/mL和14 ng/mL。 据报道,抗独特型Nbs的生产可用于测定对转基因生物分析有重要意义的Cry1Ab毒素[36]。在这种情况下开发的化验是一种在作物中测试的化学发光免疫性化验。在这种情况下,选择是通过一个高质量亲本文库噬菌体展示。利用抗cry1ab单克隆抗体作为模拟抗原,通过对所述抗体的对位识别,进行生物克隆。当直接应用于谷物样品时,其工作范围为10.49-307.1 ng/mL。 关于细菌的检测,在文献中可以找到一些关于主动免疫蛋白或相关的生物标志物产生Nb的例子。然而,使用亲本库的例子很少。屠呦呦和他的同事报道了其中一种细菌,该细菌产生了用于检测牛奶中单核增生李斯特菌的Nbs,并开发了一种LOD值为104 cfu/mL的夹层免疫分析法[37]。Nbs还可用于监测生物分子,如酶。例如,Zafra和他的同事报告了用从好氧和厌氧微生物中分离的12种纯化酶的混合物进行免疫,这些酶与主要的解毒作用有关[38]。因此,作者利用噬菌体展示方法进行了有效的筛选,同时对免疫抗原混合物的每个单独成分进行了筛选。用这个方法,可产生针对12种目标酶的特异性Nbs。 Nbs已成功应用于生物传感器的开发。生物传感器是生物受体(在本文中为Nb)与传感器紧密接触的装置,传感器将生物识别过程转换为可测量的信号。在此基础上,Campuzano和他的同事开发了一种基于磁性颗粒的竞争性免疫传感器,并使用电化学读数来测定纤维蛋白原[39]。研究了间接和直接两种方式,分别将Nb或竞争对手固定在磁珠上。两种检测结果显示出相似的检测能力,间接的更好,LOD值达到了0.044μg /毫升。 2 小分子检测 生产用于检测低分子量化合物(< 1000da)的抗体需要制备模拟目标分析物理化性质的免疫半抗原[40]。半抗原的制备已成功地用于多种化合物的制备,包括与环境、食物基质和生物样品有关的目标化合物。随后,利用这些半抗原制备了多克隆抗体和单克隆抗体。然而,尽管这些Abs具有优异的分析性能,但使用这些Abs表明,有必要提高其对温度或有机溶剂等重要外源试剂的稳定性,而Nbs对这些外源试剂具有很高的耐受性[41,42]。 第一次尝试生产小分子Nbs时,能够在微摩尔范围内检测到甲氨蝶呤[43]和偶氮酮[44]。当对四溴双酚A[45]进行基于nbb的免疫分析时,检测限被提高到低纳摩尔范围,这使得检测所需的水平成为环境暴露风险评估的一部分。在食品安全方面,Nbs已被用于真菌毒素的测定,并成功地应用于农作物中这些化合物的检测[27]。正是在这些领域,Nbs对温度和有机溶剂的耐受性的优势非常重要,因为它们可以用于不同环境中污染物的检测。因此,Wang et al.[45]和Kim et al.[46]报道了耐有机溶剂浓度高达50%甲醇和DMSO的Nbs的开发方法。Pan及其同事[47]不仅对上述溶剂具有Nb耐受性,而且对丙酮和乙醇也具有Nb耐受性。在所有情况下,Nb的分析参数与在缓冲条件下得到的分析参数相似。关于耐温性,Liu和同事[48]通过与样品一起预孵育来测试Nbs的稳定性。所有检测的Nbs在50℃条件下,5 min后性能保持完好,有的甚至在100℃条件下,5 min后仍可使用。此外,他们还表明,在90°C的温度下,Nbs在75分钟后能够达到60%的活性。关于Nbs在不同酸碱度下的稳健性,也发现了类似的现象。Wang博士和他的同事[45]报道了pH 7.4到10之间的稳定性。 检测低分子量分子通常需要建立直接或间接的竞争性检测方法。因此,需要Ab标记来可视化与相应的目标分析物的结合。考虑到Nbs可以重组表达,在克隆过程中可以加入报告基因标签(如GFP或碱性磷酸酶)作为标记物,保持初始Nb的分析性能不变[49]。最近报道的另一种策略包括使用独特类型的Abs作为替代标记,同时检测目标污染物,并在每十亿分之一的范围内提供LODs[50]。在本文中,这些抗特异性Nbs被固定在免疫层析条带中,目的是建立一种时间分辨荧光免疫层析法测定zearalenone和黄曲霉毒素B1 (APB1)。尽管Nbs具有许多优点,但它们在测定小分子方面还没有得到广泛的应用。因此,关于这类靶标的免疫传感器的发展,文献中仅能找到几个例子。在这方面,Pan和他的同事报道了另一个值得注意的有价值的例子,他们开发了一种电化学免疫传感器来直接测定黄曲霉毒素B1,Nbs固定在修饰过的玻碳电极上,LOD为3.3 pg/mL,可以测量真实样品。该系统可直接测定APB1,无需任何标记。 因此,考虑到其优异的性能,特异性Nbs对小分子的潜在诊断应用仍有待开发。它们体积小、适合生物工程、溶解度高、化学稳定性好,克服了基体干扰,提高了常规Abs的分析能力。 3 成像的应用程序 目前,早期诊断不仅涉及到特异性生物标志物的体外检测,还有其他非常有用的应用。这些包括体内诊断程序,如分子成像技术,临床医生广泛使用用于可视化可能的疾病异常,主要是肿瘤。在此背景下,基于核成像的不同方法正在开发中,如单光子发射计算机断层扫描(SPECT)和正电子发射断层扫描(PET)[12]。体外成像技术对于评价器官和组织的生物分布也很有意义。在这些病例中,免疫荧光是评估和定位感兴趣的生物标志物的主要工具之一。 如果需要在VHH中加入放射性同位素或荧光团,通常使用重组技术。但也有其他的可能性,主要包括化学修饰。值得一提的是,在此背景下Nbs可以设计为变色体。这种Nbs依赖于Nbs等功能结合分子与荧光蛋白偶联的能力。这为Nbs增加了更多的价值,因为可以依靠它们的大小,用于细胞骨架网络或核组件的可视化[51,52]。它们已被证明是作为高分辨率成像探针使用的有用工具。当Nbs功能化需要化学修饰时,应利用正交官能团来控制标记化合物的共轭位置。这些标记分子包括荧光团、酶示踪剂、生物素或不同的药物[53]。因此,考虑到Nbs可以作为很好的示踪剂,它们可以被认为是一个很好的选择,用于靶向肿瘤或其他类型的疾病,如类风湿关节炎。表皮生长因子受体(EGFR)是目前研究的热点之一,它与不同的上皮细胞肿瘤如皮肤、肺、头部和颈部肿瘤直接相关[54]。因此,EGFR是用于肿瘤定位的最佳生物标志物之一,它也可以用于成像应用的放射标记,甚至可以与治疗不同类型癌症的药物结合使用。为了实现这一目标,最常用的方法之一是用放射性同位素99mtechnetium (99mTc)对其进行标记,99mTc广泛用于癌症成像。利用[99mTc(CO)3(H2O)3]+盐对制备的EGFR Nb进行放射性标记,该盐与His-tag具有亲和关系。所得到的生物偶联物用于小鼠的体外测量,以评估其生物分布,并用于SPECT成像,识别EGFR过表达。Nbs与近红外(NIR)染料结合也被用于基于HER2肿瘤生物标志物的癌症成像。Debie和他的同事研究了控制标签结合方法的相关性,以获得最佳结果和改善药物动力学[55]。一方面,nhs激活的NIR标签通过可自由接近的赖氨酸与Nb随机耦合。另一方面,近红外标签是专门耦合到羧基端不成对的半胱氨酸形成二硫键。羧基标记的Nbs的亲和度是通过测量解离常数KD来确定的,KD约为4.5 nM;而随机标记则受共轭过程的影响(KD值在20 ~ 60nm之间)。然而,在体内和体外实验后获得的结果有助于使用标记的Nbs更精确地识别HER2过表达。位点特异性和随机标记的Nbs显示肿瘤快速积累,非特异性摄取低,导致早期肿瘤与肌肉的比值高(注射后3小时HER2阳性肿瘤分别为3.4±1.6和3.5±0.9 (p.i.),而HER2阴性肿瘤 |
【本文地址】