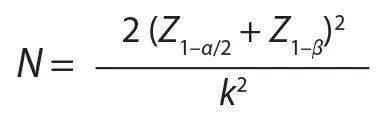| 生物反应器按比例缩小工艺的开发、验证和应用 | 您所在的位置:网站首页 › kone模型 › 生物反应器按比例缩小工艺的开发、验证和应用 |
生物反应器按比例缩小工艺的开发、验证和应用
|
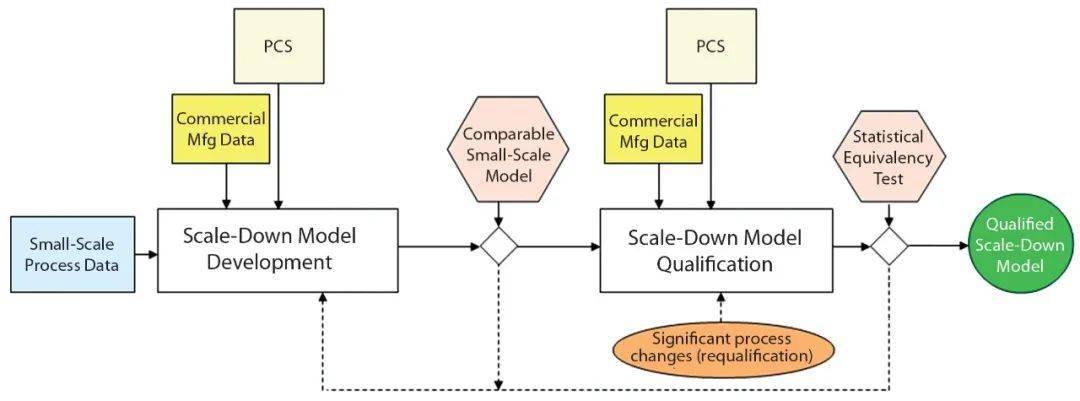
图1 开发和验证大规模反应器工艺流程的缩小模型的方法,PCS:过程控制策略。 1 材料和方法 细胞培养 我们在工作容积为12升的15升搅拌罐生物反应器中繁殖了在大孔微载体上表达重组治疗药物的中国仓鼠卵巢(CHO)细胞。这些培养物以灌注模式运行约65天。在接种后以间歇模式短暂生长后,系统将培养基连续注入生物反应器中以提供营养,同时使用专有的细胞分离设备去除收获液,以收集目标产物并减少代谢废物的积累。细胞分离装置利用重力从上清液中分离出微载体(附着细胞)。 依次使用两种不同的专有培养基为培养提供营养(例如氨基酸和维生素)。一种培养基类型用于培养的五天生长阶段,在此阶段细胞达到生产的目标密度。在从生物反应器中收获产品的同时(约60天),我们在剩余的培养中使用了第二种培养基。在下游纯化加工之前,将产品连续收获到收集容器中。监控温度、pH和溶氧(DO)等参数并将其控制在目标设定点。 使用pH探头将培养物的pH值保持在所需的操作范围内,并根据需要使用分析仪针对每日离线pH测量值进行校准。溶氧探头用于将DO设定值维持在50%,并且所产生的氧通气速率是细胞生长的次要指标。此外,我们使用了pCO 2 探头来监测培养并控制pCO 2 范围。具有反馈控制功能的自动化系统可监控和控制pH、DO、温度和通气。我们通过这种系统设置了灌注控制(连续流加和收获)。除了生物反应器容器、叶轮尺寸、细胞分离装置尺寸和收获收集容器尺寸以外,所有这些参数均与大规模反应器匹配。 分析方法 我们通过离线测量评估了细胞的生长、代谢和生产力。全自动细胞计数仪测量细胞密度和活力。在获得细胞计数之前,我们用一种酶处理了从生物反应器中收集的细胞培养上清样品,以将细胞从其微载体中分离出来。生化分析仪生成了葡萄糖、乳酸、谷氨酰胺和谷氨酸的细胞代谢。我们使用光度酶活性测定法测量了蛋白质生产力。并使用适当的分析工具评估用合格的按比例缩小的纯化模型纯化的药物物质,以选择CQA,例如比活、糖基化谱图和电荷变体等等。 模型开发 下 图2展示了我们开发缩小模型的总体方法。由于减少了12L生物反应器的体积,因此我们对种子培养过程进行了较小的调整。尽管对于大多数种子培养来说,可以保持相同的容器大小,但我们减小了容器大小,以适应按比例缩小的生物反应器。但是,我们将与种子相关的所有其他参数(例如,传代次数和放大标准)保持与大规模培养参数相同。
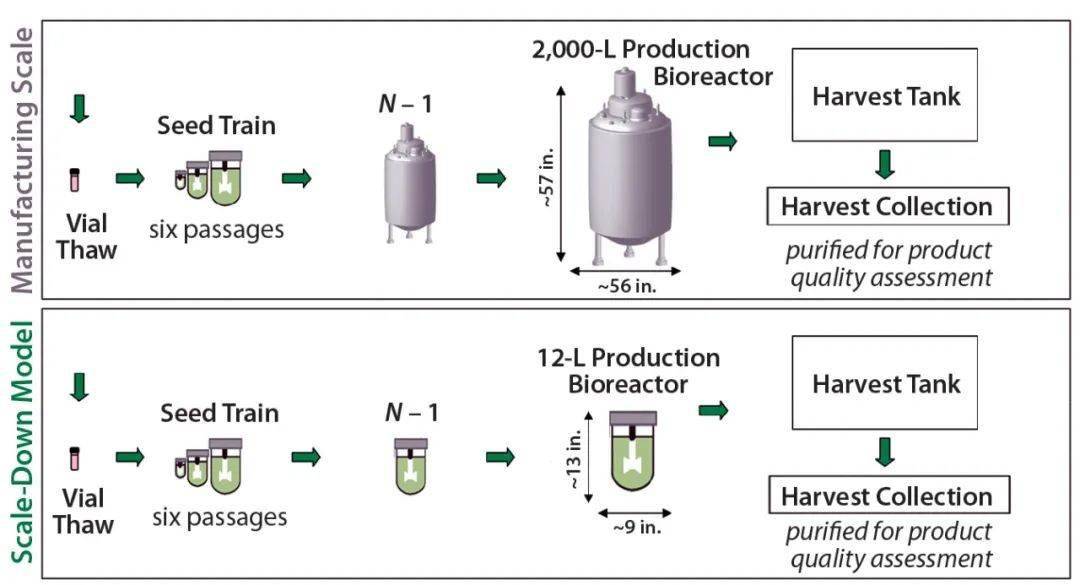
图2 开发和验证12升缩小模型所遵循的方法 除了种子培养容器和生产容器外,我们还相应地缩小了细胞分离装置的尺寸。在按比例缩小的模型中,它和生物反应器容器都是玻璃制成的,而大型设备是不锈钢。为了收集细胞上清,我们使用小规模塑料袋,而大规模使用不锈钢容器。 两种大小容器之间的另一个物理差异是搅拌叶轮配置。12升反应器使用双叶轮,2000升生物反应器配备有一个大耳式叶轮。缩小模型中的双叶轮解决了两个规模之间的液体高度与容器直径之比的差异。此外,2000升和12升生物反应器之间的叶轮直径比约为10:1,两个规模之间的叶轮与水箱直径的比约为1.6:1。 在模型开发过程中,我们研究了两个主要参数:搅拌速度和通气配置。基于P/V或搅拌桨尖端速度与大规模过程的匹配,我们评估了几种搅拌速率,以确定可比的细胞培养性能的最佳速率。将pCO 2 控制在范围内至关重要,因为高水平会影响细胞培养性能。在大规模开发过程中,高pCO 2 水平已显示出会影响细胞培养的状态。 为了在两个规模之间对比pCO 2 水平,我们评估了几种通气配置。首先,我们测试了单个通气元件,既向细胞供应氧气,又提供氮气供应,以从培养物中分离CO 2 (以将pCO 2 维持在所需范围内)。但是,由于氧气和氮气之间的竞争,很难用单个通气元件控制CO 2 的水平。因此,我们随后评估了与大规模反应器配置相匹配的双通气配置,其中两个通气元素为培养物提供了独立的氧气和氮气。 小型模型中的其他过程控制参数根据其过程控制策略遵循了大规模工艺过程。然后,我们将小规模模型生成的数据与大规模过程中的数据进行了比较,以评估某个参数是否需要进一步优化。 模型的验证 成功开发了12升比例缩小模型后,我们进行了验证研究。至少三个小规模运行生长、生产力和新陈代谢方面表现出与大规模工艺流程相当的性能时,我们认为该模型已完全开发成熟。为了计算统计上合格的缩小模型所需的运行次数,我们使用了以下样本大小公式:
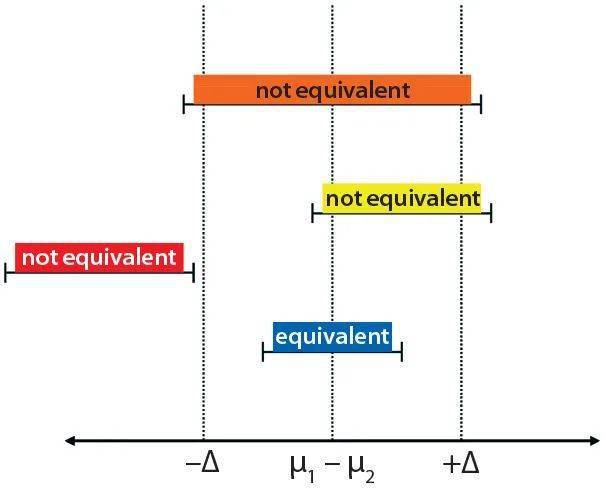
其中N=运行次数;α=置信水平(α=0.1表示90%置信水平);1–β=功率;Z=累积标准正态分布函数的反函数;k =标准偏差数。该计算基于两个大规模的标准偏差:功效数为0.9(β=0.1)和置信度为90%。根据该方程式,我们确定需要进行五次运行才能证明在两个标准偏差内与大规模反应器相当。 接下来,我们根据上面“细胞培养”部分提供的描述执行了五个生物反应器运行的实验。在最初的10天中每天对培养物进行采样,然后在剩余的55天中每周进行3次采样。为了确定当量值,我们将抽样日获得的数据与来自大规模的信息进行了统计比较,监测了代表细胞生长、代谢和生产力的五个细胞培养参数:活细胞密度(VCD)、葡萄糖浓度、乳酸浓度、葡萄糖中的乳酸(比例)和容积生产率(VPR)。这五个参数是代表反应器培养工艺表现的最关键指标。 统计分析 我们应用了TOST等效分析来验证我们的12升比例缩小模型。这是一种成熟的统计工具,用于确定两个数据集之间的统计等效性。在所有采样日均进行了TOST分析,以确定从12升生成的数据是否在统计上等同于大规模反应器。我们使用预定义的公差范围(–Δ,Δ)来确定两组数据是否可比,公差极限为两个标准差。下 图3说明了可能的等效结果。
图3 数据集被认为是等效的(蓝色条形)和非等效的(红色,橙色和黄色条形);当组均值之间的差异在预定义的公差范围(±Δ)内时,则认为数据集在统计上是等效的。 数据集被确定为是统计上等效当在组中的差异的90%置信区间(μ1-μ2)是耐受性的限制(±Δ)内。如果在验证期间出现三个以上连续的失效点,则需要进行论证。否则,参数被认为是不等价的。 2 结果和讨论 12L比例缩小模型的开发 下 表1总结了在12L比例缩小模型的开发过程中考虑的比例相关和比例无关的参数。与规模无关的变量(DO、pH、温度和接种密度)均与大规模变量相匹配。我们没有直接控制pCO 2 的水平,pCO 2 是另一个与规模无关的变量。需要更全面的研究来评估不同的氮气通气配置和针对pCO 2 的放气策略以及范围(详细信息如下)。对灌流细胞培养过程更特定的其他与比例无关的参数包括灌流速率和培养物在细胞分离装置中的停留时间。通过设计与那些重要的灌注参数相匹配的小型细胞保留设备,我们将这些设置与大规模的设置相同。我们还在两种规模上使用了相同的培养基。广泛评估了搅拌速度(取决于比例的变量),下面将详细讨论结果。
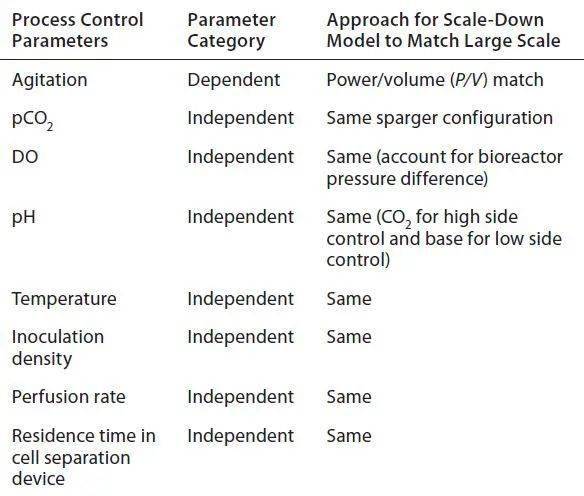
表1 在开发12L缩小模型时考虑的与比例有关和与比例无关的参数。 参数优化,搅拌: 在开发12升比例缩小模型期间广泛评估了搅拌速率。由于小规模和大尺度之间的容器大小和几何形状(例如,高度:直径比)不同,我们必须确定最佳的搅拌速度,以保持微载体悬浮在培养物中,向细胞提供足够的氧气转移,并获得生长特性与大规模的类似效果。由于该细胞系对剪切敏感(与一般的大多数微载体培养一样),我们测试了许多搅拌策略,包括常规的按比例放大/按比例缩小方法,例如匹配转头速度或P/V,以及采用了更为保守的方法保持微载体悬浮在生物反应器中所需的最小搅拌速率测试。 我们在12L刻度上评估了四种搅拌速度,包括65rpm(尖端速度与大型刻度匹配),47rpm(P/V匹配大尺寸),以及24rpm和32rpm(确定为代表12升模型的下边界)。以24rpm的速度运行使大量细胞沉淀在12L生物反应器中,表明混合不足以使微载体悬浮在培养物中。我们观察到在32rpm时具有大量细胞和微载体聚集体的非均质培养,也消除了12L规模的可能的搅拌速度。我们测试的两种较高的搅拌速率均产生了良好悬浮的培养物,因此我们比较了相应的细胞生长曲线,以确定小规模的最佳搅拌速率。以65rpm(尖端速度匹配)的操作导致从微载体分离的悬浮细胞数量增加,这可能是剪切力增加的结果。最后,我们确定47rpm(P/V匹配)是12L规模的适当搅拌速率,以提供足够的氧气转移,足够的微载体悬浮液以及可比的大规模生长和生产率特征(如下 图4)。P/V通常是微载体培养的适当缩放参数。
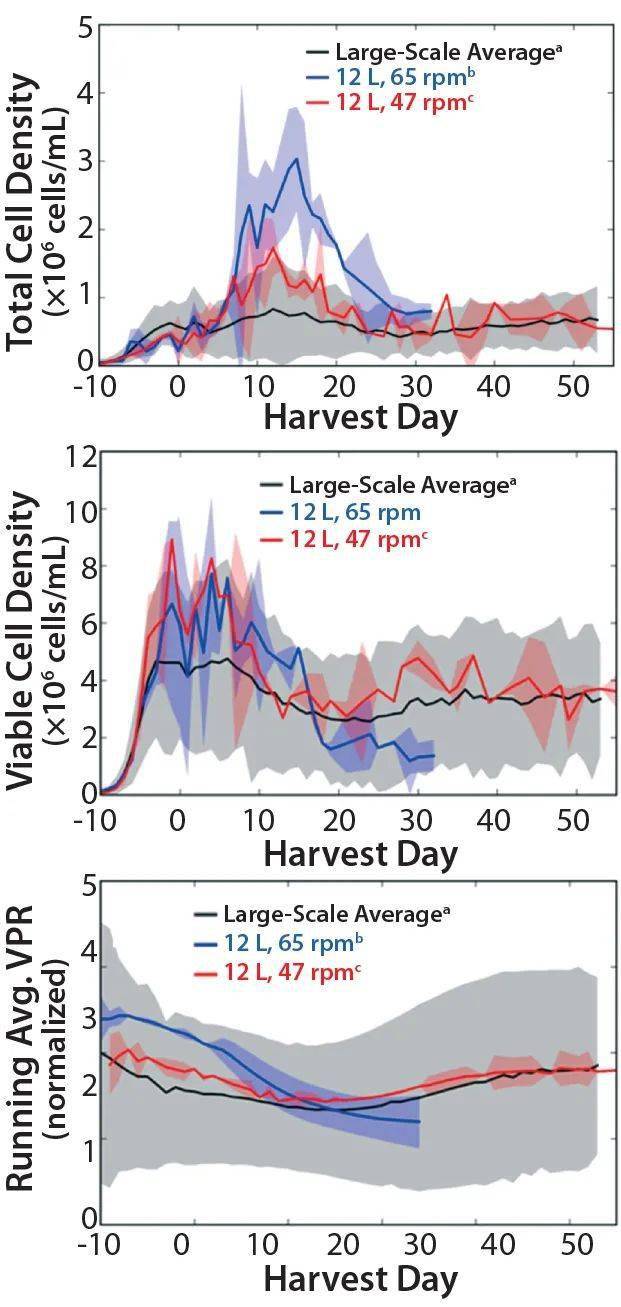
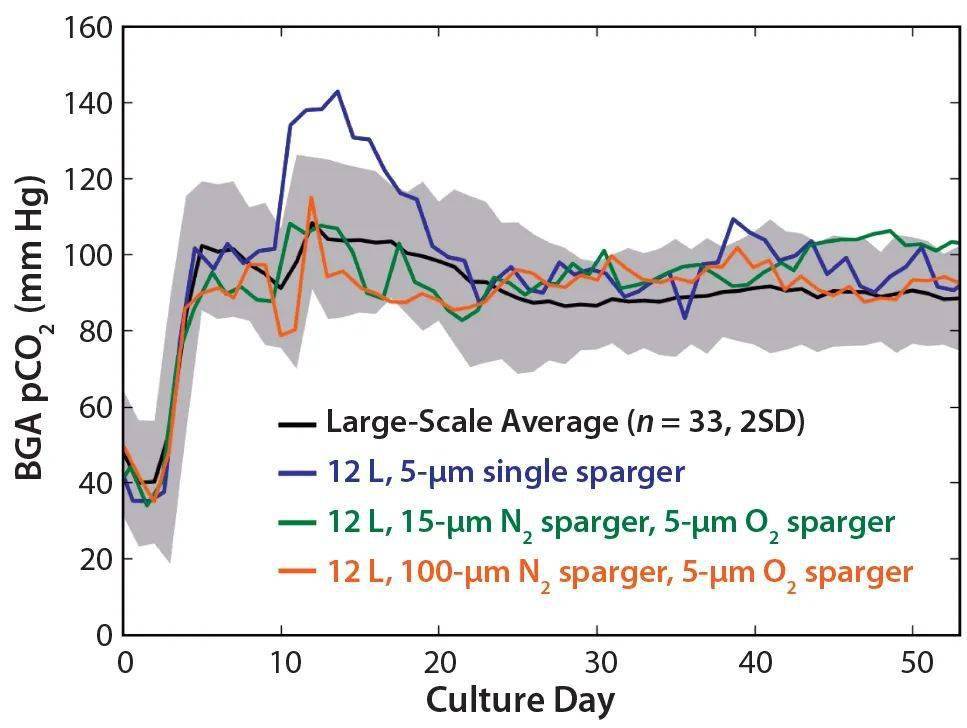
图4 (上图)悬架总细胞密度,(中图)活细胞密度(VCD)和(下图)归一化运行平均体积生产速率(VPR),用于大规模平均(Ñ=33),12L平均65rpm(n=2)和12L 47rpm平均(n=3);65rpm的12L运行由于培养性能差而提前终止。对于每个相应参数,将归一化的运行平均VPR轮廓归一化为大规模的最大平均值。阴影区域代表所有三个参数均值的两个标准偏差。 参数优化,pCO2 尽管pCO 2 级别被归类为与比例无关的变量,但它不是可以直接控制的参数,而是必须通过放气策略进行操作。为了匹配为大规模过程建立的pCO 2 目标范围,我们研究了氧气和氮气通气的机械结构,以确定12升比例缩小模型的最佳策略。 首先,我们评估了一个5μm的单一通气元件,可为培养物提供氧气和氮气,以保持DO含量并从培养物中去除CO 2 。如下 图5所示,单个通气元件允许超出大型反应器升高的CO 2 水平。随后,我们评估了两个通气元件,以匹配大型构造,并向培养物提供独立的氧气和氮气。
图5 BGA pCO2曲线代表大规模平均值(n=33);具有5μm单通气的12L模型;12L模型15微米;2通气和5μm的直径:2个通气的12L模型100μm的通气和5μm的直径。阴影区域表示与平均值的两个标准偏差。 对于氮气通气,我们测试了两个孔径(15μm和100μm),以保持与大规模相似的pCO 2 和氧分布。对于氧气通气,我们进行了传质研究,以了解12L模型中的氧气传递动力学,确定孔径为5μm的通气产生的体积氧气喷射曲线类似于大规模生物反应器。 图5还显示了双通气配置和不同的氮气通气孔径对pCO 2 分布的影响。结果表明,无论氮气通气的孔径如何,氧气和氮气的独立输送都可以匹配较大的pCO 2 范围。在两个孔径之间,我们为模型选择了100μm的氮气通气孔径,因为它可以更有效地从培养物中去除CO 2 。该通气元件降低了液面上的氮气喷射流速和总泡沫水平,在较高的水平下可能会对细胞培养产生负面影响。 模型开发结果 下 图6描绘了VCD、平均VPR和葡萄糖比率产生的乳酸的产率,以进行代表性且成功的研究开发。我们将葡萄糖曲线中的平均VPR和乳酸产量标准化为在培养过程中计算出的大规模平均值的最大值。12L显影运行的红色阴影区域和大规模运行的灰色阴影区域表示两个相对于各自平均值的标准偏差。显示的细胞培养参数反映了灌注培养过程的两个阶段。
图6 (上图)活细胞密度(VCD),(中图)归一化的运行平均体积生产率(VPR)和(下图)葡萄糖曲线的乳酸产量(针对已开发的12L缩小模型平均值)(n=3)和大规模平均值(n=33);每个参数的12L模型开发平均值均被标准化为大型平均值的最大值。阴影区域表示所有三个参数均值的两个标准偏差。 细胞在过渡期的另外五天之前生长了约五天,在此期间将生产培养基灌注到生物反应器中。之后,开始收获阶段,并收集产品用于下游加工。生产培养基比生长培养基“更稀薄”,这解释了随着培养物从生长过渡到收获和收获阶段而观察到的动态细胞培养概况。我们开发研究的结果证实,在12升比例缩小的模型中,实施47rpm的搅拌速度和孔径为100μm的第二个通气用于氮气喷吹时,产生的生长、生产率和代谢曲线与大规模的过程相似。 3 12L规模缩小模型的验证 成功地按比例缩小模型资格要求至少五个完整的12L生物反应器运行中的关键属性在统计上等同于相关大型生物反应器运行。为了验证细胞培养物按比例缩小的模型,我们评估了细胞培养物的生长、代谢和生产力,以使用TOST分析确定等效性。我们还根据不同表征参数的接受标准评估了纯化材料的产品质量。进行了五个并行的生物反应器运行以进行验证研究。 细胞培养结果 下 图7显示了为证明统计等效性而评估的五个细胞培养参数中的三个。在每张图中,大公差范围在y轴上归一化为+1(最大)和–1(最小),用灰色阴影区域表示。每个数据点也分别进行了归一化,代表了每个采样日小规模(12L验证运行)和大规模运行的平均值之间的比例差异。误差线表示每天大规模和12L规模之间的组均值差异的90%置信区间。
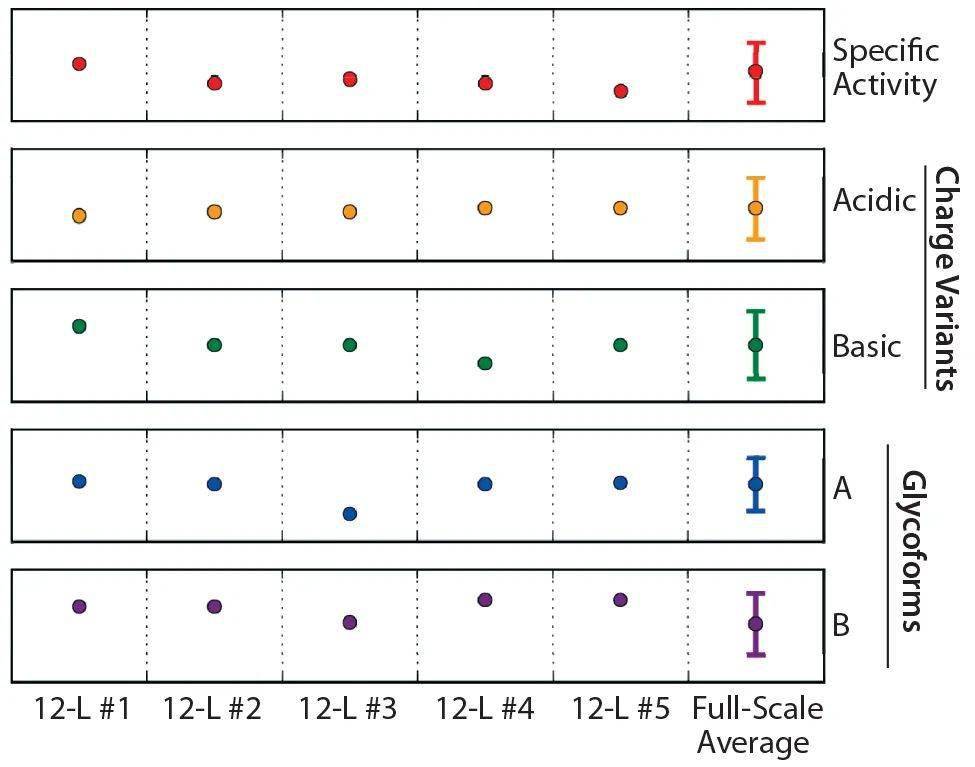
图7 12升验证平均值的标准化(上图)活细胞密度(VCD),(中图)容积生产率(VPR)和(下图)葡萄糖浓度曲线(n=5,90%置信区间,CI)可接受的公差范围;将轮廓归一化为在y轴上的+1/-1和灰色阴影区域表示的大规模公差范围。每个数据点代表12L小规模和大规模均值之间的比例差,误差线代表两组均值之差的90%置信区间。红色数据点表示超出公差范围的数据。 在图7(上图)中,VCD曲线用红色显示了两个不满足接受标准的连续数据点。如上所述,我们认为在缩小模型的验证过程中最多出现三个连续失败是可以接受的。因此,两个连续的VCD故障仍在我们的资格接受标准之内。 图7(中图)中的VPR曲线表明,所有小规模数据点均在容差范围内。这成功地建立了它们与大规模数据的等效性。 图7(下图)显示了葡萄糖浓度曲线。三个连续的葡萄糖浓度数据点超出了公差极限,由红色数据点指示。但是,基于上述“三个最大”参数,我们认为这是可以接受的。 我们对乳酸盐浓度和葡萄糖的乳酸盐产率的评估也证明了统计等效性(数据未显示)。数据表明,所有参数均已成功建立了大规模流程和缩减模型之间的等效关系。 产品质量结果 在整个收获阶段,从五个12L生物反应器中收集蛋白质产物。与为大规模过程建立的方法类似,将收集的细胞上清收集起来。每个代表性的小规模收获物收集物都包括从早期、中期和晚期培养物中收集的三到四天的收获物。使用类似于大规模过程的策略将上清物料合并,并纯化以生产原液(DS)。我们将这种材料与大规模的历史范围进行了对比,并与产品放行的接受标准进行了比较,针对从我们五个合格的12升生物反应器中获得的原液,评估了为大规模DS批量释放而分析的所有产品质量属性,如下 图8。
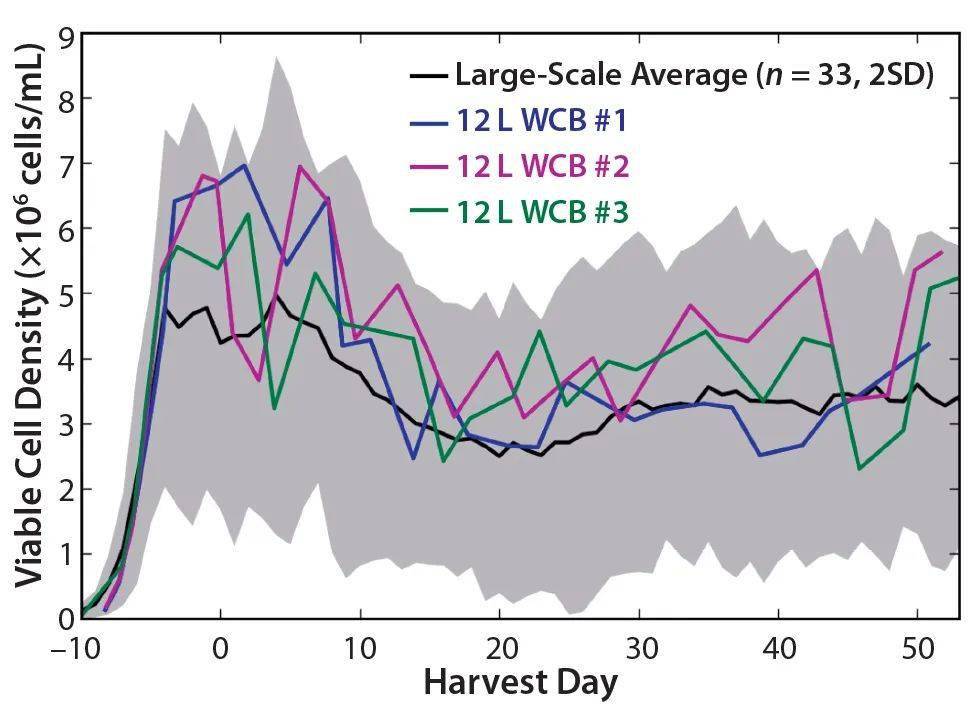
图8:从每次12 L鉴定运行中获得的纯化材料的标准化临界质量属性(CQA)数据(n=5);大规模数据上的误差线表示每个特定产品质量属性的接受标准。 4 缩小模型的应用 开发一个合格的缩小模型建立与预测基于从与模型所进行的实验结果大规模演出的能力。此类模型的应用包括探索原材料(例如,评估培养基添加剂对细胞培养性能的影响,鉴定关键原材料)以及支持大规模过程故障排除和偏差调查(例如,在实施GMP之前对新的GMP细胞库进行鉴定)。一个合格的尺度缩小的模型也可以用来建立有关用于进一步表征验证(细胞培养的性能变化的过程控制参数的更多知识)。 也应考虑缩小模型的局限性。并非所有按比例缩小的模型过程参数都可以与大规模的模型参数匹配,因此在设计研究以支持大规模时应谨慎考虑。仅仅由于尺度差异,与容器几何形状差异和剪切力有关的一些限制将难以匹配。尽管尝试使用不同的常规缩放策略(例如P/V或叶尖速度匹配)来按比例缩小搅拌速率,但为按比例缩小系统选择的搅拌速率可能无法再现大型系统的相同流体动力学和混合特性,这可能会导致生物反应器中湍流模式的变化。 气体通气/充气是另一个很难在大型和小型模型之间进行匹配的主要参数。由于液体的表面体积比不同,在小规模模型中,CO 2 排出通常更为有效。这就产生了不同的氮气通气要求,以使两个规模之间的pCO 2 水平匹配。由于生物反应器的几何形状不同,在生物反应器中的气泡停留时间在大尺度和小尺度之间也不同。 由于按比例缩小模型中的通气要求和搅拌策略不同,因此小尺寸和大尺寸通常承受的剪切力不同。对于剪切敏感细胞系,这可能会产生不同的培养性能。对于那些研究混合特性以及气体通气和剪切力对给定系统的影响的人来说,计算流体动力学可以是帮助弥合小规模和大型规模之间差异的重要工具。 新细胞工作库(WCB)的评估 使用合格的按比例缩小模型的一种应用是在大规模实施之前评估新WCB。我们使用合格的12L缩小模型评估了三个新的WCB。下 图9显示了这三个WCB的VCD配置条件。每个新工艺的增长曲线与大规模工艺增长曲线相当,此处未显示的其他参数(包括生产力和新陈代谢)也是如此。将合格的模型应用于新的WCB评估可以确保新生成的GMP WCB在大规模实施之前将按预期执行。
图9 大规模平均值(n=33),12升工作细胞库(WCB)#1、12升WCB#2和12升WCB#3的活细胞密度(VCD)曲线;大规模平均值的阴影区域表示与平均值的两个标准偏差。 缩小模型建立结果 我们成功开发了一个12升的缩小模型,以匹配2000升的细胞培养性能。随后通过证明与大规模工艺过程在与细胞生长、生产力和代谢有关的五个关键细胞培养性能指标的统计等效性上证明了开发的模型的合格性。所有产品质量属性都是可比较的,并且在可接受范围内。尽管在两个量表上都建立了统计等效性,但是在使用这种模型进行制造支持研究时,应考虑使用12升合格的按比例缩小模型。此后,我们已将合格的模型用于评估用于制造实施的新WCB,并将继续提高对为将来的特性研究和支持而生成的数据的信心。 参考: 1 、SeeleyJE, Seely RJ. A Rational, StepWise Approach to Process Characterization.BioPharm Int. 16(8) 2003: 24–34. 2、 Li F, et al. Cell Culture Processes for Monoclonal Antibody Production. MAbs2(5) 2010: 466–477. 3、 Venkat RV, Chalmers JJ. Characterization of Agitation Environments in 250-mLSpinner Vessel, 3-L and 20-L Reactor Vessels Used for Animal Cell MicrocarrierCulture. Cytotechnol. 22, 1996: 95–102 4、 Michaels JD, Mallik AK, Papoutsakis ET. Sparging and Agitation-Induced Injuryof Cultured Animal Cells: Do Cell-to-Bubble Interactions in the Bulk LiquidInjure Cells? Biotechnol. Bioeng. 51(4) 1996: 399–409. 5、 Chisti Y. Animal-Cell Damage in Sparged Bioreactors. Trends Biotechnol.18(10) 2000: 420–432. 6、 Rao DG. Introduction to Biochemical Engineering (2nd Edition). Tata McGrawHill: New Delhi, India: 2010. 7 、Kelley WJ. Using Computational Fluid Dynamics to Characterize and ImproveBioreactor Performance. Biotechnol. Appl. Biochem. 49(4) 2008: 225–238. 8、 Fang Z. Applying Computational Fluid Dynamics Technology in Bioprocesses,Part 2: Computational Fluid Dynamics Can Resolve Performance Problems. BioPharmInt. 23(5) 2010: 42–52. 9、 Bezzo F, Macchietto S, Pantelides CC. General Hybrid Multizonal/CFD Approachfor Bioreactor Modeling. AIChE J. 49(8) 2003: 2133–2148. 10、 Julien C, Whitford W. Bioreactor Monitoring, Modeling, and Simulation.BioProcess Int. 5(1) 2007: S10–S17. 11、 Alam MNHZ, Razali F. Scale-Up of Stirred and Aerated BioengineeringBioreactor Based on Constant Mass Transfer Coefficient. J. Teknol. 43(F) 2005:95–110. 12、 Garcia-Ochoa F, Gomez E. Bioreactor Scale-Up and Oxygen Transfer Rate inMicrobial Processes: An Overview. Biotechnol. Adv. 27, 2009: 153–176. 13、 Li F, et al. A Systematic Approach for Scale-Down Model Development andCharacterization of Commercial Cell Culture Processes. Biotechnol. Progr. 22(3)2006: 696–703. 14、 Chen C, et al. Statistical Equivalence Testing for Assessing Bench-ScaleCleanability: The Two-One-Sided T-Test Compares the Equivalency of Two DataSets. BioPharm Int. 23(2) 2010: 40–45. 15、 Barker LE, et al. Assessing Equivalance: An Alternative to the Use ofDifference Tests for Measuring Disparities in Vaccination Coverage. Am. J.Epidemiol. 156(11) 2002: 1056–1061. 16、 Cherry RS, Papoutsakis ET. Physical Mechanisms of Cell Damage inMicrocarrier Cell Culture Bioreactors. Biotechnol. Bioeng. 32(8) 1988:1001–1014. 17、 Croughan MS, Hamel JF, Wang DIC. Hydrodynamic Effects on Animal Cells Grownin Microcarrier Cultures. Biotechnol. Bioeng. 95(2) 2006: 295–305. 18、 Hu WS. Quantitative and Mechanistic Analysis of Mammalian Cell Cultivationon Microcarriers (doctoral dissertation). Massachusetts Institute ofTechnology: Cambridge, MA, 1983. 19、 Barngrover D, et al. Continuous Settling Apparatus. US Patent 5,733,776; 31March 1998. 20、 Zhu M, et al. Effects of Elevated pCO2 and Osmolality on Growth of CHO Cellsand Production of Antibody-Fusion Protein B1: A Case Study. Biotechnol. Progr.21(1) 2005: 70–77. 21、 Chow S, Shao J, Wang H. Sample Size Calculations in Clinical Research (2ndEdition). Chapman and Hall/CRC Press: Boca Raton, FL, 4 March 2003. 22 、Western Electric Company. Statistical Quality Control Handbook (2ndEdition). Mack Printing Company: Easton, PA, 1958;www.contesolutions.com/Western_Electric_SQC_ Handbook.pdf. 23、 Gray DR, et al. CO2 in Large-Scale and High-Density CHO Cell Perfusion Culture.Cytotechnol. 22(1–3) 1996: 65–78. 版 权 声 明 本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系([email protected]),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。返回搜狐,查看更多 |
【本文地址】