| 【科技前沿】Nat Commun丨武汉大学梁毅团队揭示miRNA对PrPᶜ相分离、肌肉细胞自噬及分… | 您所在的位置:网站首页 › 朊病毒最新研究进展 › 【科技前沿】Nat Commun丨武汉大学梁毅团队揭示miRNA对PrPᶜ相分离、肌肉细胞自噬及分… |
【科技前沿】Nat Commun丨武汉大学梁毅团队揭示miRNA对PrPᶜ相分离、肌肉细胞自噬及分…
|
北京时间2023年12月8日,Nature Communications 以长文(Article)形式在线发表了武汉大学梁毅教授团队的最新研究成果。 研究人员全球首先在肌病患者的骨骼肌样本中观察到了miR-214-3p与细胞型朊蛋白(PrPC)的过量积累和共定位现象,揭示了miRNA对PrPC相分离、肌肉细胞自噬及分化调控机制,为发展新的针对miRNA与PrPC过量积累的肌病治疗药物奠定了基础。  细胞型朊蛋白(PrPC)因其病理型朊病毒蛋白(PrPSc)引发一类神经退行性疾病-prion疾病-而臭名昭著。尽管科学家们在其错误折叠导致的神经退行性疾病背景下进行了深入研究,但迄今为止细胞内源PrPC的生理功能知之甚少。 PrPC是一种糖基磷脂酰肌醇锚定的糖蛋白,在神经和包括骨骼肌在内的非神经组织中表达,PrPC和PrPSc能在肌肉细胞中大量累积,并且PrPC的过表达或缺失对肌肉有不利影响。PrPC在肌肉生理和疾病中发挥作用,在几种人类肌病中,已发现骨骼肌细胞中PrPC存在上调和/或重新分布,这些变化包括包涵体肌炎和神经源性肌肉萎缩个体肌肉中PrPC表达增加。尽管许多骨骼肌疾病在临床和病理表现上有所不同,但它们都有一个共同的特点,即miRNA表达失调。PrPC通过与AGO相互作用促进miRISC复合物(包含TNRC6蛋白和靶向mRNA)的组装或稳定,增加AGO、TNRC6和miRNA抑制的mRNA的关联。 在野生型朊蛋白及其病理突变体E196K淀粉样纤维和野生型铜锌超氧化物歧化酶(SOD1)淀粉样纤维冷冻电镜结构及功能前期工作(2020年6月8日、2021年9月9日和2022年6月17日分别发表于《自然—结构与分子生物学》(Nat. Struct. Mol. Biol. 2020, 27, 598-602)、《科学—进展》(Sci. Adv. 2021, 7, eabg9676)和《自然—通讯》(Nat. Commun. 2022, 13, 3491)中,梁毅与刘聪团队合作解析了全长野生型朊病毒蛋白纤维、全长E196K纤维和类朊病毒蛋白野生型SOD1纤维的结构,首次在原子水平上揭示了朊蛋白由细胞型朊蛋白(PrPC)向病理型朊病毒蛋白(PrPSc)结构转变的机制,揭示了朊病毒蛋白病理聚集多态性的分子机制,揭示了渐冻症(ALS)致病蛋白质SOD1构象转化分子机制。PrPC和miRNA在细胞中都具有重要的生理功能,然而miRNA到底是怎么调控PrPC相分离、肌肉细胞自噬及分化的仍是困扰科学界的谜题。 “液-液相分离(LLPS)研究为细胞生物学带来革命性的进展,神经退行性疾病相关重要蛋白质的相分离研究有着广阔的科研前景。”论文作者指出。 六个独立的研究组已通过使用大肠杆菌中表达纯化人或小鼠的重组PrPC在体外对PrPC的相分离能力进行了表征,但迄今为止,还没有活细胞中PrPC液-液相分离的研究。 梁毅介绍,为了阐释miRNA对PrPC相分离、肌肉细胞自噬及分化调控机制,在这项研究中,研究人员在细胞和病理样本水平上开展了PrPC在肌病患者肌肉中的累积与作用机制的研究,在分化中的C2C12细胞中内源的PrPC和特异性结合的miR-214-3p表达并发生共定位, 在皮肌炎(DM)、神经源性肌病(NM)、肌营养不良(MD)等具有再生肌纤维的肌病患者中也存在大量表达与共定位。 进一步研究发现,肌肉细胞过量累积的PrPC增强其特异性结合的miRNA与下游靶mRNA的作用来抑制自噬,从而抑制肌管分化,加重肌病。这些特异性结合的miRNA在体外和活的C2C12肌肉细胞中能够促进PrPC发生液-液相分离,这种异常的相分离在C2C12肌肉细胞中加重PrPC的累积,PrPC转变为不溶于sarkosyl的纤维状凝聚物,并引起肌管细胞死亡。 肌管破坏后,新的卫星细胞分化为成肌细胞,但过量积累的PrPC会抑制其分化为肌管,这样的一个恶性循环,导致了这些肌病中具有很多不完全再生的肌管,进而导致肌肉萎缩,这一发现首次揭示了受特异性结合的miRNA调控的PrPC在肌病中的致病机制。 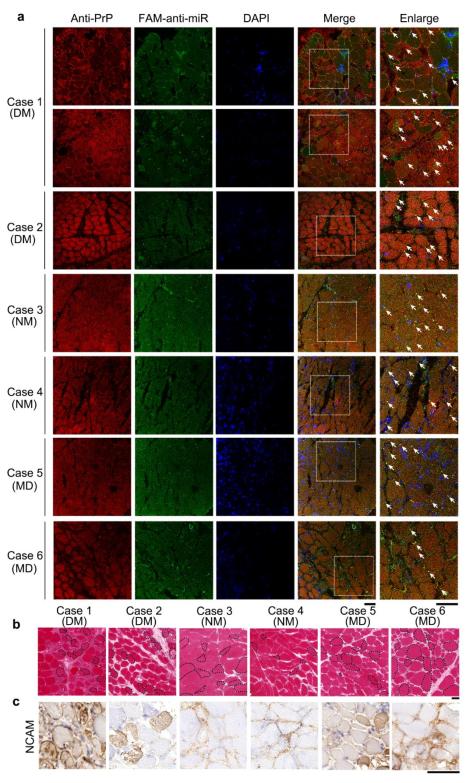 图1:在6例肌病患者的骨骼肌样本中观察到了miR-214-3p与PrPC的过量积累和共定位现象 通过CRISPR-Cas9技术、激光共聚焦显微、免疫印迹和RIP-seq等方法,研究人员发现,PrPC在C2C12肌肉细胞分化中逐渐表达,并且随着细胞分化会从细胞膜上转移到细胞质中发挥作用。敲除PrPC、过表达PrPC以及过表达PrPC定位发生改变的病理突变体F198S后,C2C12肌肉细胞都不会发生分化,且过表达PrPC能够抑制分化过程中的细胞自噬。在C2C12细胞分化中期的内源PrPC和过表达的PrPC都能选择性地结合一类成熟的miRNA,并且这些miRNA富集于自噬与分化生物进程中。有趣的是,在正常分化时候PrPC特异性富集的miRNA大多能够促进细胞自噬或者促进肌肉细胞分化。而过表达PrPC时,PrPC特异性富集的miRNA大多数抑制细胞自噬或者抑制肌肉细胞分化。 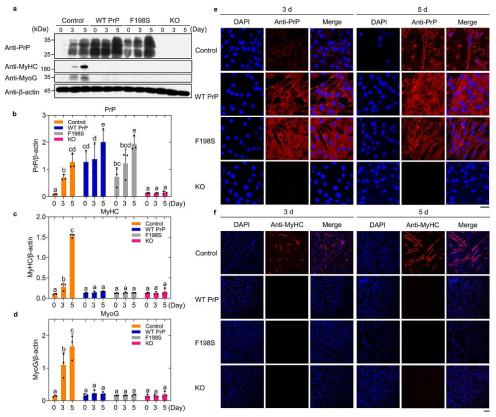 图2:敲除PrPC、过表达PrPC以及过表达PrPC定位发生改变的病理突变体F198S后,C2C12肌肉细胞都不会发生分化 该研究证明了PrPC在活细胞中能够发生液-液相分离,揭示了在体外和细胞内,这些特异结合的miRNA可以促进PrPC的相分离,并导致PrPC形成纤维状的凝聚物在细胞中沉积,从而降低细胞存活率,首次揭示了miRNA对PrPC相分离、肌肉细胞自噬及分化的调控机制及其在肌病中的作用,并使得发展新的针对miRNA与PrPC过量积累的肌病治疗药物成为可能。 武汉大学生命科学学院梁毅教授为该论文通讯作者,武汉大学生命科学学院博士生陶菁为第一作者。武汉大学人民医院神经内科副主任医师曾艳平博士、广东省科学院微生物研究所谢黎炜研究员、武汉大学人民医院神经内科卢祖能教授和武汉大学生命科学学院周宇教授等参与了该论文的研究工作。 论文信息:DOI: 10.1038/s41467-023-43826-7 本文转载自公众号“小柯生命” 中国生物物理学会官方订阅号,为BSC会员及生物物理领域专业人士服务。 投稿及授权请联系:[email protected]。 原标题:《【科技前沿】Nat Commun丨武汉大学梁毅团队揭示miRNA对PrPᶜ相分离、肌肉细胞自噬及分化调控机制》 阅读原文 |
【本文地址】