| 一种CPA中间体、CPA类化合物及其制备方法和应用与流程 | 您所在的位置:网站首页 › cpa类似 › 一种CPA中间体、CPA类化合物及其制备方法和应用与流程 |
一种CPA中间体、CPA类化合物及其制备方法和应用与流程
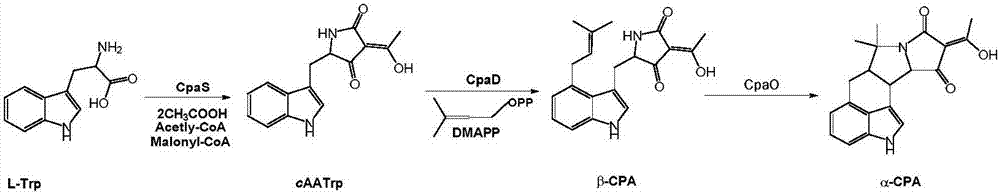 本发明涉及中间体以及化合物的制备,具体的说是一种cpa中间体、cpa类化合物及其制备方法和应用。 背景技术: 据联合国粮农组织(fao)报告,植物病虫害等每年可造成全球粮食减产达31%-42%,直接威胁到粮食安全。目前,粮食的病虫害问题主要依赖化学合成农药进行控制;但是其中大部分农药存在药物作用对象的低选择性和高毒性,在杀死目标害虫的同时也对无害或有益的微生物、昆虫及植物等造成生长抑制;还会造成害虫的耐药性、环境污染以及食品安全等方面的问题。所以,寻找低毒、环境友好型的新型农药是一个迫待解决的问题。 环匹阿尼酸类似结构非常罕见,目前已经发现的该类化合物仅有12个。这应与cpa的生物合成途径及基因簇相对简单有关(图2):cpa类化合物是在cpa合成酶(cpas)、环乙酰乙酰基-l-色氨酸二甲烯丙基转移酶(cpad)以及氧化环化酶(cpao)三个酶依次作用下,由一分子的色氨酸(trp)、乙酰辅酶a、丙二酰基辅酶a及焦磷酸二甲基烯丙酯合成的。其中cpas是一个pks-nrps杂合酶,负责将乙酰辅酶a、丙二酰基辅酶a及trp组装成cpa的第一个前体化合物caatrp。caatrp进一步在cpad的催化下选择性地在c-4位发生异戊烯基化修饰,生成第二个中间产物β-cpa。cpao最后催化β-cpa发生氧化环合生成终产物α-cpa。很显然,该生合成途径较短且后修饰少,所以其衍生物较少。对于cpad的研究(invitro)表明,它可以接受caatrp的类似物作为底物合成β-cpa类似物,如含trp的硫乙内酰脲、二酮哌嗪乃至含trp的线肽。因此,我们尝试了直接在培养基中添加这些化合物的方法来使该菌株合成cpa的类似物。而且可以在控制底物的基础上,通过控制cpao酶的活性来控制终产物是否氧化环化,进一步增加产物的多样性。在此基础上开展cpa类化合物及其类似物诱导植物抗性的研究。 米曲霉应用于发酵类食品的生产具有悠久的历史,为非黄曲霉素产生菌。cpas中,α-cpa发现较早,可特异性地抑制肌(内)质网ca2+atp酶而提升胞浆ca2+浓度。α-cpa长期被冠以真菌毒素之名,但实际尚未见确切的对人畜致毒的报道。 技术实现要素: 本发明的目的是提供一种cpa中间体、cpa类化合物及其制备方法和应用。 为实现上述目的,本发明采用技术方案为: 一种cpa化合物的中间体,cpa化合物的中间体为式i所示的β-cpa或式iii所示的2-oxo-β-cpa; 上述式i和式iii中,r1为h或c1-c10烷基;r2为式ii所示的任一种互变异构体;r3、r4、r5、r6可相同或不同的为h、c1-c10烷基、c2-c10烯基、卤素、-oh、-och3或-nh2; 优选,所述式i和式iii中r1为h、甲基、乙基、丙基或异丙基;r2为式ii所示的任一种互变异构体;r3为h、甲基、乙基、丙基、异丙基或异戊烯基;r4、r5、r6可相同或不同的为h、甲基、乙基、-cl、-oh、-och3或-nh2。 更优选。所述式i和式iii中,r1为h或甲基;r2为式ii所示的互变异构体中的d;r3为h或异戊烯基;r4、r5、r6可相同或不同的为h、甲基、-cl、-oh、-och3或-nh2。 一种cpa中间体类似物,cpa中间体类似物为式i所示的β-cpa类似物或式iii所示的2-oxo-β-cpa类似物; 式i和式iii中r1为h或c1-c10烷基;r2为式vii所示的任一种结构;r3、r4、r5、r6可相同或不同的为h、c1-c10烷基、c2-c10烯基、卤素、-oh、-och3或-nh2;式vii中r’为h或c1-c10烷基; 优选,所述式i和式iii中r1为h、甲基、乙基、丙基或异丙基;r2为式vii所示的任一种结构;r3、r4、r5、r6可相同或不同的为h、甲基、乙基、异戊烯基、-cl、-oh、-och3或-nh2;式vii中r’选自h、甲基、乙基、丙基或异丙基。 更优选,所述式i和式iii中r1为h或甲基;r2为式vii所示的任一种结构;r3为h或异戊烯基;r4、r5、r6可相同或不同的为h、甲基、乙基、-cl、-oh、-och3或-nh2;vii中r’为h、甲基、乙基、丙基或异丙基。 一种cpa类化合物,cpa类化合物为式iv所示α-cpa或式v所示2-oxo-α-cpa; 上述式iv和式v中,r1为h或c1-c10烷基;r2、r3、r4可相同或不同的为h、c1-c10烷基、c2-c10烯基、卤素、-oh、-och3或-nh2;式iv和式v中e环部分为式vi所示的任一种互变异构体; 优选,所述式iv和式v中r1为h、甲基、乙基、丙基或异丙基;r2、r3、r4可相同或不同的为h、甲基、乙基、丙基、异丙基、异戊烯基、-cl、-oh、-och3或-nh2;e环部分为式vi所示的任一种互变异构体。 更优选,所述式iv和式v中,r1为h或甲基;r2、r3、r4可相同或不同的为h、甲基、-cl、-oh、-och3或-nh2;e环部分为式vi所示的种互变异构体d。 一种cpa类似物,cpa类似物为式viii所示α-cpa类似物或式ix所示2-oxo-α-cpa类似物; 上述,式viii、式ix中,r1为h、c1-c10烷基;r2、r3、r4可相同或不同的选自h、c1-c10烷基、c2-c10烯基、卤素、-oh、-och3或-nh2;式viii、式ix中e环部分为式x所示的任一种结构,式x中r’选自h或c1-c10烷基; 优选,所述式viii、式ix中,r1为h、甲基、乙基、丙基或异丙基;r2、r3、r4可相同或不同的为h、甲基、乙基、异戊烯基、-cl、-oh、-och3或-nh2;e环部分为式x所示的任一种结构,式x中r’选自h、甲基、乙基、丙基或异丙基。 更优选,所述式viii、式ix中,r1选自h或甲基;r2、r3、r4可相同或不同的选自h、甲基、乙基、-cl、-oh、-och3或-nh2;e环部分为式x所示的任一种结构,式x中r’选自h、甲基、乙基、丙基或异丙基。 一种上述中间体、类似物、cpa类化合物的制备方法,将cpa前体化合物用体内(invivo)饲喂的方法与微生物共培养,最终通过微生物生物转化法获得cpa中间体、cpa中间体类似物、cpa类化合物和cpa类似物。 所述cpa前体化合物为式i和iii中r3为h的cpa中间体化合物或中间体类似物;微生物指含有cpa生物合成基因簇的微生物或野生型含有cpa生物合成基因簇的突变菌株。 所述含有cpa生物合成基因簇的突变菌株为曲霉属(aspergillus)或青霉属(penicillium)真菌或敲除其部分基因的突变株及cpa基因簇经异源表达的工程菌株。 所述曲霉属(aspergillus)和青霉属(penicillium)真菌包括黄曲霉(a.flavus)、米曲霉(a.oryzae)、烟曲霉(a.fumigatus)、杂色曲霉(a.versicolor)、圆孤青霉菌(p.cyclopium)灰黄青霉(p.griseofulvum)、沙门柏干酪青霉(p.camemberti)以及荨麻青霉(p.urticae)。 cpa生物合成基因簇参见图1,它包含3个核心的基因,分别为cpas(~11kb)、cpad(~1.3kb)及cpao(~1.3kb)。这三个基因依次编码三个蛋白:cpas、cpad及cpao。其中cpas是一个nrps-pks杂合酶,负责将乙酰辅酶a、丙二酰基辅酶a及色氨酸组装成cpa的第一个前体化caatrp。caatrp再在o-二甲基烷基转移酶(cpad)的催化进一步选择性地在caatrp的c-4位发生异戊烯基化修饰,生成第二个中间产物β-cpa。cpao是一个氧化环化酶,催化β-cpa发生氧化环合生成终产物α-cpa。 具体,微生物转化法制备: 1)将的菌株接种于液体培养基中摇瓶发酵3-5天,再加入不同的cpa前体化合物,继续培养2-3天。 2)发酵液除去菌体后所得上清液用大孔吸附树脂吸附,树脂与上清液的比例为15-30g/l;使树脂与上清液充分搅拌混合约30min-2h;吸附完成后,先用蒸馏水洗涤树脂,再用meoh解吸附,回收甲醇溶剂后即得cpa中间体化合物、cpa化合物以及cpa类似物。 3)上述目标产物再经色谱纯化即得纯度不低于95%的纯品。 一种上述中间体、类似物、cpa类化合物的制备方法,其特征在于:采用cpa生物合成的相关的酶经过体外(invitro)催化cpa前体化合物,进而获得依次获得cpa中间体、cpa中间体类似物、cpa类化合物和cpa类似物。 所述cpa前体化合物为式i和iii中r3为h的cpa中间体化合物或中间体类似物; 所述cpa生物合成的相关的酶为cpas、cpad及cpao。 其中cpas是一个nrps-pks杂合酶,负责将乙酰辅酶a、丙二酰基辅酶a及色氨酸组装成cpa的第一个前体化caatrp。caatrp再在o-二甲基烷基转移酶(cpad)的催化进一步选择性地在caatrp的c-4位发生异戊烯基化修饰,生成第二个中间产物β-cpa。cpao是一个氧化环化酶,催化β-cpa发生氧化环合生成终产物α-cpa(参见图3)。 具体制备,β-cpa、2-oxo-β-cpa、α-cpa及2-oxo-α-cpa化合物的酶催化法: 1)采用常规方式扩增获得菌株的cpad和cpao基因,将cpad和cpao分别克隆入过表达载体。 2)将表达载体转入宿主菌株中进行表达。培养结束后收集菌体,弃去上清液。用溶菌缓冲液重新悬浮菌体,加入溶菌酶,室温轻微混合搅拌30min。 3)冷却上述细胞悬液至4℃,进一步在此温度下超声破壁。15,000rpm离心30min,0.2μm膜过滤上清液。 4)过滤液采用fplc亲和色谱进行纯化即得cpad和cpao蛋白,cpad可用sds-page检查蛋白纯度。 5)用上述纯化的cpad催化不同的cpa前体化合物和焦磷酸二甲基烷基烯丙酯(dimethylallylpyrophosphate,dmapp),生成r3取代基为异戊烯基的cpa中间体化合物及cpa类似物;该反应式如下(cpad酶合成β-cpa和2-oxo-β-cpa类化合物或其类似物): 6)1h后,终止酶催化反应后,反应混合物经色谱纯化即得纯化的β-cpa和2-oxo-β-cpa类化合物。 7)在上述反应体系中同时添加cpao酶则可以继续使反应进行至环合步骤:即β-cpa和2-oxo-β-cpa类化合物通过氧化环化反应生成α-cpa和2-oxo-α-cpa类化合物,该反应式如下: 8)1h后,终止酶催化反应后,反应混合物经色谱纯化即得α-cpa和2-oxo-α-cpa类化合物。 制备β-cpa类似物、2-oxo-β-cpa类似物、α-cpa类似物及2-oxo-α-cpa类似物的酶催化法: 1)按照上述方式获得cpad和cpao酶。 2)用式i和式iii所示r3为h的cpa中间体类似物作为cpad的底物,与焦磷酸二甲基烷基烯丙酯(dimethylallylpyrophosphate,dmapp),生成r3取代基为异戊烯基的cpa中间体化合物及cpa类似物(参见上述cpad酶合成β-cpa和2-oxo-β-cpa类化合物或其类似物反应式)。 3)反应结束时,反应混合物经色谱纯化即得β-cpa和2-oxo-β-cpa类似物。 4)在上述反应体系中同时添加cpao酶则可以继续使反应进行至环合步骤:即β-cpa和2-oxo-β-cpa类似物通过氧化环化反应生成α-cpa和2-oxo-α-cpa类似物。 一种上述中间体、类似物、cpa类化合物的应用,所述中间体、类似物、cpa类化合物作为制备植物抗性诱导剂或植物生长调节剂中的应用。 所述中间体、类似物、cpa类化合物作为植物抗性诱导剂、生长调节剂。用于提高植物对真菌、细菌、虫害等生物胁迫的抗性;并且可用于提高植物对水、盐等非生物胁迫的抗性。 本发明所具有的优点: 本发明采用突变生物合成的方法定向合成cpa的类似物,用于进一步评价其诱导抗性的活性。对于发现新型农药先导化合物、充分开发传统意义上无活性或弱活性微生物及其代谢物资源、保障粮食及食品安全、促进农业的可持续性发展具有积极的意义。 附图说明: 图1为cpa的生物合成基因簇示意图。 图2为cpa的生物合成途径。 图3为本发明实施例提供的生物转化法制备β-cpa化合物xii及α-cpa化合物xiii的lcms色谱图。 具体实施方式 下面的实施例将对本发明予以进一步的说明,但并不因此而限制本发明。 本发明cpa类化合物为具有吲哚乙酸母核的化合物。cpa类化合物是肌(内)质网ca2+atp酶抑制剂,本发明获得的cpa中间体、cpa类化合物具有潜在植物抗性诱导剂及植物生长调节剂。可应用于病虫害防治及植物生长控制。 实施例1: 1)培养基:ygp培养基:酵母膏5g,葡萄糖10g,蛋白胨5g,水1l。固体马丁培养基:葡萄糖10g,蛋白胨5g,k2hpo41g,mgso40.5g,琼脂20g,水1l。 2)发酵种子液的制备:将米曲霉(aspergillusoryzaehmp-f28)菌株在马丁培养基上划线接种后,于28℃培养箱中培养48小时。挑取活化后的孢子接种于ygp培养基中,置于28℃,170rpm摇床中培养48小时得发酵种子液。 米曲霉(aspergillusoryzaehmp-f28)于2011年12月26日,保藏于中国典型培养物保藏中心,地址武汉大学;保藏编号cctccno:m2011484。 3)接种及发酵:接种上述种子液于ygp培养基中,接种量为20ml/l。然后将发酵液于28℃,170rpm培养基中发酵培养3天。 4)生物转化:上述培养发酵液中加入cpa前体化合物xi以及dmapp,继续培养48小时。 5)发酵液除去菌体后所得上清液用大孔吸附树脂吸附,树脂与上清液的比例为20g/l;使树脂与上清液充分搅拌混合约50min;吸附完成后,先用蒸馏水洗涤树脂,再用meoh解吸附,回收甲醇溶剂后经即得产物xii和xiii(参见图3)。xii是一种β-cpa化合物,xiii是一种α-cpa化合物。 由图3中lcms色谱图进而将xii和xiii得以区分,色谱中hplc分析条件:色谱柱:phenomenexc18柱(250mm×4.6mm,5μm);紫外(uv)检测波长:220nm、285nm;流速:1ml/min;柱温箱温度:35℃;进样量:20μl。洗脱条件:流动相a:色谱乙腈(流动相a)、流动相b含0.1%甲酸的纯水;0-8min:37%流动相a和63%流动相b等度洗脱;8-15min:37%流动相a和63%流动相b至63%流动相a和37%流动相b梯度洗脱;15-25min:63%流动相a和37%流动相b至100%流动相a梯度洗脱;25-33min:100%流动相a等度洗脱。ms条件:离子源类型:电喷雾离子源(esi源);正离子模式;喷雾电压:3kv;气化温度:300℃;鞘气体压力:40kv;辅助气体压力:10kv;毛细管温度:270℃;毛细管补偿:35kv;扫描范围:450-600da。 实施例2: 1)cpad及cpao的克隆、表达及纯化:采用本领域技术人员熟知的现有技术从aspergillusoryzaehmp-f28的基因组dna分别扩增cpad和cpao基因的外含子。分别用dna连接试剂盒连接入pqtev载体,构建成cpad及cpao的表达载体,并将该表达载体转入大肠杆菌(e.coli)进行表达。采用含有100μg/ml的氨苄青霉素的lb培养基(luria-bertani)培养。培养条件为37℃,200rpm。用od600监测细胞的生长情况。待od600达到0.5左右时,将发酵液冷却至17℃,并用0.25mm的异丙基硫代半乳糖苷(iptg)诱导蛋白表达。17℃继续培养20h后,在4℃、5000rpm离心发酵液。所得菌体悬浮于20mm,ph8的tris-hcl缓冲液(500mmnacl,15mmimidazole,1mmdtt,10%甘油)中,加入溶菌酶(1mg/ml),室温轻微混合搅拌30min。冷却上述细胞悬液至4℃,进一步在此温度下超声破壁。15,000rpm离心30min,0.2μm膜过滤得上清液。 4)过滤液采用fplc亲和色谱进行纯化即得cpad和cpao蛋白,用sds-page检查保证蛋白纯度。 5)用上述纯化的cpad催化cpa前体化合物xiv和dmapp,生成β-cpaxv。继续用cpao催化发生环合反应生成α-cpa型产物xvi。反应在50mmtris-hcl(ph7.5)缓冲液中进行,dmapp浓度为250μm,xiv浓度为200μm的,反应温度30℃。而后再向反应体系中添加cpad,使上述反应混合物启动反应,使cpad的终浓度为50nm。10分钟后加入二倍反应混合物体积的甲醇并混合均匀使反应终止,此时可获得产物xv。 将上述反应体系中启动反应体系的cpad由cpad及cpao替换,使上述反应混合物启动反应,则在反应终止时获得终产物xvi。 |
【本文地址】