| 阴道恶性肿瘤诊断与治疗指南(2021年版) | 您所在的位置:网站首页 › 黑色素瘤病程进展过程图片 › 阴道恶性肿瘤诊断与治疗指南(2021年版) |
阴道恶性肿瘤诊断与治疗指南(2021年版)
|
阴道恶性肿瘤诊断与治疗指南(2021年版)
中国抗癌协会妇科肿瘤专业委员会
来源: 中国癌症杂志
编者: zhangyuanyuan
2021年07月30日
阅读 14668
点赞 2
评论 0
中国抗癌协会妇科肿瘤专业委员会. 阴道恶性肿瘤诊断与治疗指南(2021年版)[J]. 中国癌症杂志, 2021, 31 (6): 546-560.
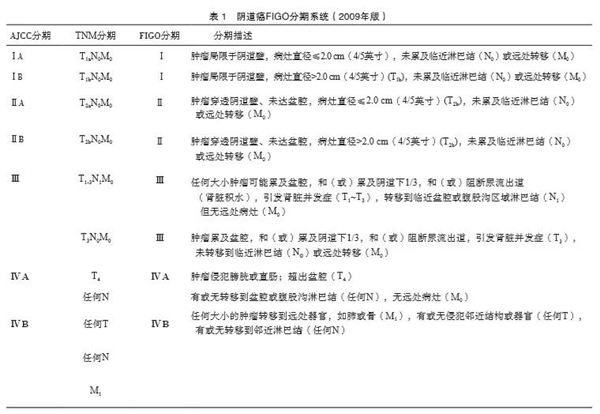
主编简介 王丹波,二级教授,博士导师。辽宁省肿瘤医院院长,辽宁省肿瘤研究所所长,妇科教研室主任。享受国务院政府特殊津贴,国家卫计委突出贡献中青年专家。现任中华医学会妇科肿瘤学分会常委、中国抗癌协会癌症筛查与早诊早治专委会候任主委、中国抗癌协会妇科肿瘤专委会副主委、中国抗癌协会肿瘤内分泌治疗专委会副主委、CSCO妇科肿瘤专委会副主委、中国医师协会妇产科分会委员、辽宁省医师协会副会长、辽宁省医学会妇科肿瘤学分会前任主委 、辽宁省医学会妇产科分会副主委、沈阳医学会妇产科分会主委。《中国实用妇科与产科杂志》副主编。 阴道恶性肿瘤诊断与治疗指南(2021年版) 中国抗癌协会妇科肿瘤专业委员会 [关键词] 阴道恶性肿瘤;诊断;治疗;指南 阴道恶性肿瘤诊断与治疗指南(2021年版) 编写专家 主 编: 王丹波 中国医科大学肿瘤医院/辽宁省肿瘤医院 副主编: 李 力 广西医科大学附属肿瘤医院 秘书: 佟 锐 中国医科大学肿瘤医院/辽宁省肿瘤医院 张 晶 中国医科大学肿瘤医院/辽宁省肿瘤医院 主要编写人员(按姓氏笔画排序): 王 莉 河南省肿瘤医院 王建六 北京大学人民医院 孙 丽 青岛市肿瘤医院 阳志军 广西医科大学附属肿瘤医院 李 斌 中国医学科学院肿瘤医院 李长忠 山东省立医院 李秀敏 山东临沂市肿瘤医院 杨英捷 贵州省肿瘤医院 吴绪峰 湖北省妇幼保健院 陆安伟 南方医科大学深圳医院 赵卫东 安徽省立医院 郝 敏 山西医科大学第二医院 娄 阁 哈尔滨医科大学附属肿瘤医院 徐惠成 贵州省贵黔国际总医院 郭瑞霞 郑州大学第一附属医院 唐 郢 重庆大学附属肿瘤医院 黄曼妮 中国医学科学院肿瘤医院 阴道恶性肿瘤可分为原发性和继发性肿瘤。由于发病率低,国内外均缺乏大样本、前瞻性的研究,故尚无统一的诊治标准。阴道鳞癌和黑色素瘤多见于老年或绝经后妇女。近年来由于高危型人乳头瘤病毒(human papillomavirus,HPV) 持续感染增多,年轻的阴道鳞癌患者也在逐渐增多。腺癌好发于青春期,内胚窦瘤和葡萄状肉瘤则好发于婴幼儿。继发性阴道恶性肿瘤多来自相邻器官恶性肿瘤的直接蔓延、浸润以及淋巴转移,来自远隔器官的血行转移较少[1-2]。 1原发性阴道恶性肿瘤 原发性阴道恶性肿瘤是少见的妇科恶性肿瘤,其人群发病率仅为0.6/10万,占妇科恶性肿瘤的1%~2%,阴道恶性肿瘤的10%;阴道恶性肿瘤HPV感染率为65%~70%,HPV16是阴道癌患者中最常见的类型[3-5]。原发性阴道恶性肿瘤指癌灶局限于阴道壁,无子宫颈癌、外阴癌的组织学证据。其发病确切原因不明,除了可能与高危型HPV持续感染相关外,还与阴道壁反复损伤、免疫抑制治疗、吸烟、子宫颈放射治疗史、长期异常阴道分泌物刺激等有关[6-7]。子宫切除尤其是40岁前的子宫切除史亦可能是发生阴道癌的高危因素之一,约有40%的原发性阴道癌患者有全子宫切除病史,其中20%~30%因子宫颈癌前病变切除子宫[8-10]。 1.1 诊断 根据国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)制定的原发性阴道癌诊断标准:① 子宫颈和外阴未见肿瘤;② 距子宫颈原位癌手术2年后,距浸润性子宫颈癌的手术治疗5年后,距接受放射治疗的子宫颈癌10年后。 1.1.1 主要临床表现 临床症状:早期可呈阴道分泌物增多或不规则流血,接触性阴道出血。晚期症状与子宫颈癌相似。晚期可累及阴道旁,肿瘤侵犯附近组织器官如神经、骨质、尿道、膀胱和直肠等,可出现下腹部、腰骶部疼痛、排尿痛、血尿、肛门坠胀、排便困难、排便时疼痛等,以及出现腹股沟、锁骨上淋巴结肿大和远隔器官转移。 1.1.2 查体 全身查体:明确有无浅表淋巴结特别是腹股沟淋巴结、锁骨上淋巴结转移。有无骨质转移体征,尤其是盆骨的叩击痛,有无肾区的叩击痛。若合并感染,可有腹部压痛等炎症体征。 妇科查体:早期病变外阴无肿瘤征象,可以窥见或扪及阴道壁病灶,呈结节状、菜花状、溃疡状或浅表糜烂状,也可以是阴道白斑或息肉状病变,但子宫颈外观无肿瘤性病变。晚期病变阴道可完全被肿瘤填塞、阴道旁组织浸润甚至形成冰冻骨盆。浸润较深的阴道前壁/后壁肿物若侵透尿道/直肠前壁,则可因尿瘘/肠瘘出现经阴道漏尿/漏便。阴道前壁病变因窥器遮挡容易漏诊。 1.1.3 主要的辅助检查 1.1.3.1 病理学诊断 可以在直视下行病理学活检,也可以借助阴道镜定位活检。对不能耐受疼痛、阴道口狭窄的患者可在镇静或全麻后进行充分检查和活检。病灶位于阴道上1/3阴道壁居多,鳞癌多位于后壁,腺癌多位于前壁[11]。最常见的大体分型为菜花型或结节型,其次为溃疡型、浅表糜烂型。从组织病理学上看,85%~95%的原发性阴道恶性肿瘤为鳞癌,其次为腺癌,而腺鳞癌、黑色素瘤、肉瘤、生殖细胞肿瘤、小细胞神经内分泌癌等更为罕见[12]。经病理学检查除外子宫颈癌、外阴癌后,阴道癌的病理学诊断才能确定。合并子宫颈/外阴的高级别上皮内病变(high-grade intraepithelial lesion,HIL)不能确诊为子宫颈癌/外阴癌。 1.1.3.2 血液学检查 完善血常规、肝肾功能、电解质等血液学检查,明确有无感染、贫血、低蛋白血症、糖尿病等合并症,有无肝肾功能不全。 1.1.3.3 肿瘤标志物检查 鳞癌可行鳞状细胞癌抗原(squamous cell carcinoma antigen,SCCA)检查。非鳞癌应进行糖类抗原(carbohydrate antigen,CA)125、CA19-9、癌胚抗原(carcinoembryonic antigen,CEA)、甲胎蛋白(alpha fetoprotein,AFP)和神经元特异性烯醇化酶(neuron-specific enolase,NSE)等检查[13]。 1.1.3.4 影像学检查 包括超声、X线胸片、CT、MRI、静脉肾盂造影、PET/CT检查等。如果没有禁忌证,CT、MRI应为增强扫描。盆腔MRI增强扫描可评估局部病灶范围及膀胱、直肠的浸润程度;静脉肾盂造影可以评估输尿管的受压/浸润程度。全身PET/CT检查可以评估转移情况。可根据临床症状及可疑转移部位选择其他影像学检查。 1.1.3.5 内镜检查 阴道镜下阴道病变评估,同时可以做子宫颈细胞学检查以排除子宫颈原发病变的可能。凡期别较晚者,均需行尿道-膀胱镜、直肠-乙状结肠镜检查,以排除癌灶侵犯这些器官。 1.1.3.6 高危型HPV检测 阴道癌与高危型HPV持续感染相关。 1.1.3.7 基因检测 由于缺乏有力的一级证据,基因检测尚未被作为诊断标准之一予以推荐。但随着目前免疫相关治疗、靶向治疗等研究进展,基因检测有望成为用于诊断或指导后续治疗的推荐检测项目。 1.1.4 主要鉴别诊断 阴道恶性肿瘤需与阴道上皮萎缩、阴道HPV感染引起的阴道尖锐湿疣、阴道结核性溃疡、子宫内膜异位结节等鉴别,病理学检查是主要鉴别诊断方法。确诊原发性阴道恶性肿瘤还需排除子宫颈癌、外阴癌、子宫内膜癌、卵巢癌/输卵管癌、绒癌阴道转移、泌尿系/肠道来源恶性肿瘤等。 1.2 分期 阴道癌目前临床常用的分期标准仍为临床分期。依然采用阴道癌FIGO 2009年分期(表1)。
分期原则:① 阴道癌临床分期主要根据临床检查的全面评估。② 妇科检查需由两位或以上有经验的妇科肿瘤专科医师进行。③ 阴道癌分期需在治疗前确定,一旦确定,其后不能更改。④ 当分期有异议时,将分期定于较早的期别。⑤ 手术当中探查及术后病理学检查结果,或治疗中及治疗后发现转移,均不能改变分期。 1.3 治疗 1.3.1 治疗原则 由于缺乏大样本前瞻性研究,阴道恶性肿瘤尚无标准化治疗方案,临床上应遵循个体化原则,依据患者的年龄、疾病分期、病灶部位、组织病理学特征、肿瘤大小确定治疗方案,采用放射治疗或手术治疗,以及化疗等综合治疗,但预后较子宫颈癌差。由于发病率低,患者应集中于有经验的肿瘤中心进行治疗。阴道特殊类型恶性肿瘤详见后面相关章节,下述治疗特指阴道鳞癌。总体而言,阴道上段癌可参照子宫颈癌的治疗,阴道下段癌可参照外阴癌的治疗。由于阴道与膀胱、尿道、直肠间隔较小,不同部位淋巴引流不同,血管及淋巴管丰富、吻合支多等解剖学特点,肿瘤治疗难度大,且需注意不同治疗方式对生殖功能和性功能可能产生的影响[14]。 1.3.2 放疗 放疗适用于Ⅰ~Ⅳ期病例,是大多数阴道癌患者首选的治疗。尤其适用于Ⅱ期及以上中晚期患者及失去手术机会的患者。放疗优越性主要体现在可保留器官。在制定放疗计划时,MRI检查有重要的指导作用,可确定肿瘤大小、判断与邻近器官的空间结构关系[15]。 放疗包括腔内或近距离治疗及体外照射(external beam radiation therapy,EBRT)两部分。70 Gy为最优或较低阈值剂量,可提高阴道鳞癌的2年生存率及局部控制率,但可能导致3级或4级毒性反应。推荐阴道癌放疗的最佳剂量为 70~80 Gy(EQD2)。 1.3.2.1 体外照射 根据阴道癌生长的部位及大小、淋巴结转移情况进行个体化设计。 ⑴ 放疗技术:放疗技术包括适型调强放疗(intensity-modulated radiotherapy,IMRT)、容积调强放疗(volumetric modulated arc therapy, VMAT)、螺旋断层放疗(TOMO)等,可以使病灶获得更高的放疗剂量,降低邻近器官放疗剂量,不良反应更少,推荐使用。 ⑵ 阴道原发肿瘤区域放射野设计:主要照射范围包括阴道、阴道旁,如果肿瘤邻近或达阴道穹窿,需要包括子宫颈及子宫颈旁组织。 ⑶ 淋巴结引流区放射野设计:肿瘤位于阴道中上段,其照射范围与子宫颈癌照射范围近似,主要包括髂内淋巴结、髂外淋巴结、闭孔淋巴结及骶前淋巴结。若盆腔淋巴结有转移,要包括髂总淋巴结;如果淋巴结转移到更高水平,应根据影像学检查确定照射范围。肿瘤位于阴道中下段,其照射范围与外阴癌照射范围近似,包括腹股沟、髂外、髂内和闭孔淋巴结引流区。如果肿瘤仅位于阴道下1/3,而且证实腹股沟淋巴结没有转移,可以不勾画髂内外淋巴结及闭孔淋巴结,仅包括腹股沟淋巴结引流区。腹股沟淋巴结照射,患者体位固定建议蛙腿或八字分开固定,能减少腹股沟皮肤放射性损伤。 ⑷ 放射剂量:一般给予1.8~2.0 Gy/次,总量45~50 Gy,转移的肿大淋巴结可以同步加量或后期加量10~15 Gy。 ⑸ 同步化疗:目前未见大样本前瞻性研究证实阴道癌同步化疗可以获益。一个纳入71例阴道癌的小样本回顾性研究提示,同期放化疗较单纯放疗对总生存期、无瘤生存期具有潜在获益。可以考虑采用顺铂或含铂类药物联合方案的同期化疗。 1.3.2.2 腔内放疗 主要针对阴道原发病灶及临近浸润区,腔内治疗根据具体情况可以选择不同的阴道施源器,或者联合组织间插植放疗,有报道[16]推荐对浸润深度≥0.5 cm、阴道中下段的病灶、体积较大的阴道肿瘤使用腔内联合组织间插植近距离放疗,以达到控制肿瘤、保护危及器官的目的。建议使用三维后装技术,可提高治疗有效率。借助3D打印技术的适型施源器可以加强保护,提高治疗满意度[17-19]。剂量推荐:阴道黏膜下0.5 cm或HR-CTV D90 5~7 Gy/次,每周1~2 次,总量24~30 Gy,联合体外放疗总量70~80 Gy(EQD2)。 1.3.2.3 各期放疗原则 ⑴ Ⅰ期阴道癌:阴道肿瘤表浅,肿瘤浸润深度≤5 mm并且肿瘤宽度≤2 cm,仅给予阴道近距离放疗,阴道黏膜下0.5 cm,60 Gy以上。肿瘤浸润深度>5 mm或肿瘤宽度>2 cm,先用外照射治疗阴道肿瘤阴道旁区域及引流淋巴结区域,外照射后给予近距离放疗补量。 ⑵ Ⅱ、Ⅲ期阴道癌:应用体外+腔内照射,外照射剂量为45~50 Gy,转移的肿大淋巴结可以同步加量或后期加量10~15 Gy。照射范围详见1.3.2.1体外照射⑵、⑶的放射野设计。常规照射20~30 Gy时需屏蔽直肠和膀胱,同时加用阴道腔内照射。若用调强放射技术时用40 Gy后再加用阴道腔内照射,如果肿瘤大,腔内放疗不能有效覆盖肿瘤区域,可以联合组织间插植。近距离放疗剂量:详见1.3.2.2 腔内放疗。 ⑶ Ⅳ期:应采取个体化治疗,大多数患者采用姑息性治疗。ⅣA期患者可选择根治性放化疗,ⅣB期患者首选化疗,但是对于寡转移灶患者,仍然可能有治愈机会,可积极给予根治性放疗,治疗靶区因病灶范围而定。 1.3.2.4 术后辅助放疗 对于Ⅰ期阴道鳞癌的治疗,手术治疗与放疗的效果相似。FIGO分期、病理学类型是影响阴道癌预后的独立因素,肿瘤>4 cm、阴道受侵长度>2/3阴道壁也可能是影响因素,对于存在高危因素的患者,术后可联合放疗以增加局部控制率。如手术切缘及淋巴结阴性,则不用辅助放射治疗。少数Ⅱ期患者可以通过根治性手术治愈,术后建议辅助放疗者,行手术治疗后辅助放疗,预后会较好。 1.3.3 手术治疗 由于阴道解剖位置的特殊性,根治性手术创伤较大,副损伤多,对性功能影响大,对患者及性伴侣的生活质量有较大影响,故手术并非主要的治疗手段[20]。手术作为初始治疗仅用于早期、局限于阴道壁的小病灶。手术方式可以根据病情选择经腹、经阴道、经腹腔镜等。阴式路径更适用于局限于阴道壁的表浅小病灶。由于缺乏生存数据,选择腹腔镜手术应慎重,应用于放疗前卵巢悬吊、淋巴结活检较为安全。 ⑴ 病变位于阴道壁上1/3的Ⅰ期患者:可行广泛全子宫和阴道上段切除,阴性切缘至少距病变1 cm,并行盆腔淋巴结切除。若已行子宫全切,可行子宫旁组织切除+阴道上段切除+盆腔淋巴结切除术。 ⑵ 病变仅位于阴道壁下1/3的早期患者:可行阴道局部广泛切除/扩大切除(切缘距离病灶1 cm)+腹股沟淋巴结切除术,必要时切除部分尿道和外阴并同时做成形术。 ⑶ 病变位于阴道壁中1/3的患者:需行广泛/次广泛全子宫切除、全阴道切除及腹股沟和盆腔淋巴结切除术,手术创伤大,患者往往难以接受而多选择放疗。 ⑷ ⅣA期患者:若合并直肠阴道瘘或膀胱阴道瘘时行盆腔器官廓清术(全盆腔廓清术/前盆腔廓清术/后盆腔廓清术),但手术复杂,恢复慢,围手术期并发症风险较高。如在基层医院发现并确诊,建议转诊到有手术能力的肿瘤医学中心治疗。盆腔廓清术是指对肿瘤累及的相邻盆腔脏器进行整体切除,用在初始治疗时常为一种姑息手术。盆腔廓清术适应证中,阴道癌占17%,位居第二位。患者的5年生存率从原来的20%提高至30%~60%。盆腔廓清术分为Ⅰ型(肛提肌上型)、Ⅱ型(肛提肌下型)和Ⅲ型(肛提肌下联合外阴切除术型),其手术范围广、难度大,通常需要妇科、胃肠外科、泌尿外科医师的共同参与,切缘阴性对预后有重要意义。术后主要并发症(Clavien Dindo≥Ⅲ级)占40.4%,无并发症占19.2%。盆腔廓清术的常见并发症有伤口感染、尿路感染、败血症、脓肿等,晚期易发生肠梗阻、消化道和泌尿生殖道瘘,同时患者的社会心理障碍也可能长期持续存在。因此术前应严格筛选病例,充分评估患者病情,排除远处转移,明确肿瘤界限,严格把握手术适应证,术后积极康复管理[21-22]。 ⑸ 卵巢移位手术:初始治疗选择放疗的早中期年轻患者,可于放疗前行腹腔镜下或经腹卵巢移位,同时予钛夹标记,为后续放疗做准备。晚期患者卵巢转移率未见报道,故保留卵巢需慎重。 ⑹ 放疗前淋巴结切除手术:在经选择的病例,经腹腔镜或腹膜外切除增大的淋巴结可作为分期和治疗计划的一部分。 ⑺ 阴道成形术:年轻阴道癌患者,特别是需要全阴道切除的患者,可以选择在阴道切除的同时行阴道成形术,维持术后性功能。术前充分告知,可以知情选择。覆盖材料可选择腹膜法、羊膜法、生物材料法、乙状结肠法等。 1.3.4 化疗 单纯化疗效果较差,常用于放疗的同步化疗。化疗并未增加老年患者的死亡率[23]。 辅助化疗多与手术或放疗联合用于晚期或肿瘤复发、转移患者的辅助治疗,作用有待评价。静脉化疗考虑给予3~4个疗程,其化疗方案与子宫颈癌或外阴癌类似,动脉灌注化疗选择以铂类药物为主的联合化疗方案,可作为中晚期原发性阴道癌患者姑息性治疗方法之一。 1.3.5 靶向及免疫治疗 阴道癌的靶向治疗及免疫治疗缺乏临床证据。免疫治疗(如帕姆单抗)适用于程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)阳性者以及微卫星高度不稳定(microsatellite instability-high,MSI-H)或错配修复基因缺陷(dificient mismatch repair,dMMR)的难治性子宫颈癌患者。靶向治疗如血管内皮生长因子抑制药物(如贝伐珠单抗)已经被推荐用于复发子宫颈癌的一线治疗。两者均已成为改善子宫颈癌预后的新策略,但是能否适用于阴道癌的临床治疗仍需后续关注临床试验结果[24-25]。 1.3.6 介入治疗 介入治疗多用于阴道病灶大出血、保守治疗无效时。采用双侧超选择性插管至双侧阴道动脉、子宫动脉或髂内动脉后以明胶海绵颗粒栓塞肿瘤供血血管。可同时进行动脉介入化疗。 1.4 预防 一级预防(疫苗):阴道癌与高危型HPV持续感染相关,尤其是HPV16亚型。作为子宫颈癌一级预防措施,HPV疫苗可减少子宫颈癌前病变的发生。有长期研究数据显示,开展HPV疫苗接种地区的HPV相关阴道癌有望减少。美国食品药品管理局(Food and Drug Administration,FDA)于2018年批准了HPV9价疫苗(重组疫苗)Gardasil 9的补充申请,扩大了疫苗的使用范围,用于预防由9种HPV类型导致的包括阴道癌和阴道上皮内瘤变(vaginal intraepithelial neoplasia,VaIN)2级和3级在内 的癌症与疾病[26-28]。二级预防(筛查):① 尚无证据支持常规筛查阴道癌。② 多次锥切术后仍持续有HSIL或持续高危型HPV阳性的女性,注意阴道癌筛查;若因宫颈癌及其癌前病变已切除子宫,术后建议长期随访,行阴道残端细胞学检查。③ 有阴道癌发生高危因素者,筛查方法以HPV联合细胞学更准确。 1.5 预后与随访 1.5.1 阴道癌预后 阴道癌预后与分期、病理学类型、组织分级、病灶部位及治疗方法相关,其中分期最为重要。鳞癌的不良预后因素还包括肿瘤大小(>4 cm)、病灶超出阴道上1/3、HPV感染状态和MIB-1指数(Ki-67增殖指数)。病理学类型、年龄、生育和性功能、一般状态都可影响治疗选择,从而可能影响预后。阴道癌Ⅰ~Ⅳ期患者5年生存率分别为73%、48%、28%和11%。鳞癌患者的预后优于非鳞癌患者。 1.5.2 阴道癌随访 第1年,每1~3个月1次:第2、3年,每3~6个月1次;3年后,每年1次。随访时行阴道细胞学涂片检查,必要时行阴道镜检查和必要的影像学检查。 2特殊类型的原发性阴道恶性肿瘤 2.1 阴道腺癌 阴道本身并无腺体,阴道腺癌可来自残余的中肾管、副中肾管或阴道的子宫异位结节。原发性阴道腺癌仅占原发性阴道恶性肿瘤的8%~10%,大部分确诊于14~22岁的年轻女性。有学者报道己烯雌酚与阴道的透明细胞癌相关,出现在孕16周前子宫内暴露的女性患儿中。已知或可疑己烯雌酚子宫内暴露者,推荐密切随访,每年进行细胞学筛查,必要时行阴道镜检查。非己烯雌酚暴露相关的阴道腺癌罕见,包括内膜样腺癌,可能与子宫内膜异位症相关。还有黏膜亚型,通常见于绝经后女性。大部分腺癌治疗方式同鳞癌。手术同样仅适用于Ⅰ期及部分轻度Ⅱ期的患者,通常保留卵巢。对于肿瘤直径 |
【本文地址】