| 雪胆素片联合阿霉素增强细胞免疫原性死亡的抗肝癌作用研究 | 您所在的位置:网站首页 › 雪胆素片的功效与作用云南产 › 雪胆素片联合阿霉素增强细胞免疫原性死亡的抗肝癌作用研究 |
雪胆素片联合阿霉素增强细胞免疫原性死亡的抗肝癌作用研究
|
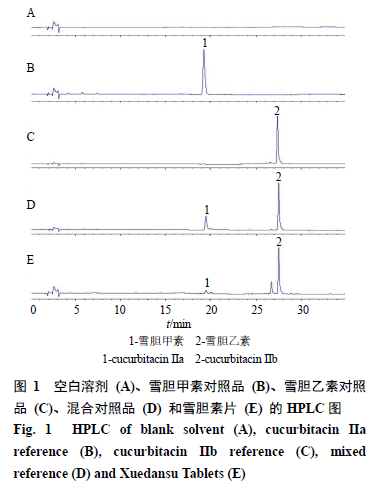
1材料 1.1 动物 1.2 细胞 人肝癌HepG2细胞购自中国科学院上海生命科学研究院细胞资源中心;小鼠肝癌H 22 细胞购自上海拜力生物技术有限公司。 1.3 药品与试剂 1.4 仪器 培养板、细胞培养瓶(美国Corning公司);SPECTRA MAX 190型酶标仪(Molecular Devices公司);普通光学显微镜、倒置荧光显微镜(日本Olympus公司);HH-4型水浴锅(上海维诚仪器公司);台式离心机(德国Heraeus公司);Agilent 1260型高效液相色谱仪;KQ5200型超声清洗器(昆山市超声仪器有限公司);Fresco 21型冷冻离心机(美国Thermo Fisher Scientific公司);Synergy H1型酶标仪(美国BioTek公司)。 2 方法 2.1 雪胆素片和阿霉素溶液的制备 称取5 mg阿霉素粉末溶于1 mL DMSO中,配制成质量浓度为5 mg/mL的母液,于4 ℃保存,临用时将母液用培养基稀释1000倍配制成质量浓度为5 mg/L的溶液,随后使用培养基逐级稀释到所需浓度。雪胆素片研磨粉碎后,称取40 mg溶于1 mL DMSO-完全培养基(1∶9)的溶液中,随后逐级稀释到所需浓度,给药体系中DMSO的终质量分数不超过0.1%。 2.2 高效液相色谱定性分析雪胆素片主要成分 2.2.2混合对照品的制备取雪胆甲素、雪胆乙素置于5 mL量瓶中,加甲醇定容至5 mL,分别制备雪胆甲素对照品溶液、雪胆乙素对照品溶液、混合对照品溶液,临用时用0.45 μm微孔滤膜滤过,于4 ℃保存。另以甲醇配制阴性对照1瓶。 2.2.3供试品溶液的制备取雪胆素片,研细,精密称定0.14 g,精密加入甲醇5 mL,超声处理10 min,放冷,用甲醇补足减失质量,摇匀,用0.45 μm微孔滤膜滤过,于4 ℃保存。 2.3 MTT 法检测雪胆素片联合阿霉素对HepG2细胞存活率的影响 HepG2细胞用含10%胎牛血清的DMEM不完全高糖培养基,于5% CO 2、37 ℃的恒温培养箱中培养。取处于对数生长期的HepG2细胞,接种于96孔板,每孔8000个。培养24 h后分别给予不同质量浓度雪胆素片(20、40、80、120、160、200 mg/L)、阿霉素(0.05、0.10、0.50、1.00、2.50、5.00 mg/L)及雪胆素片(20~200 mg/L)+阿霉素(0.05 mg/L)处理细胞,以不含药液的培养基作为对照,以不含细胞的培养基作为调零孔,培养24 h后,每孔加入10 μL MTT溶液(5 mg/L),37 ℃孵育4 h后,每孔加入100 μL DMSO溶液,振荡10 min后置于酶标仪中测定490 nm处的吸光度(A)值,计算细胞存活率。 细胞存活率=( A 给药-A调零)/( A 对照-A调零) 2.4 平板克隆检测雪胆素片联合阿霉素对HepG2细胞增殖的影响 取处于对数生长期的HepG2细胞,接种于6孔板中,每孔1000个。在培养箱中培养6 d后换液,分别给予雪胆素片(80 mg/L)、阿霉素(0.05 mg/L)及雪胆素片(80 mg/L)+阿霉素(0.05 mg/L)处理细胞,以不含药液的培养基作为对照,在培养箱中培养3 d后吸弃旧培养液,用PBS洗2遍,甲醇固定20 min后,按照结晶紫染色试剂盒说明书操作,干燥后观察增殖情况并拍照记录。 2.5流式细胞术检测HepG2细胞凋亡和细胞周期 取处于对数生长期的HepG2细胞,接种于6孔板上,每孔1×10 6个,培养24 h后分别给予雪胆素片(80 mg/L)、阿霉素(0.05 mg/L)及雪胆素片(80 mg/L)+阿霉素(0.05 mg/L),进行细胞周期实验给药时增加雪胆素片(40 mg/L)组及雪胆素片(40 mg/L)与阿霉素(0.05 mg/L)联合给药组,以不含药液的培养基作为对照,孵育24 h后收集细胞,用冷的PBS洗涤细胞2遍,根据Annexin V-FITC/PI凋亡试剂盒和细胞周期试剂盒说明书操作,利用流式细胞仪检测细胞凋亡和周期。 2.6 免疫荧光检测HepG2细胞ICD相关蛋白表达 取处于对数生长期的HepG2细胞,接种于24孔板中,每孔5×10 4个,培养24 h后分别给予雪胆素片(80 mg/L)、阿霉素(0.05 mg/L)及雪胆素片(80 mg/L)+阿霉素(0.05 mg/L),以不含药液的培养基作为对照,继续孵育24 h后吸弃培养基,PBS漂洗3次,4%多聚甲醛固定20 min;1% BSA封闭30 min,分别滴加CRT和HMGB1单克隆抗体稀释液50 µL,4 ℃避光孵育过夜;第2天滴加二抗,避光孵育60 min;按照DAPI凋亡试剂盒说明书进行核染。染色完毕后滴加封片液50 µL于24孔板中,于激光共聚焦显微镜上进行荧光检测并拍照。 2.7 ELISA 检测HepG2细胞ATP分泌 取处于对数生长期的HepG2细胞,接种于6孔板上,每孔5×10 5个,置于5% CO 2培养箱中过夜培养,分别给予雪胆素片(80 mg/L)、阿霉素(0.05 mg/L)及雪胆素片(80 mg/L)+阿霉素(0.05 mg/L),以不含药液的培养基作为对照,孵育24 h后根据ATP检测试剂盒说明书操作,利用多功能酶标仪的化学发光功能进行检测。 2.8 H 22 肝癌细胞小鼠皮下移植瘤模型的建立 收集处于对数生长期的H 22 细胞,用高糖培养基调整细胞浓度至2×10 7个/mL。用一次性注射器注射到小鼠右侧腋下,每只注射0.1 mL,注射24 h后将小鼠随机分为4组,分别为模型组、雪胆素片(500 mg/kg)组、阿霉素(3 mg/kg)组和联合给药组,给药剂量同单用组保持一致,常规饲养,每天记录小鼠生存状况。雪胆素片溶于0.9%氯化钠溶液中,小鼠ig给药,1次/d;阿霉素溶于0.9%氯化钠溶液中,尾iv给药,每3天1次;联合组给药方式与周期均同单用组保持一致。小鼠共分为2批,第1批每组5只,12 d后脱颈椎法处死,剥离移植瘤组织、脾脏、心脏,称取瘤体与脾脏质量。另一批每组7只,每3天使用游标卡尺测量1次肿瘤体积,共测量5次,记录小鼠60 d内的生存情况 肿瘤体积=长×宽2/2 脾脏指数=脾脏质量/体质量 2.9 免疫组化检测小鼠皮下移植瘤模型肿瘤组织ICD相关蛋白表达 将各组小鼠瘤组织保存于福尔马林中,组织用石蜡包埋,切片脱蜡,0.3% H 2O 2孵育30 min。使用PBS冲洗切片3次,转移至柠檬酸盐抗原修复液中高压加热,室温冷却,加入CRT和HMGB1单克隆抗体后4 ℃孵育过夜。第2天,切片用PBS洗涤,加入经生物素标记的二抗,室温孵育1 h [16]。切片用DAB显色后苏木素复染,脱水后用中性树脂封片,于显微镜下观察CRT和HMGB1表达情况。 2.10小鼠皮下移植瘤模型心脏病理HE染色 取各组小鼠心脏组织,用10%中性缓冲福尔马林固定,石蜡包埋,连续切成4 μm切片,65 ℃烘箱中烘烤3 h后用二甲苯洗3次,梯度乙醇冲洗2次,苏木素染色,流水冲洗后用盐酸-乙醇溶液分化,氨水返蓝,流水洗后用伊红复染,浸入梯度乙醇中,二甲苯透明,中性树脂封片[17],风干后拍照观察小鼠心肌毒性。 2.11 统计学分析 所有数据均采用表示,统计学分析使用GraphPad Prism 9.0软件,组间比较采用配对t检验。 3 结果 3.1 雪胆素片主要有效成分的定性分析 本研究选择210 nm为检测波长,利用高效液相色谱对雪胆素片主要成分进行定性分析。如图1所示,雪胆素片的主要成分为雪胆甲素和雪胆乙素。
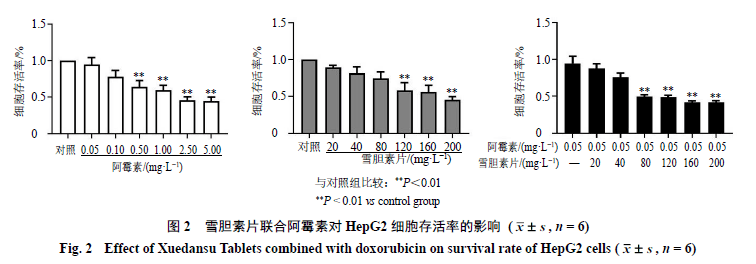
3.2 雪胆素片联合阿霉素对HepG2细胞存活率的影响 如图2所示,阿霉素和雪胆素片抑制HepG2细胞增殖,呈剂量相关性。单独给药时,雪胆素片(80mg/L)抑制率为21.37%,阿霉素(0.05 mg/L)抑制率为0.52%,而雪胆素片(80 mg/L)联合阿霉素(0.05 mg/L)抑制率则达到51.15%,呈现较强的协同抗肝癌作用,差异具有统计学意义(P<0.01)。因此后续体外实验选择80 mg/L雪胆素片联合0.05 mg/L阿霉素。
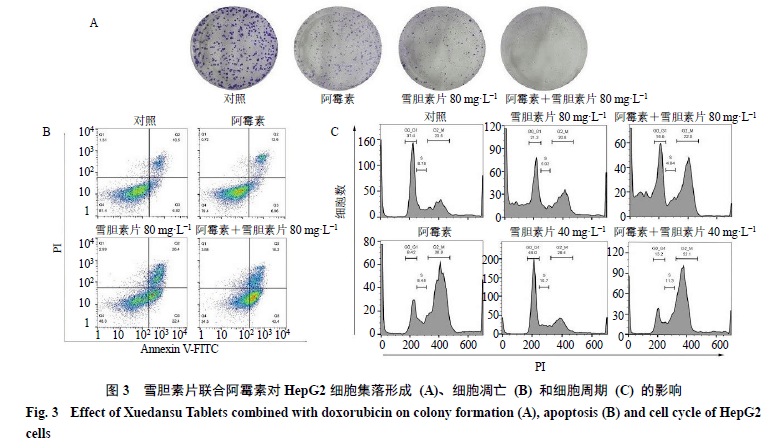
3.3 雪胆素片联合阿霉素对HepG2细胞集落形成的影响 如图3-A所示,与对照组相比,阿霉素(0.05 mg/L)组、雪胆素片(80 mg/L)组和联合给药组细胞集落形成数量均有减少,其中联合组的抑制作用最明显,表明雪胆素片联合阿霉素抑制肿瘤能力最强。
3.4 雪胆素片联合阿霉素对HepG2细胞凋亡和周期的影响 如图3-B所示,不同组别药物处理HepG2细胞24 h后,对照组、阿霉素(0.05 mg/L)组、雪胆素片(80 mg/L)组和联合给药组细胞凋亡率分别为17.31%、19.86%、48.8%、61.6%,说明雪胆素片与阿霉素联用后诱导HepG2细胞凋亡的能力增强。 如图3-C所示,不同组别药物处理HepG2细胞24 h后,各组G 2 /M 期细胞数量均高于对照组;与阿霉素组相比,雪胆素片(40 mg/L)联合阿霉素(0.05 mg/L)组G 2 /M 期的细胞数量明显增多,雪胆素片(80 mg/L)联合阿霉素(0.05 mg/L)组G 2 /M 期细胞数虽然没有增加,但出现凋亡亚峰。上述结果提示低质量浓度(40 mg/L)的雪胆素片与阿霉素联用可诱导HepG2细胞有丝分裂停滞在G 2 /M 期,高质量浓度(80 mg/L)的雪胆素片与阿霉素联用诱导HepG2细胞凋亡。
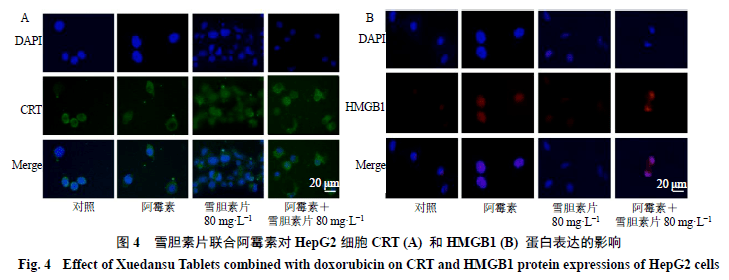
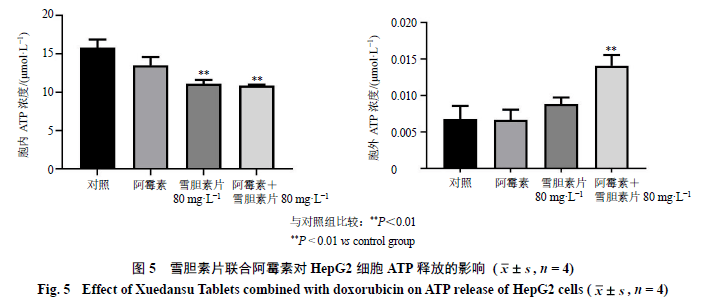
3.5 雪胆素片联合阿霉素对HepG2细胞CRT和HMGB1蛋白表达的影响 CRT在ICD早期转位到细胞膜上,同时细胞释放HMGB1。免疫荧光检测结果(图4)显示,雪胆素片(80 mg/L)与阿霉素(0.05 mg/L)联合处理后HepG2细胞CRT明显暴露于细胞膜;同样,联合组处理过的HepG2细胞中HMGB1向外分泌。说明雪胆素片(80 mg/L)与阿霉素(0.05 mg/L)联合处理后促使CRT暴露于细胞膜,并促进HMGB1向胞外分泌。 3.6雪胆素片联合阿霉素对HepG2细胞ATP释放的影响 如图5所示,阿霉素(0.05 mg/L)组、雪胆素片(80 mg/L)组和联合组胞内ATP浓度均低于对照组,其中雪胆素片组和联合组有统计学意义(P<0.01)。与对照组相比,联合组胞外ATP浓度显著升高(P<0.01),提示雪胆素片(80 mg/L)与阿霉素(0.05 mg/L)联合使用促进ATP由胞内向胞外分泌。
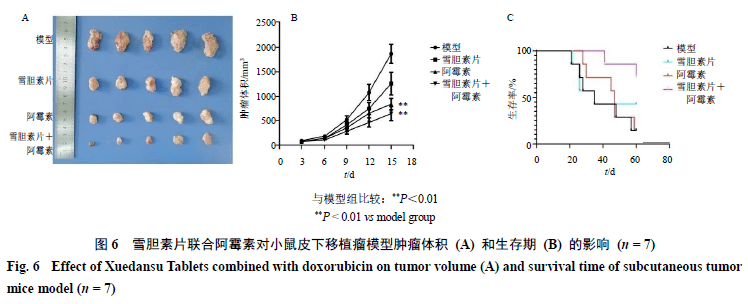
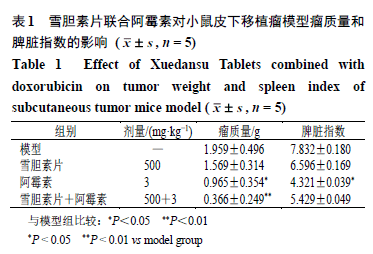
3.7 雪胆素片联合阿霉素对小鼠皮下移植瘤模型移植瘤生长及生存周期的影响 小鼠sc H 22 细胞建立异位移植瘤模型,模型组小鼠肿瘤体积持续增大,小鼠逐渐出现运动迟缓、食欲不佳、立毛等症状。在给药12 d后取小鼠肿瘤组织并拍照(图6-A),雪胆素片(500 mg/kg)、阿霉素(3 mg/kg)以及联合给药组小鼠移植瘤体积生长速度比模型组明显减缓,联合组肿瘤体积抑制程度最大,抗肿瘤作用显著增强(图6-B,P<0.01),并且在一定程度上改善阿霉素单用所致的小鼠脾脏指数降低现象(表1)。60 d生存期观察结果(图6-C)显示,联合组小鼠生存质量最高,死亡率最低。
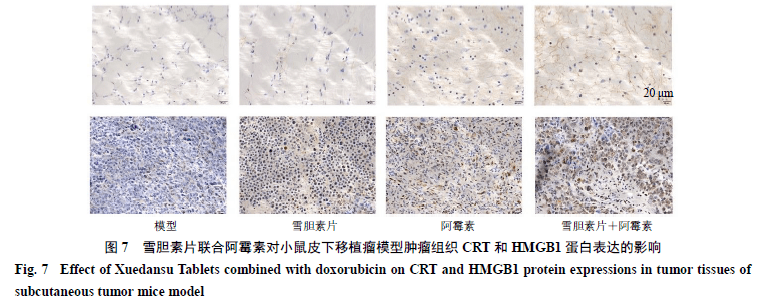
3.8雪胆素片联合阿霉素对小鼠皮下移植瘤模型肿瘤组织CRT和HMGB1蛋白表达的影响 如图7所示,与模型组相比,雪胆素片(500 mg/kg)与阿霉素(3 mg/kg)联合给药组CRT和HMGB1蛋白阳性表达的细胞数量明显增多,与体外实验中对HepG2细胞调控作用一致。
3.9 雪胆素片联合阿霉素对小鼠皮下移植瘤模型心肌毒性的影响 如图8所示,模型组和雪胆素片(500 mg/kg)组小鼠心肌细胞未见明显病理变化;阿霉素(3 mg/kg)组小鼠心肌细胞坏死及空泡样变化明显;阿霉素与雪胆素片联合使用后,小鼠心肌细胞坏死及空泡样变化有显著改善,表明雪胆素片与阿霉素联合使用后能够减轻阿霉素的心肌毒性。 4 讨论 雪胆素片是由葫芦科雪胆属植物提取的“雪胆素”制成的口服片剂,雪胆素主要成分为雪胆甲素和雪胆乙素,以雪胆甲素主[18],是葫芦素类化合物的一种。雪胆素对胃癌、肺癌、乳腺癌等恶性肿瘤均有抑制作用[19-28]。目前文献报道的关于雪胆素抗肿瘤作用机制主要有:抑制细胞增殖和侵袭能力;阻滞细胞周期在G 2 /M 期;诱导细胞凋亡;干扰表皮生长因子受体(epidermal growth factor receptor,EGFR)/丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路[19,26];破坏肌动蛋白细胞骨架等[20,27]。此外,研究发现,雪胆甲素还可以通过保护免疫系统和调节免疫功能抑制二甲基苯蒽诱导的小鼠乳腺肿瘤[21];通过抑制Aurora A、信号转导与转录激活因子3(signal transducers and activators of tranion 3,STAT3)以及Cofilin等信号通路多靶点协同抑制人肺癌细胞系NCI-H460和A549增殖并促进细胞凋亡[22];通过抑制Wnt/β-连环蛋白(β-catenin)通路激活,从而抑制胃癌细胞SGC-7901的增殖及其迁移能力[23]。同时,研究发现葫芦素类化合物不仅在单独用药时表现出良好的抗肿瘤活性[24],而且在药物联用方面也表现出一定优势,如葫芦素B与吉西他滨等联用治疗胰腺癌等肿瘤,低剂量的葫芦素E加强顺铂对乳腺癌细胞的抑制作用等[29]。尽管雪胆素在肿瘤治疗中表现出一定的潜力,但是对于雪胆素及雪胆素片对肿瘤的治疗缺乏系统的体内外研究,对于其是否能作为化疗辅助药物从而减少化疗药物的使用剂量和不良反应尚未有报道。本研究发现雪胆素片可以抑制HepG2细胞活力,与阿霉素联用有效抑制细胞集落的形成;细胞凋亡和周期结果显示,联用时低质量浓度雪胆素片阻滞细胞周期,高质量浓度时导致凋亡,提示雪胆素片联合阿霉素能够提高抗肿瘤效果。 综上所述,本研究发现雪胆素片与阿霉素联用能够促进细胞凋亡,阻滞细胞周期,以及诱导CRT与HMGB1的表达;同时增强抗肿瘤活性,提高小鼠皮下移植瘤模型脾脏指数,延长小鼠生存时间,减弱阿霉素对小鼠的心肌毒性,上调肿瘤组织内CRT与HMGB1蛋白表达,其机制可能与促进细胞ICD有关。后续研究将聚焦于雪胆素片与阿霉素联合使用诱导HepG2细胞的ICD过程,及其对DC细胞吞噬作用和T淋巴细胞活化程度的影响。 利益冲突所有作者均声明不存在利益冲突 参考文献(略) 返回搜狐,查看更多 |
【本文地址】