| 半导体物理学习整理(一) | 您所在的位置:网站首页 › 闪锌矿晶体结构有几个原子 › 半导体物理学习整理(一) |
半导体物理学习整理(一)
|
第一章 半导体的晶体结构和缺陷
目 录 第一章 半导体的晶体结构和缺陷 一、定义和重要性质 1.半导体的定义 2.半导体的重要性质 二、固体的分类 1.晶体 2.非晶体 三、化学键类型和晶体结构规律性 1.原子的负电性 2.化学键类型和晶体结构规律性 四、晶体结构的各向异性 1.晶向和晶面 2.金刚石结构的各向异性 3.GaAs晶体的极性 一、定义和重要性质 1.半导体的定义:半导体是指在常温下导电性能介于导体和绝缘体之间的材料;是一类性质受到温度,光照,电,磁微量杂志等作用而被影响的材料。 半导体、导体和绝缘体的电阻率: 导体半导体绝缘体(1)温度升高可以使半导体导电能力显著增强; (2)微量杂质含量能够显著改变半导体的导电能力; (3)适当波长的光照可以改变半导体的导电能力; (4)磁场,电场等外界因素也可以显著改变半导体的导电能力。 二、固体的分类 1.晶体:晶体的特点:具有一定的外形和固定的熔点,组成晶体的原子(或离子)在较大范围内(至少是微米量级)是按一定的方式有规则的排列而成——长程有序(如Si、Ge、GaAs)。 (1)单晶:整个晶体主要由原子(或离子)的一种规则排列方式所贯穿,常用的半导体材料锗(Ge),硅(Si),砷化镓(GaAs)都是单晶。 (2)多晶:是由大量的微小单晶体(晶粒)随机堆积成的整块材料,如各种金属材料和电子陶瓷材料。 2.非晶体 :非晶体的特点:无规则的外形和固定的熔点,内部结构也不存在长程有序,但在若干原子间距的较小范围内存在结构上的有序排列——短程有序。 三、化学键类型和晶体结构规律性 1.原子的负电性化学键的形成取决于原子对核外电子的束缚力强弱,即原子的负电性是衡量原子对核外电子束缚能力强弱的量。 (1)电离能:失去一个价电子所需要的能量; (2)亲和能:最外层得到一个价电子成为负离子所释放的能量; (3)原子负电性=(电离能+亲和能)×0.18;负电性反映了两个原子之间建合时最外层得失电子的难易程度,价电子总是向负电性大的原子转移。(锂Li的负电性为1) 常见主族元素负电性情况 I族元素II族元素III族元素IV族元素V族元素VI族元素VII族元素锂Li铍Be硼B碳C氮N氧O氟F11.52.02.53.03.54.0钠Na镁Mg铝Al硅Si磷P硫S氯Cl0.91.21.51.82.12.53.0钾K钙Ca镓Ga锗Ge砷As硒Se溴Br0.81.01.51.82.02.42.8铟In锡Sn锑Sb1.51.81.9从上表中可知:I A到VII A,负电性增大,非金属性增强;同族元素从上到下,负电性减弱,金属性增强。 2.化学键类型和晶体结构规律性(1)离子键和离子晶体 离子键是指由正负离子静电引力形成的结合力,由离子键结合成的晶体叫离子晶体。离子键是极性键,离子晶体是极性晶体。 离子晶体的结构特点:任何一个离子的最近邻必是带相反电荷的离子. 配位数:晶体中的一个离子(原子)最近邻的原子数或离子数,反映了原子排列的紧密程度。配位数越大,原子排列越紧密。NaCl的配位数为6——两个面心立方相互套构而成。 NaCl的导电性:Na的价电子转移到Cl的外层轨道形成Na+和Cl-,最外层都形成8电子稳定结构,因此电子被紧束缚在各离子上不能自由运动,因此不参与导电,因此离子晶体一般是绝缘晶体。 晶胞:是晶体结构的基本单元,它充分反映了整个晶体的结构特点,既反映了周期,又反映了各种对称性,即整块晶体是由许多这样的基本单元重复排列而成的。 (2)共价键和共价晶体 共价键:依靠共有自旋相反的配对的价电子所形成的结合力。(共价键又称半导体键) 共价晶体:依靠共价键结合形成的晶体。 共价键特点:(1)饱和性。每个原子和周围原子的共价键数目具有一定限制(Si配位数为4);(2)方向性。原子之间形成共价键时电子云的重叠在空间的确定方向上具有最高密度。 共价键之间的键角为 共价半径:共价四面体中可以粗略的将原子看作圆球并且最近邻的原子间彼此相切,则圆球半径为半导体四面体半径,简称共价半径或四面体半径。 CSiGe最近邻原子间距1.54A2.34A2.44A共价半径0.77A1.17A1.22A金刚石结构的晶胞特点:1)正立方体;2)八个顶角上各有一个原子,体对角线上距最近邻顶角1/4处各有一个原子;3)原子密度=(8×1/8+6×1/2+4)/a³=8/a³。Ge的a=5.56A,原子密度为4.42×10²²/cm³;Si的a=5.43A,原子密度5.22×10²²/cm³。 (3)金属键和金属晶体 金属键:所谓金属键是指负电电子气和正电原子实之间的库仑引力所形成的结合力。 金属晶体:由金属键结合形成的晶体称为金属晶体。 金属晶体特点:1)原子之间排列紧密,使占有空间尽可能小;2)金属的配位数是所有晶体类型中最大的;3)有大量可自由移动的电子,可导电性;4)导热性;5)有光泽。 (4)混合键和混合晶体 混合键:对于大多数晶体,不单纯存在某种化合建,而是同时具有几种化合建——称为混合键。 混合晶体:例如GaAS、InSb、InP、CdS、SiGe、SiC等都是共价键和离子键组成的混合键,称为混合晶体。 混合键的特点:1)由于电负性的差别,电子会向电负性大的方向转移,因而具有极性(如Ga带正电,As带负电),所以会具有一定离子键的性质;2)GaAs等半导体的混合键具有一定极性,可以看作偶极子。 闪锌矿结构晶胞:闪锌矿是由两个不同原子各自组成的面心立方晶胞沿空间对角线方向相互平移1/4对角线长度套构而成。原子密度:如GaAs,Ga的原子密度=As的原子密度=4/a ³,a=5.64A。 四、晶体结构的各向异性晶体的物理或化学性质沿着不同方向或平面往往不同,这种现象成为各向异性。 1.晶向和晶面晶体是由晶胞周期性排列而成,所以整个晶体如同网格,称为晶格。晶体中原子(离子)重心位置称为格点,所有格点的总体称为点阵。 对立方晶系,晶胞内任取一格点为原点,取立方晶胞三个相互垂直的边作为三个坐标轴,称为晶轴。此时三轴长度相等为a,定义a为晶胞单位长度,长度为a的晶轴记为三个基本矢量 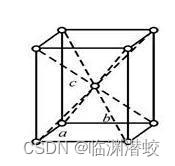 立方晶系的晶轴
立方晶系的晶轴
晶格中任意两格点可连成一条直线并且通过其它格点还可以作出许多条与此相平行的直线,从而晶格中的所有格点可以看成全部包含在这一系列相互平行的直线系上,称为晶列,晶列的取向加晶向。 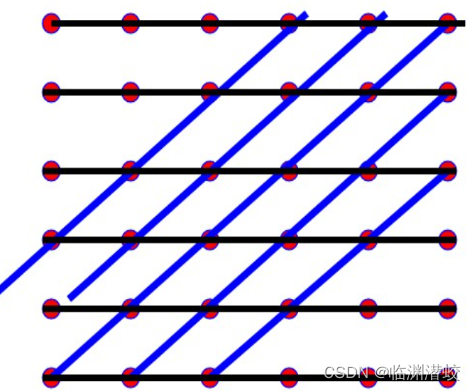 两种不同的晶列
两种不同的晶列
为表示晶向,从一个格点O沿某个晶向到另一格点p作位移矢量R,则 晶体中格点可以看作为全部包含在一系列平行等间距的平面族上——晶面族。取晶面与三个晶轴的截距r、s、t的倒数的互质整数h、k、l称为晶面指数,记作(k h l)。若截距为负数时,在指数上放加“-”。若晶面与某晶轴平行。则其对应指数为0。同类晶面记作{k h l},例如{100}代表(100)、(010)、(001)、( (1)晶向和{100}晶面上的原子排列 晶面的垂直距离称为面间距——{100}晶面的面间距为a/4; 单位面积上的原子个数为原子面密度,单位长度上的原子个数为原子线密度。在{100}晶面上原子面密度为 晶面间的单位面积内包含的共价键数目称为晶面间共价键面密度,{100}晶面间共价键面密度为 (2)晶向和{110}晶面上的原子排列 {110}的晶面间距为 {110}的原子面密度为 {110}的共价键面密度为 晶向上原子线密度为 (3)晶向和{111}晶面上的原子排列 金刚石结构在{111}面上的原子面密度为 晶向的原子线密度为 {111}晶面的共价键密度,间距大的为 (4) 晶体各向异性情况总结 晶面或晶向面间距原子面密度晶面间作用于每个原子的共价键数晶面间共价键密度原子线密度100相邻双层原子面间 双层原子面内 单个{111}面 双层原子面内 相邻双层原子面之间为1, 双层原子面内为3 相邻双层原子面之间 双层原子面内 金刚石结构沿着方向腐蚀最快。 晶面之间共价键密度以{111}面的相邻双层原子面之间为最小而面间距最大,则相邻原子链接不牢固,所以在外力作用下,硅、锗容易沿{111}面裂开,故{111}面为硅、锗的解理面。 3.GaAs晶体的极性 GaAs晶体沿[111]方向的化学腐蚀慢于[ 解理面不是{111}晶面,而是{110}晶面,但是{111}面也有微弱的解理性。 (III—V族)化合物半导体的晶轴称为极性轴。 对于大多数晶体而言,同类的晶向与晶面其原子排列方式相同,物理化学性质相同。
|
【本文地址】