| 黄铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其... | 您所在的位置:网站首页 › 铁矿渣主要成分化学式 › 黄铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其... |
黄铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其...
|
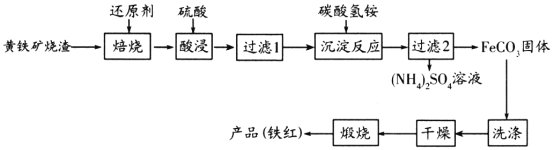
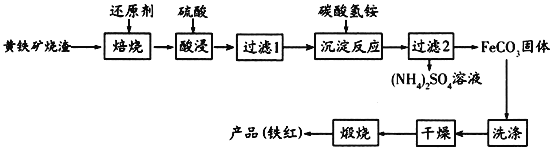
黄铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备高档颜料—铁红(Fe2O3)的流程如下:
回答下列问题: (1)“焙烧”时所添加的最佳还原剂是________(填序号)。 a.焦炭 b.硫黄 c.镁粉 d.锌粉 (2)“过滤1”后的滤液中溶质的主要成分是________________(填化学式)。 (3)“沉淀反应”时反应温度不宜过高,其原因为________(用化学方程式表示)。 (4)为检验FeCO3是否洗涤干净,可以向最后一次洗涤液中滴加________溶液。 (5)在空气中煅烧FeCO3生成铁红和另一种氧化物,反应的化学方程式为________。 (6)现有黄铁矿烧渣500t,铁元素的质量分数为16.8%,经过一系列转化后,得到90t铁红,该产品的产率为________。(提示: 高一化学工业流程中等难度题查看答案及解析 黄铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备高档颜料—铁红(Fe2O3)的流程如下:
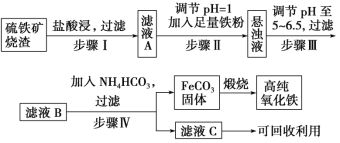
回答下列问题: (1)“焙烧”时所添加的最佳还原剂是________(填序号)。 a.焦炭 b.硫黄 c.镁粉 d.锌粉 (2)“过滤1”后的滤液中溶质的主要成分是________________(填化学式)。 (3)“沉淀反应”时不宜混入过多空气,其原因为______________________(用离子方程式表示)。 (4)为检验FeCO3是否洗涤干净,可以向最后一次洗涤液中滴加________溶液。 (5)在空气中煅烧FeCO3生成铁红和另一种氧化物,反应的化学方程式为________。 (6)现有黄铁矿烧渣500t,铁元素的质量分数为16.8%,经过一系列转化后,得到90t铁红,该产品的产率为________。(提示: 高一化学工业流程中等难度题查看答案及解析 高纯氧化铁可作现代电子工业材料。以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图。已知当溶液的pH大于6.5,Fe2+开始转化成Fe(OH)2。
(1)步骤Ⅰ中过滤所得滤渣的主要成分是________,工业上可以利用一种弱酸溶解该物质,该弱酸为________。 (2)步骤Ⅱ中加入铁粉的目的是_______。 (3)在空气中煅烧FeCO3可制备高纯氧化铁,煅烧所需的主要仪器为_____(写一种仪器名称),FeCO3在煅烧前应充分洗涤干净,写出实验室洗涤沉淀的方法____________。 (4)写出煅烧FeCO3可制备高纯氧化铁反应的化学方程式:___________。 高一化学工业流程中等难度题查看答案及解析 高纯氧化铁可作现代电子工业材料。以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图。已知当溶液的pH大于6.5,Fe2+开始转化成Fe(OH)2。
(1)步骤Ⅰ中过滤所得滤渣的主要成分是____,工业上可以利用一种弱酸溶解该物质,该弱酸为____。 (2)步骤Ⅱ中加入铁粉的目的是____。 (3)写出步骤Ⅳ中反应的离子方程式____。 (4)在空气中煅烧FeCO3可制备高纯氧化铁,煅烧所需的主要仪器为____(写一种仪器名称),FeCO3在煅烧前应充分洗涤干净,写出实验室洗涤沉淀的方法____。 (5)写出煅烧FeCO3可制备高纯氧化铁反应的化学方程式:____。 高一化学工业流程中等难度题查看答案及解析 以黄铁矿为原料制备硫酸会产生大量的废渣,合理利用废渣可以减少环境污染,变废为宝。工业上,可利用废渣(含Fe2+、Fe3+的硫酸盐及少量 CaO和MgO)制备高档颜料铁红(Fe2O3) 和回收(NH4)2SO4,具体生产流程如下。 已知:铵黄铁矾的化学式为(NH4)2Fe6(SO4)4(OH)12。
(1)在废渣溶解操作时,应选用________溶解(填字母)。 A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸 (2)为了提高废渣溶解时的浸取效率,可采用的措施有哪些?___________________(写出一点即可)。 (3)物质A 是一种氧化剂,工业上一般选用空气,其理由是___________。氧化过程中发生反应的离子方程式为_________________。 (4)根据下图有关数据,你认为工业上氧化操作时应控制的最佳温度和pH是:______。
(5) 铵黄铁矾中 可能混有的 杂质有 Fe(OH)3、____________。 铵黄铁矾与氨水反应的离子方程式为______________。 高一化学综合题中等难度题查看答案及解析 以黄铁矿为原料制硫酸会产生大量的废渣,合理利用废渣可以减少环境污染,变废为宝。工业上利用废渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如下:
(1)在废渣溶解操作时,应选用________溶解(填字母)。 A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸 (2) 为了提高废渣的浸取率,可采用的措施有哪些?_______________(至少写出两点)。
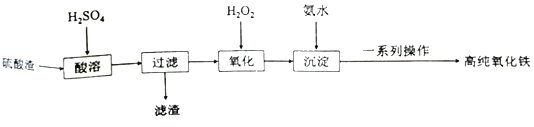
(3)物质A是一种氧化剂,工业上最好选用________(供选择使用的有:空气、Cl2、MnO2),其理由是_______________。氧化过程中发生反应的离子方程式为_________________。 (4)根据如图有关数据,你认为工业上氧化操作时应控制的条件(从温度、pH和氧化时间三方面说明)是:______________________________________________________。 (5) 铵黄铁矾中可能混有的杂质有Fe(OH)3、________。 (6) 铵黄铁矾的化学式可表示为(NH4)xFey(SO4)z(OH)w,其化学式可通过下列实验测定: ① 称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。 ② 量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。 ③ 量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体448mL,同时有红褐色沉淀生成。 ④ 将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。 通过计算,可确定铵黄铁矾的化学式为___________________________。(已知铵黄铁矾的摩尔质量为960g•mol-1,计算过程中不考虑固体损失和气体溶解。 高一化学简答题中等难度题查看答案及解析 利用硫酸渣(主要成分为Fe2O3和少量的SiO2、FeO)可以制备高纯度的氧化铁,制备流程如图:
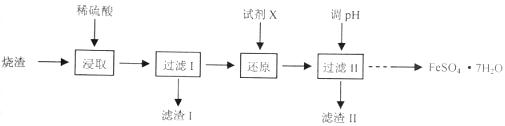
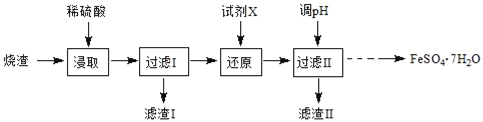
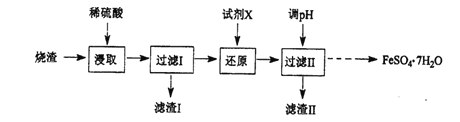
(1)滤渣的主要成分是___。 (2)“氧化”时发生反应的离子方程式为___。 (3)检验沉淀是否完全的方法为___。 (4)一系列操作包括:过滤、沉涤、干燥、___。 (5)用高温分解FeSO4也可以制备较纯的Fe2O3,写出反应的化学方程式___。 (6)上述硫酸渣含铁28%,现需高纯氧化铁64吨,理论上需用硫酸渣多少吨?___(写出计算过程) 高一化学工业流程中等难度题查看答案及解析 工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:
请回答下列问题。 (1)滤渣Ⅰ的主要成分是___(填化学式)。 (2)从分离出滤渣Ⅱ后的滤液中得到产品,应进行的操作是___、___、过滤、洗涤、干燥。 (3)还原时,试剂X若选用SO2,则该反应的离子方程式为___。 (4)绿矾(FeSO4·7H2O)若保存不当或长期放置,易与空气中的氧气反应,检验绿矾是否被氧化的方法是___。 高一化学工业流程中等难度题查看答案及解析 工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4•7H2O),流程如图:
(1)滤渣Ⅰ的主要成分是_________(填化学式)。 (2)还原时,试剂X若选用SO2,则反应后的阴离子是_________(填化学式)。 (3)从分离出滤渣II后的滤液中得到产品,应进行的操作是_________、_________、过滤、洗涤、干燥。 (4)七水合硫酸亚铁(FeSO4•7H2O) 在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。 步骤a:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL溶液; 步骤b:取上述溶液25mL于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.0100mol/L的KMnO4溶液,至恰好完全反应,记录消耗的KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应),发生的反应为:MnO4﹣+5Fe2++8H+=5Fe3++Mn2++4H2O; 步骤c:重复“步骤b”2~3次,平均消耗KMnO4溶液20.00mL。 ①步骤a中配制溶液时需要的玻璃仪器除烧杯、胶头滴管外,还需要_________、_________。 ②该补血剂中亚铁离子的含量为_________mg/片。 高一化学综合题困难题查看答案及解析 工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:
(1)滤渣I的主要成分是_______________(填化学式)。 (2)还原时,试剂X若选用SO2,则反应后溶液中的阴离子是_________________(填化学式) (3)检验过滤Ⅰ得到的滤液中存在Fe3+的方法是____________________。 (4)七水合硫酸亚铁(FeSO4·7H2O)在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。 步骤a:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL溶液; 步骤b:取上述溶液25 mL于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.0100 mol/L的KMnO4溶液,至恰好完全反应,记录消耗的KMnO4溶液的体积(假定药品中其他成分不与KmnO4反应),发生的反应为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O; 步骤c:重复“步骤b”2~3次,平均消耗KMnO4溶液20.00mL。 ①步骤a中配制溶液时需要的玻璃仪器除烧杯、胶头滴管外,还需要___________、________。 ②该补血剂中亚铁离子的含量为mg/片(请写出计算过程) ___________。 高一化学综合题中等难度题查看答案及解析 |
【本文地址】