| 进行m6A热点研究,先Get这『3大研究区域、2大报告系统』 | 您所在的位置:网站首页 › 荧光报告基因属于什么 › 进行m6A热点研究,先Get这『3大研究区域、2大报告系统』 |
进行m6A热点研究,先Get这『3大研究区域、2大报告系统』
|
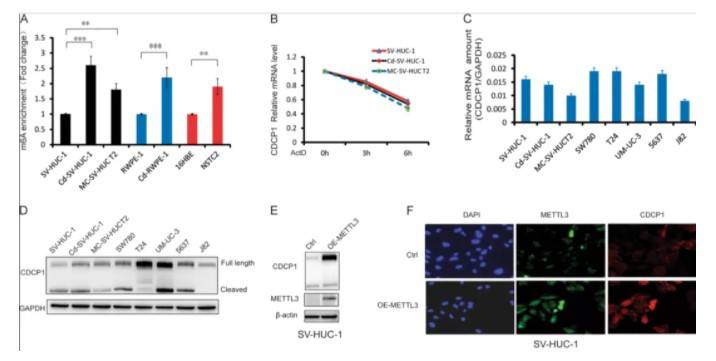
D. m6A修饰上调的基因; E. m6A修饰下调的基因 根据早先报道的文献,差异基因中,CDCP1属于癌基因。进一步验证CDCP1-m6A的修饰情况:
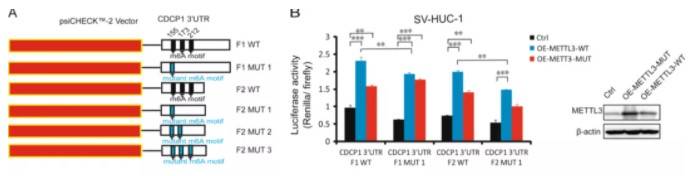
A. 癌细胞CDCP1的m6A明显升高; B-C.正常细胞与癌细胞的CDCP1水平无明显变化; D-F.癌细胞CDCP1蛋白表达增强,且与METTL3的催化正相关 鉴定出的基因根据其m6A修饰位置,采取不同方式构建报告系统,并验证其对应功能即可(下面简叙3UTR-m6A研究路径,其余位置只突出报告系统部分)。 一、3UTR-m6A研究方式m6A在3'非翻译区(UTR)特别丰富,也是目前常做的类型,主要是影响蛋白表达(接上文): CDCP1在3UTR上含有多个m6A修饰位点,通过构建双荧光素酶报告系统,构建全长、截断型、突变型,与催化蛋白METTL3野生型、突变型共转,逐一验证修饰位点与基因表达的关系,最终确认,3UTR的三个m6A修饰共同促进CDCP1的上调表达2:
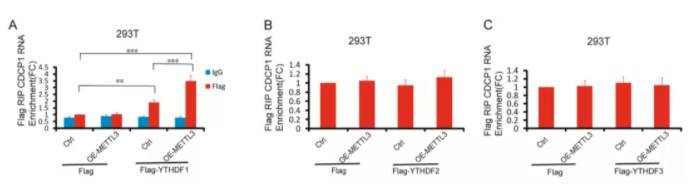
A.构建CDCP1-3utr三个m6A位点野生型、突变型(A突变为T)报告系统;B.报告载体与野生型以及催化突变体METTL3共转测定相对荧光素活性 作者进一步测试了读码器YTHDFs是否结合CDCP1-mRNA,RNA免疫沉淀分析表明,YTHDF1,而不是YTHDF2或YTHDF3与CDCP1 mRNA结合,得出METTL3 / YTHDF1识别CDCP1 3'-UTR上的m6A残基:
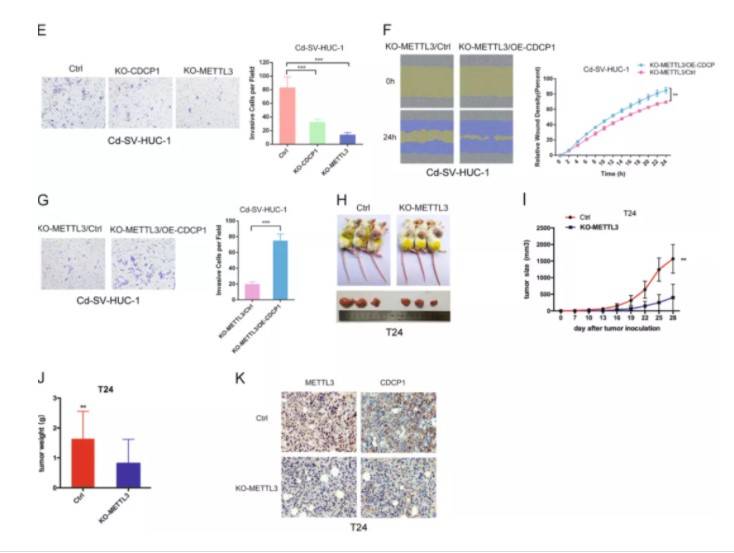
A-C. CDCP1的RNA免疫沉淀验证 在已经验证出肿瘤细胞中CDCP1的上调与METTL3 / YTHDF1修饰有关,剩余的实验则基于甲基化修饰相关基因以及目标蛋白在细胞以及动物水平进行KO或者过表达进行验证即可:
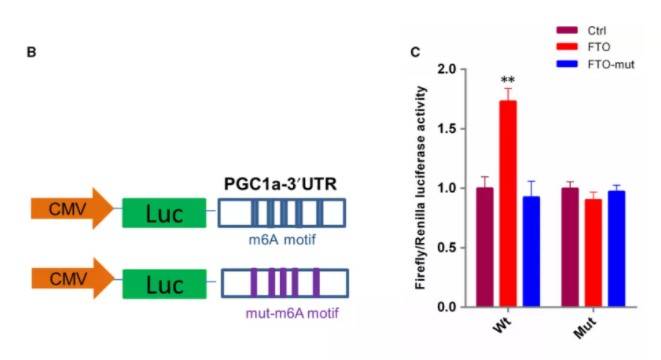
E.敲除METTL3,CDCP1抑制细胞迁移和侵袭;F-G.CDCP1过表达部分挽救了METTL3耗竭引发的细胞迁移和侵袭;H-J.METTL3敲除抑制了肿瘤生长;K.免疫染色 同样,消码器也是采取上述方法验证:m6A脱甲基酶FTO的下调与透明细胞癌发生相关,FTO的下调导致了PGC-1α下调,影响了线粒体的功能。通过构建3UTR的全长野生型及m6A突变型(文章A突变为C)报告系统,与FTO过表达共转,验证出FTO作用于PGC-1α的3UTR,促进表达3:
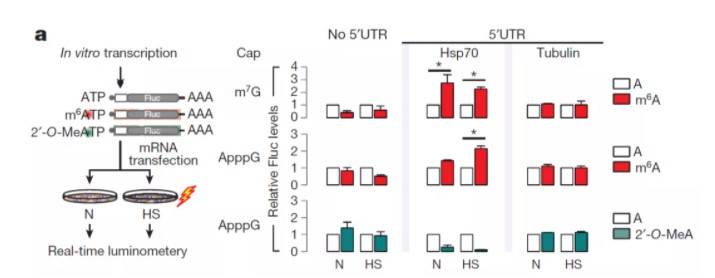
B,构建PGC-1α-3UTR野生型、突变型报告系统,与FTO及对照共转染;C,FTO特异性增强了野生型的表达 二、5UTR-m6A研究方式发生于5UTR的m6A可以促进了不依赖帽的翻译起始,增强蛋白表达。文章通过合成5UTR未修饰、m6A修饰、非m6A甲基化的的荧光素酶RNA全长,转染293,结果只有m6A修饰的发生翻译4:
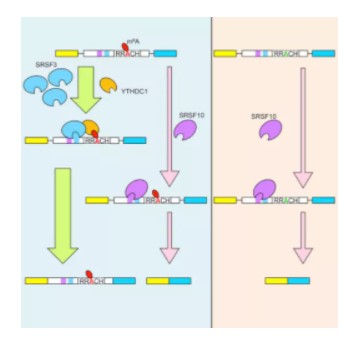
5UTR报告系统构建及结果验证(2’-O-MeA为对照) 三、pre-mRNA-m6A研究方式m6A修饰在pre-mRNA中的分子机制,则依靠反式作用因子影响剪切的发生: 为了验证参与剪切的蛋白,通过串联亲和纯化SFB-YTHDC1获取到了多个互作蛋白SRSF1,SRSF3,SRSF7,SRSF9和SRSF10,并进一步验证得出了下面的互作功能模型,YTHDC1/SRSF3复合物倾向于外显子保留,而SRSF10促进外显子剪切去除5:
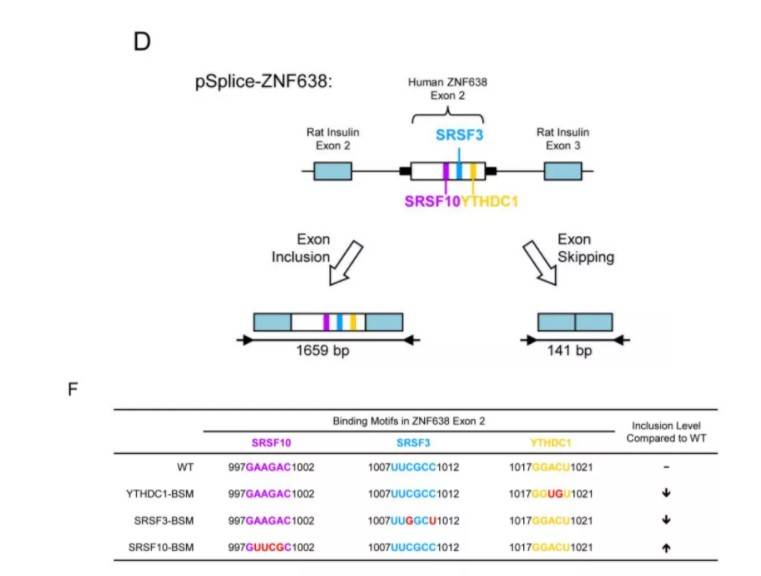
外显子中的m6A修饰引发的可变剪切 通过构建miniGene报告系统,将ZNF638外显子2克隆到pSpliceExpress载体5,分别构建YTHDC1、SRSF3、SRSF10结合位点的突变型,验证可变剪切机制:
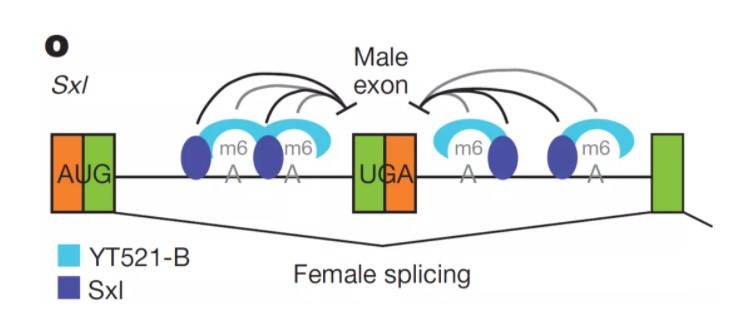
D.构建示意图以及猜测的外显子剪切情况;F,YTHDC1、SRSF3的突变都导致了外显子2的去除,SRSF10的突变导致了外显子2的保留增加 同样,内含子也含有m6A修饰:果蝇基因SXL内含子中m6A的修饰与否决定了性别,m6A的修饰产生了一个外显子的可变剪切,雌性内含子含有m6A修饰,缺失了外显子;而雄性不含m6A,保留了一个外显子,该机制同样可以基于上述的miniGene报告系统研究6:
果蝇Sxl内含子修饰引发的可变剪切 表观遗传学已成为时下科研热门研究方向,本文重点论述了mRNA不同位置的功能特征以及研究方法。当然,读码器的不同,具体的机制也是有差异的。吉凯基因提供meRIP-seq测序、报告系统验证一站式服务,还在等什么,快来咨询吧!!! 欢迎添加微信:GENECHEM_H,来咨询吧【参考文献】 1.m6A modification in RNA: biogenesis, functions and roles in gliomas 2.Dynamic m6A mRNA methylation reveals the role of METTL3-m6A-CDCP1 signaling axis in chemical carcinogenesis: 3. N6‐methyladenosine demethylase FTO suppresses clear cell renal cell carcinoma through a novel FTO‐PGC‐1α signaling axis 4. Dynamic m6A mRNA methylation directs translational control of heat shock response 5. Nuclear m6A Reader YTHDC1 Regulates mRNA Splicing 6. m6A potentiates Sxl alternative pre-mRNA splicing for robust Drosophila sex determination返回搜狐,查看更多 |
【本文地址】