| 范特霍夫方程 | 您所在的位置:网站首页 › 范特霍夫 › 范特霍夫方程 |
范特霍夫方程
|
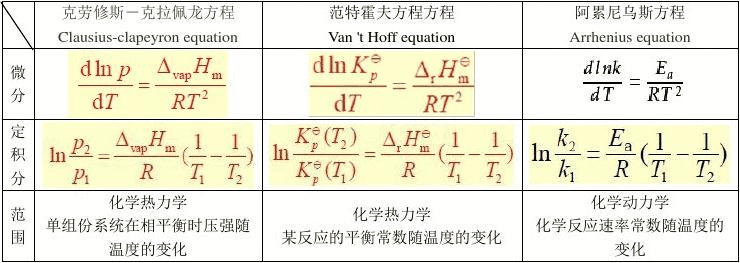
目录 1 范特霍夫方程 2 方程式 ▪ 总结和使用 ▪ 从热力学发展 ▪ 范\特霍夫等温线范特霍夫方程 编辑 给定过程的标准焓变 ΔrH⊖,范特霍夫方程将化学反应的平衡常数 Keq 的变化与温度 T 的变化联系起来。 它是由荷兰化学家 Jacobus Henricus van\'t Hoff 于 1884 年在其著作 Études de Dynamique chimique(动态化学研究)中提出的。 范特霍夫方程序已被广泛用于探索热力学系统中状态函数的变化。 从该方程导出的 Van \'t Hoff 图在估计化学反应的焓变和熵变时特别有效。 方程式 编辑总结和使用标准压力 P 0 {\\displaystyle P{0}} 用于定义 Van \'t Hoff 方程的参考状态,即 d d T ln K e q = Δ r H ⊖ R T 2 {\\displaystyle {\\frac {d}{dT}}\\ln K_{\\mathrm {eq} }={\\frac {\\Delta _ {r}H{\\ominus }}{RT{2}}}} 其中 ln 表示自然对数, K e q {\\displaystyle K_{eq}} 是热力学平衡常数,R 是理想气体常数。 该方程式在任何一个温度和所有压力下都是精确的,源于反应的吉布斯自由能在化学平衡状态下保持稳定的要求。 实际上,假设标准反应焓 Δ r H ⊖ {\\displaystyle \\Delta _{r}H{\\ominus }} 是常数(此外,这也是 通常假定等于其在标准温度下的值)。 因为实际上 Δ r H ⊖ {\\displaystyle \\Delta _{r}H{\\ominus }} 和标准反应熵 Δ r S ⊖ {\\displaystyle \\Delta _{r}S{\\ominus }} 对于大多数过程来说确实随温度变化,积分方程只是近似的。 在实践中也对平衡常数内的活度系数进行了近似。 积分方程的一个主要用途是估计新的xxx温度下的新平衡常数,假设在整个温度范围内标准焓变恒定。 为了获得积分方程,首先将 Van\'t Hoff 方程重写为 d ln K e q d 1 T = − Δ r H ⊖ R 。 {\\displaystyle {\\frac {d\\ln K_{\\mathrm {eq} }}{d{\\frac {1}{T}}}}=-{\\frac {\\Delta _{ r}H{\\不记号}}{R}}。} 温度 T1 和 T2 之间的定积分是 ln K 2 K 1 = Δ r H ⊖ R ( 1 T 1 − 1 T 2 ) 。 {\\displaystyle \\ln {\\frac {K_{2}}{K_{1}}}={\\frac {\\Delta _{r}H{\\ominus }}{R}}\\ 左({\\frac {1}{T_{1}}}-{\\frac {1}{T_{2}}}\\右)。} 在此等式中,K1 是xxx温度 T1 下的平衡常数,K2 是xxx温度 T2 下的平衡常数。 从热力学发展结合著名的吉布斯反应自由能公式 Δ r G ⊖ = Δ r H ⊖ − T Δ r S ⊖ , {\\displaystyle \\Delta _{r}G{\\ominus }=\\Delta _{r}H{\\ominus }-T\ \Delta _{r}S{\\ominus },} 其中 S 是系统的熵,具有吉布斯自由能等温方程: Δ r G ⊖ = − R T ln K e q , {\\displaystyle \\Delta _{r}G{\\ominus }=-RT\\ln K_{\\mathrm {eq} },} 我们获得 ln K e q = − Δ r H ⊖ R T + Δ r S ⊖ R 。 {\\displaystyle \\ln K_{\\mathrm {eq} }=-{\\frac {\\Delta _{r}H{\\ominus }}{RT}}+{\\frac {\\Delta _{r}S{\\省略}}{R}}。} 假设 Δ r H ⊖ {\\displaystyle \\Delta _{r}H{\\ominus }} 和 Δ r S ⊖ {\\displaystyle \\Delta _{ r}S{\\ominus }} 独立于 T 产生 Van \'t Hoff 方程。 对于较大的温度变化,预计这些假设会有所推翻。 假设 Δ r H ⊖ {\\displaystyle \\Delta _{r}H{\\ominus }} 和 Δ r S ⊖ {\\displaystyle \\Delta _{r}S{\\ominus }} 是常数, 前面的方程给出了 ln K 作为 1/T 的线性函数,因此被称为 Van\'t Hoff 方程的线性形式。 因此,当温度范围小到标准反应焓和反应熵基本恒定时,平衡常数的自然对数与温度倒数的关系图给出一条直线。 直线的斜率可以乘以气体常数R得到反应的标准焓变,截距可以乘以R得到标准熵变。
Van \'t Hoff 等温线可用于确定恒温下非标准状态反应的吉布斯反应自由能的温度依赖性: ( d G d ξ ) T , p = Δ r G = Δ r G ⊖ + R T ln Q r , {\\displaystyle \\left({\\frac {dG}{d\\xi }}\\right )_{T,p}=\\Delta _{\\mathrm {r} }G=\\Delta _{\\mathrm {r} }G{\\ominus }+RT\\ln Q_{\\mathrm {r} },} 其中 Δ r G {\\displaystyle \\Delta _{\\mathrm {r} }G} 是在温度 T {\\displaystyle T} 下非标准状态下反应的吉布斯自由能, Δ r G ⊖ {\ \displaystyle \\Delta _{r}G{\\ominus }} 是反应 a 的吉布斯自由能。 内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/216094/ |
【本文地址】
| 今日新闻 |
| 推荐新闻 |
| 专题文章 |