| 6.2:势能、动能、自由能和活化能 | 您所在的位置:网站首页 › 自由能变化的单位 › 6.2:势能、动能、自由能和活化能 |
6.2:势能、动能、自由能和活化能
|
免费能源
在得知化学反应在能量储存键破裂时会释放能量之后,下一个重要问题是如何量化和表达与化学反应相关的能量? 如何将一种反应释放的能量与另一种反应释放的能量进行比较? 自由能的测量用于量化这些能量传递。 自由能以开发测量方法的科学家约西亚·威拉德·吉布斯的名字命名为吉布斯自由能(用字母 G 缩写)。 回想一下,根据热力学第二定律,所有能量转移都涉及以不可用形式(例如热)损失一定数量的能量,从而产生熵。 Gibbs 自由能专门指与化学反应相关的能量,这种能量在计算熵后可用。 换句话说,吉布斯的自由能是可用能量,或可用于工作的能量。 每一次化学反应都涉及自由能的变化,称为 delta G (G)。 可以计算任何经历这种变化的系统(例如化学反应)的自由能变化。 要计算 ΔG,请从系统的总能量变化中减去熵损失的能量(以 S 表示)。 系统中的总能量变化称为熵,表示为 H。 计算 ΔG 的公式如下,其中符号 T 表示以开尔文为单位的绝对温度(摄氏度 + 273): 在此站点观看从自由能转变为过渡状态的动画。 化学反应物所需的活化能来自哪里? 推动反应向前推进所需的活化能来源通常是来自周围的热能。 热能(化学反应中反应物或产物的总键能)加快了分子的运动,增加了它们碰撞的频率和力;它还会稍微移动分子内的原子和键,帮助它们达到过渡状态。 因此,加热系统将导致该系统内的化学反应物更频繁地发生反应。 增加系统的压力也有同样的效果。 一旦反应物从周围环境吸收了足够的热能以达到过渡状态,反应就会继续。 特定反应的活化能决定其进行速度。 活化能越高,化学反应就越慢。 铁生锈的例子说明了本质上是缓慢的反应。 由于其高E A,这种反应会随着时间的推移缓慢发生。 此外,除非火花产生的充足热量消耗了许多燃料的活化能,否则其燃烧速度将可以忽略不计。 但是,一旦它们开始燃烧,化学反应就会释放足够的热量来继续燃烧过程,为周围的燃料分子提供活化能。 就像细胞外的这些反应一样,大多数细胞反应的活化能过高,热能无法有效克服。 换句话说,为了使重要的细胞反应以可观的速度(每单位时间的反应次数)发生,必须降低其活化能(图\(\PageIndex{1}\)\(\PageIndex{5}\));这被称为催化。 就活细胞而言,这是一件非常好的事情。 重要的大分子,例如蛋白质、DNA和RNA,会储存大量能量,并且它们的分解是有效的。 如果仅靠细胞温度就能为这些外激反应提供足够的热能以克服其激活屏障,那么细胞的基本成分就会分解。 艺术连接 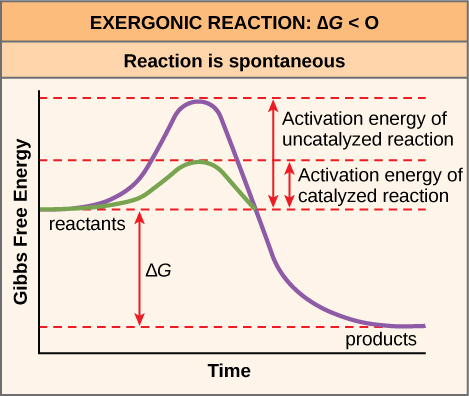 图\(\PageIndex{5}\):活化能是反应进行所需的能量,如果反应被催化,则活化能较低。 此图的水平轴描述了事件的时间顺序。
图\(\PageIndex{5}\):活化能是反应进行所需的能量,如果反应被催化,则活化能较低。 此图的水平轴描述了事件的时间顺序。
如果不需要活化能来分解蔗糖(食用糖),你能把它储存在糖罐里吗? |
【本文地址】