| 可逆反应的自发性能用ΔG判断吗 | 您所在的位置:网站首页 › 自由能变△g大于0 › 可逆反应的自发性能用ΔG判断吗 |
可逆反应的自发性能用ΔG判断吗
|
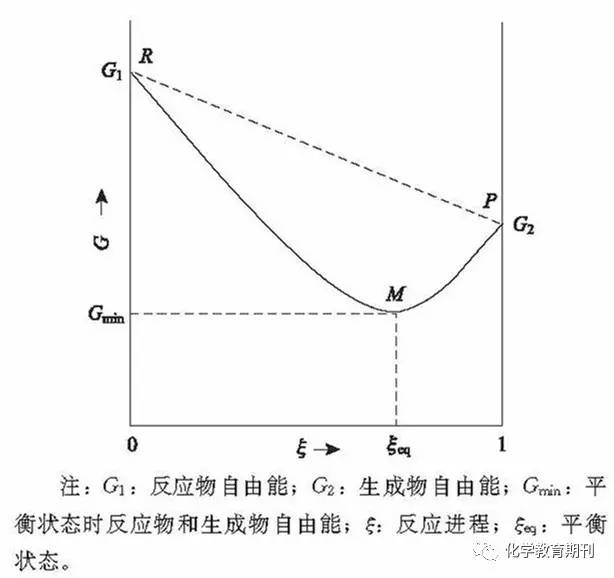
4 研究与分析 在进行真正的研究之前,不妨这样来想这个问题:在自然界中,所有反应都是可逆的,只是由于可逆的程度不同,才将其分为可逆反应与不可逆反应。由此可以看出,可逆反应与不可逆反应本质上是没有区别的,那么适用于不可逆反应的吉布斯自由能变公式自然也适用于可逆反应。可为什么按照之前问题探讨的思路,就会出现不适用的状况呢?下面通过2种方式来探讨这个问题。 4.1 吉布斯自由能变 首先假设一个在等温等压条件下的可逆反应:A(g)+B(g) «C(g)+D(g),对于一个物质,它是具有自由能(G)的,同时也是具有焓(H)与熵(S)的,其关系满足吉布斯函数G=H-TS(T为热力学温度,必大于零)。 当一个反应开始后,反应体系必然是要对外做功的,其做功的大小就是自由能变ΔG:ΔG=G2-G1=(H2-H1)-T(S2-S1)=ΔH-TΔS。由此可以看出,不论是焓变、熵变,还是自由能变,都是末状态与初状态的差值。而在使用焓变和熵变计算自由能变的时候,代入的是标准摩尔焓变和标准摩尔熵变,计算出的是标准摩尔自由能变,这些数值都是一个反应在完全反应的情况下的数值,在计算关于不可逆反应的自由能变时,这样计算是完全没有问题的,因为不可逆反应是可以完全反应的。但是可逆反应是不能完全反应的,所以在计算时应用末状态自由能值减初状态自由能值,这样得到的自由能变值才具有判断意义[1]。 那么如何理解可逆反应的自发性呢?首先反应体系中的物质是具有自由能的,这是一种能量。所以在无外力做功的情况下,反应体系会从高能量状态变为低能量状态,达到一种更为稳定的状态。 对于一个可逆反应,从反应体系的自由能变化(如图1所示)可以知道,平衡状态的自由能确实比两头都小,它是一个极小值,无论从“哪头”投料,即无论起始状态是什么样,它都会降低自由能,朝着化学平衡状态的方向移动。对于这个问题,需要从宏观角度去思考,因为吉布斯函数本身就是一个宏观函数,只有从宏观上去看一个反应,才能使公式与反应相吻合。宏观上的转化方向,才是我们说的“自发”,而不是微观上的分子同时在解离,就可以说它们都是自发的。而实际上,对于可逆的化学反应来说,正反应方向与逆反应方向哪个反应速率更大,宏观上就是向哪个方向自发反应的。事实上,一个可逆反应在反应的过程中也是不可逆的。对于可逆反应,初状态是投料时的状态,而末状态则是平衡状态。在不改变体系条件的状况下,反应只会最终达到平衡,不会再改变,这就是可逆反应的不可逆。比如最初给的是反应物A、B,当反应向正方向进行时,C、D在宏观上只会越来越多,所以C、D的分解就不是自发的。而到了平衡状态,我们说在宏观上反应“静止”,ΔG为0,也是这个道理,我们不必去关心微观上是在建立一个动态平衡。
图1 可逆反应体系吉布斯自由能变化 结合图1再来分析一下之前的错误做法。代入的ΔH与ΔS是R点到P点的变化量,得出ΔG<0,反应自发,其逆反应ΔG>0,不可自发,从图上来看也是没错的,这符合之前有关势能的理解。但要注意,这种理解实际上把这个反应看成了不可逆反应,在图中以虚线表示。当知道了平衡态的自由能最低时,就会发现无论是从R到M,还是从P到M,其ΔG都是小于零的,这也符合一个可逆反应无论从哪个方向开始反应最终都会平衡的客观事实,所以可逆反应的正逆反应都是自发的。 吉布斯自由能是过程自发性的判断,它的大小相当于系统向环境作最大可能的有用功,因此,也可以说,吉布斯自由能是系统做有用功的本领的度量,也就是系统过程自发性的度量。不过不要忘记,前面已经明确,吉布斯自由能用以度量系统作最大有用功的条件是等温等压。若发生等温等容过程或其他过程,需要另作别论。 通过上述研究,我们便可以更好地理解吉布斯自由能变与自发性的关系:ΔG<0,过程自发;ΔG>0,过程不自发(逆过程自发);ΔG=0,达到平衡状态。一个自发过程,随着过程的发展,ΔG的绝对值渐渐减小,过程的自发性渐渐减弱,直到最后,ΔG=0,达到平衡。 4.2 范特霍夫等温方程 我们再从另一种角度解释可逆反应的自发性,同样,讨论的前提是反应体系等温等压。 首先,要先引入一个公式——范特霍夫等温方程:ΔG=ΔG0+RTlnQ,其中,ΔG0为一定温度下标准吉布斯自由能变,Q为该反应商,R为大于零的常数,T为热力学温度。反应商在气体反应中叫做气压商,在溶液反应中叫做浓度商。 在等温等压反应中,如果吉布斯自由能为负,则正反应自发,反之则逆反应自发。如果吉布斯自由能为零,则反应处于平衡状态,此时,Q变成平衡常数K,根据范特霍夫等温方程:ΔG=ΔG0+RTlnQ,于是有: ΔG0=-RTlnK 再把上式代入原公式得到: ΔG=RTln(Q/K) 这样就可以在公式的基础上,利用数学方式解释可逆反应的自发性。对于反应A(g)+B(g) «C(g)+D(g),当反应向正方向进行时,宏观上是由A、B生成C、D的过程,在未达到平衡时,Q<K,可得ΔG<0,此时从宏观上来说正反应是自发的。如果Q>K,此时反应向逆方向进行,ΔG>0,注意,Q与K均是以正反应方向来计算的,就说明宏观上正反应是不可自发的,于是相对的,逆反应就是可自发的。如果将化学反应方程式反过来再进行计算,此时得到的值与之前的Q/K互为倒数,但最终的结果和上面是相同的。 于是,从数学角度再次证明了可逆反应的自发性是符合ΔG判据的。 5 结论 通过探究,最终可以得出在等温等压的封闭体系内,不作非体积功的前提下,任何自发反应总是朝着吉布斯自由能(G)减小的方向进行。ΔG=0时,反应达平衡,体系的G降到最小值。ΔG判据是适用于可逆反应的。 参考文献 [1]上海师范大学, 河北师范大学, 华中师范大学,等. 物理化学.3版.北京:高等教育出版社,1980:71-77,125-136 引用本文 张天民. 可逆反应的自发性能用ΔG判断吗[J]. 化学教育, 2017, 38(9): 63-65 文章推荐 《化学教育》是教师专业发展的好参谋、好助手、好伙伴! 补订2017年《化学教育》办法 国家级全国中文核心期刊 栏目整合 印刷换新 品质提升 权威、客观、全面、实用 《化学教育》是中国科学技术协会主管,中国化学会、北京师范大学共同主办的国家级全国中文核心期刊,被北京大学《中文核心期刊要目总览》2008版、2011版和2014版连续收录,排同类期刊第1名;美国化学文摘(CA)收录源期刊。 《化学教育》为半月刊,全年共计24期,每期16元,全年共计384元。为了保证能及时收到期刊,由中国邮政承担订阅及投递服务。 订阅方式1:请到当地就近邮局的报刊订阅窗口办理,邮发代号为2-106。 订阅方式2:微信订阅,请扫描下方的二维码,进入订阅页面,按照步骤依次操作:选择投送地区—填写订阅份数—单击立即购买—提交订单—(如果首次操作,请按照提示添加详细可靠的收获地址)—确认订单—微信支付,即可完成订阅。请记住CNSI开头的订单号,以便查询,由“中国邮政”微信公众服务号提供查询和客户服务,全国统一客服电话:11185-9-2。 立即扫码订阅 有化学课程的地方,就应该有《化学教育》期刊! 微信征稿:观点评述、教学案例、教学心得、微课视频、实验视频、趣味实验、活动报道、科普文章、论文交流、人物事迹、试题评析等,新鲜、热门、有趣、实用,统统都可以,让分享促进你我成长,让传播增强化学力量!如果文章阅读人数超过3000,朋友圈分享人数超过300,则赠送1套全年《化学教育》!投稿邮箱:,邮件主题请写明“微信投稿”。鼓励原创,若参考了他人的文章,请注明来源,以免引起抄袭和剽窃的争议。返回搜狐,查看更多 |
【本文地址】