| 2020版药典:胶囊(空心胶囊)通则发布草案 | 您所在的位置:网站首页 › 胶囊的外壳是什么成分 › 2020版药典:胶囊(空心胶囊)通则发布草案 |
2020版药典:胶囊(空心胶囊)通则发布草案
|
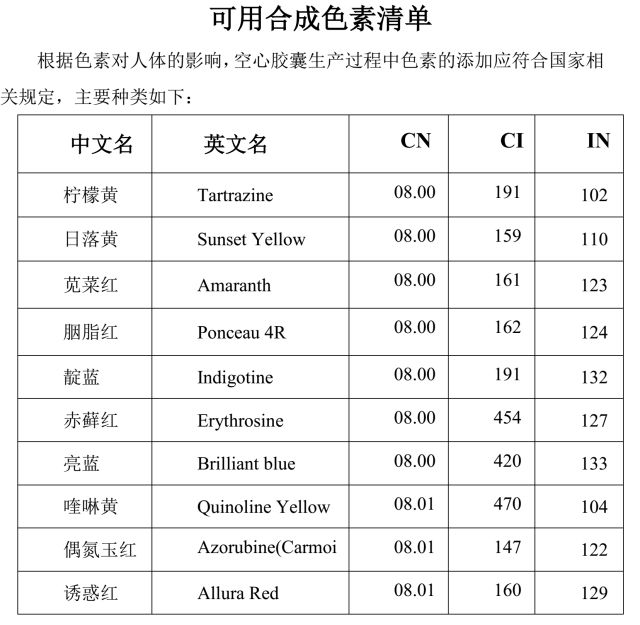
空心胶囊作为胶囊剂的药用辅料,安全性、适用性等方面应符合《中国药典》胶囊剂下的通用要求。 2. 空心胶囊分类 2.1 按照成膜材料来源 根据空心胶囊主要成膜材料的来源进行分类,可分为动物源的空心胶囊和非动物源的空心胶囊。 动物源的空心胶囊是指空心胶囊主要成膜材料始源于动物。非动物源的空心胶囊是指空心胶囊生产用成膜材料为非动物源性且不含有任何动物源物质。例如羟丙甲纤维素空心胶囊、普鲁兰多糖空心胶囊、羟丙基淀粉空心胶囊等,应注明其成膜材料来源。 2.2 按照用途 根据空心胶囊在人体特定部位释放内容物的情况进行分类,可分为胃溶空心胶囊和肠溶空心胶囊,肠溶空心胶囊可包括结肠肠溶空心胶囊等。 2.3 按照透明度 空心胶囊分为透明胶囊(帽体均不含遮光剂)、半透明胶囊(仅帽或体一节含遮光剂)、不透明胶囊(帽体均含遮光剂)三种。 3. 命名原则 除另有规定外,空心胶囊的总体命名原则应与辅料命名原则一致,结合目前常用胶囊品种,现对空心胶囊的命名做如下规定:“用途”+“主要成膜材料”+“空心胶囊”。 一般胃溶胶囊不必注明其胃溶“用途”。其辅助成分不必在名称中体现,而其他特殊功能的胶囊应体现特殊功能,例如“肠溶明胶空心胶囊”,“肠溶”显示其用途是在小肠或结肠内释放内容物,“明胶”为其主要成膜材料。 4. 制备 空心胶囊生产企业应按照用于获准上市制剂、并在监管部门备案的生产工艺组织生产并保证供应链的安全。所有辅助材料的添加和使用均应合法安全。 空心胶囊生产企业所使用的成膜材料及辅助材料符合药用或食品要求;应注明配方成分的来源、使用量以及执行标准等,若配方或配方量发生变化,应按照相关规定进行变更。 4.1 成膜材料控制 4.1.1 动物源成膜材料主要为明胶 明胶为动物的皮、骨、腱与韧带中胶原蛋白不完全酸水解、碱水解或酶降解后纯化得到的制品。明胶主要来源于健康动物的新鲜牛骨(皮)、猪骨(皮)等;原料供应商应出具相应机构的检疫合格证书和相应记录,做到来源可追溯;牛源性材料应来源于无疯牛病疫情地区。应注明制备明胶动物来源为猪骨(皮)、牛骨(皮)、或有猪骨(皮)和牛骨(皮)混合来源。应加强对动物组织运输过程中使用的防腐剂控制,并确保在后期生产工艺过程中能够有效去除。 4.1.2 非动物来源成膜材料,主要为羟丙甲纤维素、普鲁兰多糖、羟丙基淀粉等。胶囊使用的成膜材料应符合《中国药典》相应标准。 4.2 辅助材料 辅助材料一般包括保湿剂、表面活性剂、必要时可加着色剂、遮光剂等其中的一种或几种辅助成份。保湿剂通常使用甘油、聚乙二醇类等;表面活性剂通常使用十二烷基硫酸钠等;着色剂应符合药用要求或食品要求的色素;遮光剂通常使用二氧化钛等。着色剂应使用应符合药用或食品要求的色素。 4.2.1 抑菌剂 生产企业应对空心胶囊的生产过程进行全面控制,有效控制微生物的污染。原则上,配方中不使用抑菌剂。如要使用时,选择安全性高的抑菌剂,并根据抑菌效力试验确定抑菌剂的用量,并对所使用的抑菌剂的剂量进行安全性评估。经确认的抑菌剂种类和用量,应在配方中加以标注,不得随意变更。同时建立科学有效的抑菌剂含量测定方法,抑菌剂含量,应为标示量的 80%~120%。 4.2.2 着色剂 空心胶囊生产中应避免和减少色素的使用,如果需要使用,应为《食品安全国家标准食品添加剂使用标准》(GB2760)和《中国药典》中允许使用的种类。合成色素品种不超过色素清单规定的范围(见附件)。空心胶囊每种颜色配色使用色素不得超过三种;添加总量原则上不超过空心胶囊总重量的 0.5%。并在配方中注明使用色素的种类。使用色素的质量由空心胶囊生产企业负责。 4.2.3 油墨 生产过程中应避免使用印字工艺,若需使用印字工艺,应选择对人体无害、安全无苯及苯类的油墨,符合药用或食用标准。油墨的溶剂残留应符合《中国药典》残留溶剂的规定。 4.3 生产工艺 空心胶囊生产企业应按照用于获准上市制剂、并在监管部门备案的生产工艺组织生产。 空心胶囊生产工艺应进行充分验证,制定合理的工艺参数,确保工艺的稳定性以及产品的批间一致性。当空心胶囊的配方、配方量、生产工艺和质量标准等发生变化是时,其生产企业应主动开展相应的质量评估,及时通知药品生产企业,并按相关要求向国家药品监督管理机构报送相关资料,变更有关信息。 空心胶囊作为药用辅料,在生产过程中,应对其生产环境进行控制,整个生产过程必须在洁净区内完成,洁净区至少应符合D级洁净度要求。 为控制空心胶囊的污染程度,采用灭菌或添加抑菌剂等生产工艺,需对安全性进行评估,进行工艺验证,不能对胶囊成分产生影响。若采用环氧乙烷,需对灭菌的有效浓度,残留量进行控制和验证。 对采用的灭菌或去除微生物污染的方法,应保证空心胶囊成分的安全性,并经过工艺验证,确保灭菌或去除微生物污染的效果。对采用化学方法进行微生物污染的去除或杀灭微生物的,应对使用的化学试剂安全性进行评估,并对灭菌剂的残留限度进行检测,制定安全合理的限度指标。 肠溶空心胶囊结构为空心胶囊外包肠溶包衣而成,肠溶包衣材料主要为纤维素酯类等。其生产工艺通过配制胶液和包衣液,蘸胶、烘干后蘸包衣液、二次烘干、脱模、切割、套合,形成肠溶空心胶囊。 胃溶空心胶囊系生产工艺通过配制胶液、蘸胶、烘干、脱模、切割、套合,形成胃溶空心胶囊。 空心胶囊的批次应以在一定时间间隔内,采用相同成膜材料配方、同一工艺条件、同一条生产线,同一规格、连续生产的产品为一个批次;每批产品的生产过程具有可追溯性、质量均一性和批间稳定性。原则上,每批产品不超过3000万粒。 4.4 检查项目 一般包括但不仅限于以下项目: 【鉴别】、【松紧度】、【脆碎度】、【崩解时限】、【干燥失重】、【炽灼残渣】、【重金属】、【微生物限度】。 除另有规定外,空心胶囊应根据胶囊制剂的要求确定以上项目的指标,并参照现行版《中国药典》中的方法进行项目检查。 5. 空心胶囊的适用性 空心胶囊主要用作口服制剂载体,可填充固体、液体、半固体内容物。应按照《药用辅料适用性研究指导原则》(制定中)的有关规定以及空心胶囊和内容物的特点开展适用性研究。以保证内容物装量准确、溶出度符合设计要求、药物和空心胶囊相容、质量稳定。 明胶空心胶囊、明胶肠溶空心胶囊的适用性研究应关注随着放置时间而发生明胶分子内、明胶分子间、明胶-药物间、明胶-其它物料的交联,如发生交联导致制剂溶出度不符合要求,可在溶出介质中加入一定效价的胃蛋白酶或胰蛋白酶进行溶出度试验(应进行体内外相关性研究)。 肠溶空心胶囊应保证胶囊的耐酸力和不同pH下的溶出度,以确保药物在肠道中的溶出。 非明胶空心胶囊的水分往往低于明胶空心胶囊,可适用于对水分敏感的药物,但其崩解时间往往较长,应关注对药物溶出度、生物利用度的影响,以保证生物利用度的要求。 空心胶囊的适用性研究应贯彻质量源于设计的理念,保证符合胶囊剂要求。 6. 稳定性 空心胶囊作为口服制剂的载体和赋形剂,应对空心胶囊的稳定性进行相应的评估,可参考《原料药与制剂稳定性研究指导原则》(通则)的相关要求,制定胶囊的保质期,以确保空心胶囊在保质期内的稳定性,为空心胶囊用于制剂的稳定性研究提供稳定性基础数据。空心胶囊的成膜材料、生产工艺、生产设备、产品规格、配方、配方量、保存温度等改变时,应重新进行胶囊稳定性的评估,根据评估结果重新制定空心胶囊的保质期。 空心胶囊在保质期内,其理化及相关特性应保持稳定。 7. 贮藏、运输、包装 空心胶囊的贮藏、运输、包装应能够保障其安全和质量稳定,防止污染和交叉污染。 除另有规定外,空心胶囊应避光、贮藏温度 10℃-25℃,湿度 35-65%,密封保存;直接接触空心胶囊的内包装材料应使用药用级并符合药用包装的相关要求。外包装应当有一定强度,足以保护其在运输、贮藏时避免受到挤压变形而影响使用。空心胶囊的贮藏、运输环境应与相应所使用的制剂的要求适应,符合药品运输和贮存的相关管理规定,不得与未经允许的物料同库存放或者同车运输。
公众号
|
【本文地址】


 返回搜狐,查看更多
返回搜狐,查看更多