| 小鼠IL | 您所在的位置:网站首页 › 美国的最具代表性动物是什么英文翻译 › 小鼠IL |
小鼠IL
|
胡昊扬,许志强 1南通大学医学院,江苏 南通 226019;2南京医科大学第一附属医院药学部,江苏 南京 210029 由免疫球蛋白E(immunoglobulin-E,IgE)介导的过敏性疾病是临床上的常见病、多发病,其影响超过全球30%的人口,并且伴随着人们生活方式的变化和环境污染加重,过敏性疾病的发病率仍在逐年上升[1-2]。肥大细胞是引起过敏性疾病的主要效应细胞之一,其表面FcεRⅠ受体结合的特异性IgE可与过敏原交联结合,引起细胞活化并释放各类可引起过敏反应的生物活性介质[3]。因此,肥大细胞也是研究过敏性疾病发病机制、诊断方法和治疗策略的重要工具。 目前,骨髓来源的肥大细胞已被广泛地用作过敏反应研究的体外细胞模型,但其应用的前提是需要通过诱导培养使其分化为成熟的肥大细胞,并且在此过程中需要持续给予细胞因子[4]。白细胞介素3(interleukin-3,IL-3)则是促进肥大细胞分化、增殖过程中最重要的细胞因子之一[4],IL-3 主要由活化的T细胞产生[5],其完整的一级结构由166个氨基酸组成,其中第1~26 位氨基酸为信号肽序列(Uniprot ID:P01586)。尽管国内外已有多个厂家开发了基于大肠杆菌重组形式的商品化的小鼠IL-3产品,但长期且持续性地进行肥大细胞的分化和培养仍需要较大的构建和维持成本。为了进一步提高体外肥大细胞模型构建的效率并降低原代细胞培养过程中的IL-3使用成本,构建并且筛选出能够高效生产小鼠IL-3的表达和纯化体系尤为必要。 本研究针对现有小鼠IL-3 核苷酸序列进行大肠杆菌偏爱密码子优化,通过构建质粒并筛选其在大肠杆菌原核表达体系中最佳的菌密度、诱导温度、时间和诱导剂浓度等因素,并在纯化后验证其在促小鼠肥大细胞分化成熟中的活性,从而为高效、经济的原代肥大细胞培养奠定物质基础。 1 材料和方法1.1 材料E.coliBL21(DE)感受态细胞(南京诺唯赞生物科技股份有限公司);小鼠IL-3基因合成、重组质粒构建(南京金斯瑞生物科技股份有限公司)。 胰蛋白胨、酵母粉、氯化钠、卡那霉素、三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、氧化型谷胱甘肽(glutathione disulfide,GSSG)、还原型谷胱甘肽(glutathione,GSH)、精氨酸、甘油、异丙基硫代半乳糖苷(isopropylthio-β-galactoside,IPTG)、咪唑、尿素、盐酸胍、二硫苏糖醇(dithiothreitol,DTT)、精氨酸、丙烯酰胺/甲叉双丙烯酰胺30%溶液(29∶1)、考马斯亮蓝G250、牛血清白蛋白(bovine serum albumin,BSA)(上海生工生物工程股份有限公司)。HisTrap HP亲和层析柱(5 mL)、HiTrap Desalting(5 mL)、Resource Q(1 mL)(Cytiva公司,美国)。BCA蛋白浓度测定试剂盒(上海碧云天生物科技公司)。Supersil C4 300Å色谱柱(大连依利特分析仪器有限公司)。商业化小鼠IL-3、SCF(美国PeproTech 公司)。PE anti-mouse CD117(c-Kit)Antibody、APC anti-mouse FcεRIα Antibody(Bio-Legend 公司,美国)。小鼠抗二硝基苯单克隆抗体(anti-DNPIgE)、白蛋白-二硝基苯(DNP-HSA)、β-己糖胺酶底物(4-硝基苯基N-乙酰基-β-D-氨基葡萄糖)(Merck公司,美国)。BABL/c小鼠3只(SPF级),6~8周龄,购自南京青龙山动物繁殖场,动物实验经南京医科大学实验动物福利伦理委员会批准(伦理批文编号:IACUC-2007037)。 1.2 方法1.2.1 小鼠IL-3原核表达载体的构建 从UniProt(登记号:P01586)、GenBank(登记号:AAA39291.1)中检索并获取小鼠IL-3的氨基酸序列信息及其对应的核苷酸序列,并委托南京金斯瑞生物科技股份有限公司进行大肠杆菌偏爱密码子优化和基因合成,并将其连接至pET28a(+)表达载体的NcoⅠ和XhoⅠ之间,通过Sanger法测序对构建产物进行确认。 1.2.2 小鼠IL-3的诱导表达和条件优化 取2 μL浓度为0.1 μg/μL的pET-28a(+)-IL-3重组质粒加至100 μL的BL21(DE3)感受态中并于冰上静止30 min,42℃热激70 s后置于冰上静止5 min,加入450 μL LB培养基(胰蛋白胨:10 g/L,酵母粉:5 g/L,氯化钠:10 g/L)后于37℃震荡培养1 h。取转化后的菌液100 μL 涂布于固体LB 培养基(含50 μg/mL 卡那霉素),置于37 ℃培养过夜。挑取单克隆菌落接种于含有50 μg/mL 卡那霉素LB 液体培养基中,并在37 ℃、240 r/min条件过夜培养。 取培养后菌液,按1∶100(v/v)再接种至含卡那霉素的LB培养基中,按照菌密度、诱导剂浓度、诱导温度、诱导时间4个因素进行多因子参数设置,其中菌密度是其在600 nm 处吸光值(A600=0.6 或0.8),诱导剂浓度为0.3、0.5、1.0 mmol/L 终浓度的IPTG,诱导温度为16 ℃、28 ℃、37 ℃,诱导时间为8 h或16 h。按以上因素和水平完成诱导组别设置后,在180 r/min转速下按预设条件进行震荡培养,并重复进行3次。 将诱导后菌液离心并收集菌体,使用160 μL 10 mmol/L 磷酸盐缓冲溶液(phosphate buffered saline,PBS)重悬菌体,加入40 μL 5×Laemmli样品缓冲液,沸水浴中处理10 min。将样品在4 ℃,12 000 r/min条件下离心10 min后,取15 μL 上清液进行SDSPAGE 检测。将电泳凝胶进行考马斯亮蓝染色,使用ImageJ软件对凝胶中16 kDa处的诱导条带的面积和强度进行计算,分析各个组别的蛋白表达情况。 1.2.3 小鼠IL-3的表达形式分析 将小鼠IL-3 表达菌接种于3 mL 含卡那霉素的LB 液体培养基中,并在37℃、240 r/min 条件过夜培养。将培养菌液进一步转入300 mL 含卡那霉素的LB 培养基中,在相同的条件下振摇至菌液A600为0.6 时加入终浓度1 mmol/L 的IPTG,并在37℃、180 r/min 条件震荡培养8 h。使用SDS-PAGE 检测小鼠IL-3 的表达形式:取IPTG 诱导前菌液、诱导后菌液,12 000 r/min 离心收集菌体,按上述表达条件优化中所述电泳步骤处理样品。同时将剩余诱导后菌液离心后,使用PBS洗涤菌体,再次离心后重悬于10 mL PBS中,利用超声破碎仪进行细胞裂解(70%功率,工作5 s,间隔5 s,总时长30 min),取100 μL破碎后产物在4 ℃,12 000 r/min条件下离心10 min,分离上清液和沉淀用于SDS-PAGE检测。 1.2.4 小鼠IL-3的分离纯化 基于上述结果,将超声破碎后的沉淀溶解于变性液中(20 mmol/L Tris-HCl,0.5 mol/L NaCl,5 mmol/L咪唑,6 mol/L 盐酸胍,1 mmol/L DTT,pH 8.0)。将HisTrap HP 层析柱装载到ÄKTA层析系统,使用上样缓冲液(20 mmol/L Tris-HCl,0.5 mol/L NaCl,5 mmolL咪唑,8 mol/L 尿素,1 mmol/L DTT,pH 8.0)平衡层析柱后,将变性后的小鼠IL-3 上样至层析柱中,逐次使用2%、4%、50%、100%比例的洗脱缓冲液(20 mmol/L Tris-HCl,0.5 mol/L NaCl,500 mmol/L 咪唑,8 mol/L 尿素,1 mmol/L DTT,pH 8.0)进行洗涤和洗脱,分别收集洗脱峰进行SDS-PAGE电泳检测。 根据已报到的方案略作调整进行蛋白质复性[6]。具体如下:合并上述洗脱的小鼠IL-3,于4 ℃透析至复性液中(50 mmol/L Tris-HCl,0.5 mol/L Na-Cl,5 mmol/L EDTA,1 mmol/L GSH,0.1 mmol/L GSSG,0.5 mol/L精氨酸,10%甘油,pH9.5),持续24 h。 收集复性后产物,先使用HiTrap Desalting 层析柱将产物溶液置换至离子交换A溶液中(20 mmol/L Tris-HCl,pH8.5),置换后产物上样至相同溶液平衡后的Resource Q 层析柱,使用梯度递增的离子交换B溶液中(20 mmol/L Tris-HCl,1 mol/L NaCl,pH 8.5)进行蛋白洗脱,分别收集不同的洗脱峰进行SDSPAGE检测分析。同时,按照说明书使用BCA蛋白浓度测定试剂盒对纯化后小鼠IL-3的浓度进行测定。 基于最终纯化的小鼠IL-3,使用反向-高效液相色谱法对其进行纯度测定,具体如下:使用Supersil C4 300Å色谱柱(4.6 mm×300 mm)、流动相A为含有0.1%TFA 和10%乙腈的水溶液、流动相B 为含有0.09%TFA 和80%乙腈的水溶液进行样品的梯度洗脱测定,色谱条件为0~5 min(100%流动相A,0%流动相B)、5~60 min(流动相A 由100%至0%,流动相B由0%至100%),监测280 nm处的紫外吸收信号。 1.2.5 小鼠IL-3促肥大细胞分化成熟的活性研究 按照已报道的方法进行小鼠原代肥大细胞分化培养[7]。首先通过颈椎脱臼法处死小鼠后取其股骨,将骨髓细胞冲出后用于后续洗涤和培养处理,并且分为两组:一组在培养过程中加入终浓度10 ng/mL的本研究中纯化的小鼠IL-3 并配合10 ng/mL 的商业化小鼠SCF,另一组在培养过程中加入10 ng/mL商业化小鼠IL-3 并配合10 ng/mL 的商业化小鼠SCF,均置于37 ℃、5%CO2条件下培养。在培养第3 周和第5 周时分别取样进行肥大细胞分化状态和细胞比例检测[8],具体如下:将细胞收集后,500g离心5 min 后弃上清,使用含10%胎牛血清的RPMI1640 培养基调整细胞浓度为1.0×106/mL,分别移取300 μL上述细胞悬液,离心后使用300 μL流式染色缓冲液(含0.5% BSA 的PBS 溶液,pH 7.2)重悬,分别取100 μL 细胞悬液加入3 μL PE anti-mouse CD117(c-Kit)Antibody 和3 μL APC anti-mouse FcεRIα Antibody,室温孵育15 min。随后加入1 mL流式染色缓冲液清洗细胞,500g离心5 min 后弃上清,再次加入300 μL 流式染色缓冲液重悬,采用流式细胞仪检测肥大细胞表面特异性标志物FcεRI和CD117的表达水平并计算该细胞群所占比例。 参照已报道的方法进行小鼠肥大细胞被激发后的β-己糖胺酶释放量测定[9]。使用培养第5周的肥大细胞与小鼠抗二硝基苯基的IgE 抗体孵育过夜,将细胞收集后,500g离心5 min 后弃上清,并使用台式液(tyrode's solution)洗涤并重悬,分组加入10μL PBS、DNP-HSA、3%Triton X-100后,置于37 ℃、5% CO2条件下培养孵育30 min。反应结束后,离心并吸取50 μL 上清与50 μL β-己糖胺酶底物混合后,37 ℃孵育1.5 h,随后使用75 μL 0.2 mol/L甘氨酸溶液(pH 10.7)终止反应,并测定405 nm处测量其吸光度值,β-己糖胺酶释放率计算公式如下:(ODDNP-HSA-ODPBS)/(ODTritonX-100-ODPBS)×100%。 1.3 统计学方法实验数据使用GraphPad Prism 8软件进行统计学分析,各组数据表示为均数±标准差(),多组定量资料比较采用单因素方差分析(one-way ANOVA)检验,多组间比较采用Dunnett 法。P<0.05 为差异有统计学意义。 2 结果2.1 小鼠IL-3基因序列优化应用OptimumGeneTM算法分析,小鼠IL-3 原始核苷酸序列的密码子适应指数(codon adaptation index,CAI)和GC含量分别为0.35和47.53%。经优化后,CAI 值和GC 含量分别提高到0.97 和55.50%,优化前与优化后的核苷酸序列如图1所示。
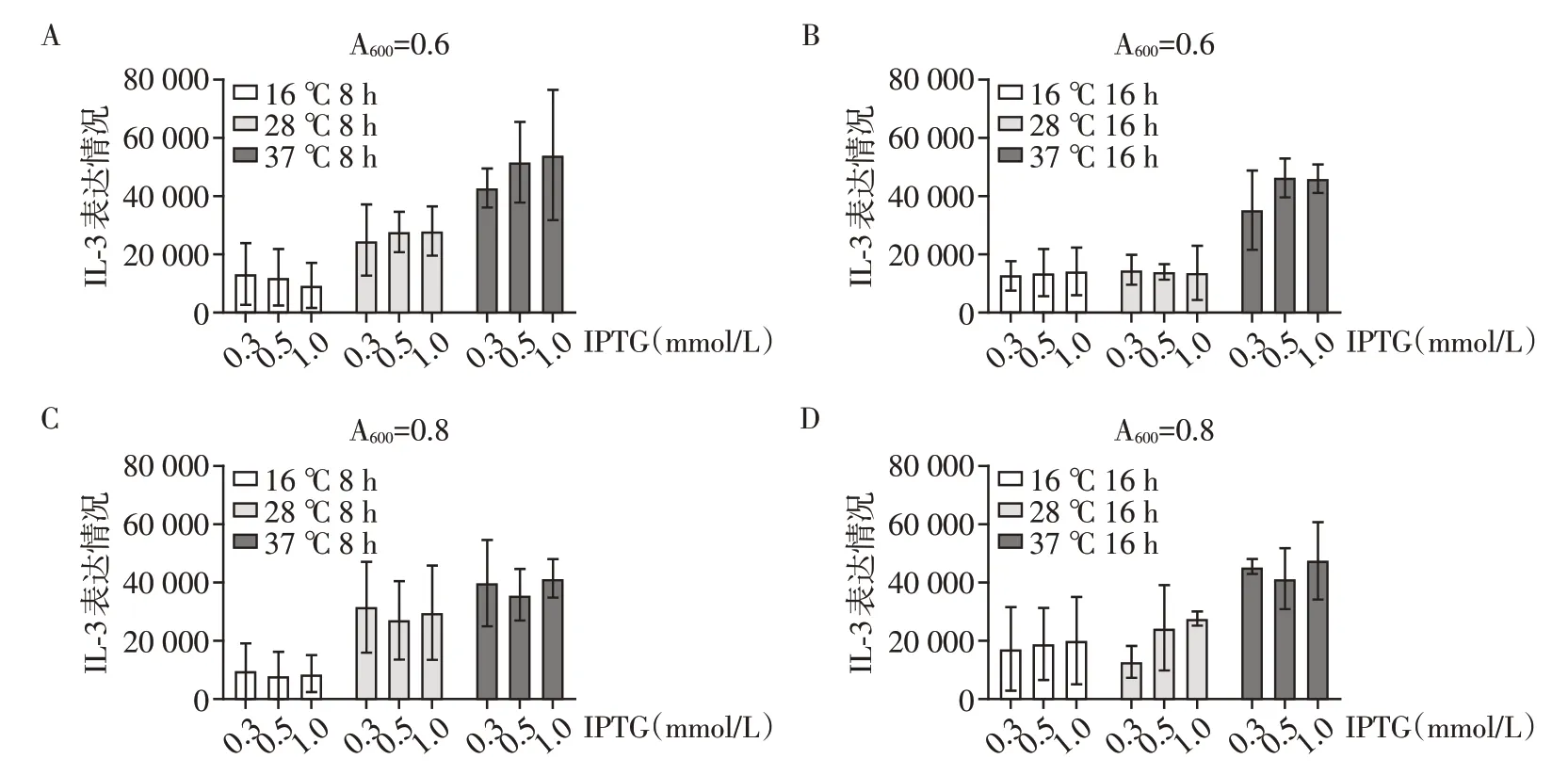
图1 优化前和优化后的小鼠IL-3的基因序列及其编码的氨基酸序列Figure 1 The gene sequence of mouse IL-3 before and after codon optimization and its corresponding amino acid sequence 2.2 小鼠IL-3蛋白的原核表达和条件优化根据不同的菌密度、IPTG 诱导剂浓度、诱导温度及诱导时间设计四因素多水平因子条件筛选最佳的小鼠IL-3 的诱导表达条件(图2A)。经SDSPAGE 以及考马斯亮蓝G250 染色检测,结果显示,在不同的因素和水平下均可观察到约16 kDa 处的蛋白诱导条带,与小鼠IL-3理论序列的分子量相符合;同时可观察到目的蛋白的表达量随着温度的升高(16℃~37℃)表现为上升趋势,而IPTG 单因素的变化对目的蛋白表达量的影响程度较小;诱导时间从8 h 增加至16 h后,目的蛋白的表达量呈下降趋势(图2B~E)。
图2 小鼠IL-3蛋白的表达条件优化Figure 2 Optimization of the prokaryotic expression of mouse IL-3 为了进一步分析选定的四因素及各个水平对小鼠IL-3 的表达量影响情况,将每组实验重复3 次后,使用ImageJ 图像分析软件计算各组SDS-PAGE结果中目的条带的面积强度。如图3 所示,当诱导条件设置为诱导前菌液度吸光值为0.6、使用IPTG终浓度为1 mmol/L、诱导温度为37 ℃、诱导时长为8 h时,小鼠IL-3 在大肠杆菌中具有平均最高的表达量。
图3 重组小鼠IL-3的表达情况分析Figure 3 Analysis the protein content of recombinant mouse IL-3 2.3 小鼠IL-3的表达形式分析和纯化表征进一步的诱导表达和超声破碎产物的SDSPAGE 结果显示,位于16 kDa 处的小鼠IL-3 存在于超声破碎后沉淀物中,几乎全部以包涵体形式表达,破碎后的上清液中无可观测的目的蛋白条带(图4A)。因此,对分离的包涵体变性溶解后,在8 mol/L咪唑条件下进行Ni2+亲和层析纯化。由层析紫外吸收图谱可见,在50%比例的洗脱缓冲液条件下(咪唑浓度约250 mmol/L)出现一个明显的洗脱峰,进一步收集后经SDS-PAGE 分析确认小鼠IL-3成功得到了纯化(图4B)。在经过透析复性后,产物通过阴离子交换层析进一步纯化,并在低NaCl浓度条件下出现洗脱峰。收集主要峰组分进行分析显示最终纯化的小鼠IL-3在SDS-PAGE中表现为单一蛋白条带。根据BCA蛋白浓度测定结果,最终纯化的小鼠IL-3的浓度为0.08 mg/mL(图4D),其在反向色谱中所测定的纯度>85%,色谱峰保留时间:32.230(图4E)。
图4 小鼠IL-3的表达形式分析和纯化表征Figure 4 Analysis of the expression formand purification of mouse IL-3 2.4 小鼠IL-3 促进小鼠肥大细胞分化成熟的活性验证使用流式细胞仪检测原代培养的骨髓细胞中肥大细胞的分化情况,通过圈定分析肥大细胞表面特异性标志物FcεRI和CD117双阳性的细胞群计算该细胞群所占比例。结果显示,随着诱导培养时间从3周持续至5周,本研究中纯化的小鼠IL3配合商业SCF刺激组中FcεRI+CD117+肥大细胞占比从23.3%(肥大细胞数量/流式细胞术圈定总细胞数量:3 702/15 920)增加至67.8%(肥大细胞数量/流式细胞术圈定总细胞数量:7 202/10 625)(图5A、B),高于阳性对照组中使用商业化小鼠IL-3配合商业化小鼠SCF的培养参照(图5D、E),进一步证实了本研究中所纯化小鼠IL-3在原代肥大细胞培养过程中的生物活性。 进一步的对肥大细胞被激发后的β-己糖胺酶的释放量进行测定,结果显示,本研究中纯化的小鼠IL-3 配合商业SCF 刺激组中,肥大细胞在经过小鼠抗二硝基苯基的IgE 抗体致敏和DNP-BSA 刺激后β-己糖胺酶释放量较PBS 对照组显著升高(P<0.05),计算所得释放率为22.1%(图5C);在商业化小鼠IL-3 配合商业化小鼠SCF,同样可观察到被激发后的β-己糖胺酶释放量较PBS 对照组显著升高(P<0.05),释放率为19.3%(图5F)。
图5 流式细胞术分析肥大细胞分化Figure 5 Analysis of the differentiation of mast cells from mouse bone marrow cells by flow cytometry 3 讨论肥大细胞在过敏性疾病的发病机制中属于最核心的效应细胞之一,其既可通过IgE 交联抗原的方式被激发,也可被非IgE 依赖的途径物质直接活化[10],进而释放各类生物活性介质,如活性胺、脂质介质、细胞因子等。因此,肥大细胞是研究过敏性疾病及其他相关免疫炎症反应发生和发展机制的重要工具之一。小鼠骨髓来源的肥大细胞已被广泛地应用于体外细胞模型[8],其一般需要在IL-3 的支持下进行4~6周的体外分化培养。尽管目前已有多个厂家提供了商业化可获得的IL-3蛋白,并且基于大肠杆菌的表达体系也已被广泛应用,但为了降低肥大细胞诱导分化和培养过程中的商业化小鼠IL-3 的使用成本,进一步提高体外模型的构建效率并推进其应用,需要能够高效、快速和稳定地获得具有能够诱导肥大细胞分化生物活性的小鼠IL-3,因此对于其原核表达条件建立和优化尤为必要。 在异源表达系统中,密码子优化可提高了靶基因的翻译效率,从而尽可能地提高宿主中原始物种DNA序列编码的蛋白质表达[11]。因此在本研究中,首先针对小鼠IL-3 的原生核苷酸序列进行大肠杆菌偏爱密码子优化,使其CAI指数和GC含量均得到了提升。根据OptimumGeneTM算法工具优化原则,核苷酸序列的CAI 指数高于0.8 时被定义为具有高基因表达水平,本研究中优化后的序列CAI 从优化前的0.35 升高至0.97,属于从根本层面对小鼠IL-3的表达进行了优化。优化后的序列经过基因合成后克隆至pET-28a(+)载体质粒,通过该质粒的NcoⅠ和XhoⅠ位点进行了连接并且保留了羧基端的6个组氨酸标签,该标签不仅极大的提高了下游的纯化效率,并且为诱导表达后的目的蛋白验证提供了靶点,本研究中诱导表达以及最终纯化后的小鼠IL-3均通过Western blot进行了组氨酸标签检测(数据未展示)。异源基因能否在大肠杆菌高效表达受到多种因素的影响,而表达条件的优化则能够在合适的条件下最大程度提高目的蛋白质的获取量[12,13]。为了筛选小鼠IL-3 原核表达的最佳条件,本研究根据菌培养密度、诱导剂浓度、诱导时温度和诱导时长4 个因素进行了多个代表性水平的因子参数设置。经过3 次重复实验后发现诱导前菌密度A600为0.6 时且IPTG 终浓度为1.0 mmol/L,在37 ℃条件下诱导8 h 具有最高的蛋白表达量,而诱导前菌密度A600为0.8时、诱导温度为16 ℃或28 ℃时、诱导时长为16 h时均呈现不同程度的蛋白检测量降低,这可能分别与细菌生长超过对数期、低温影响了细菌的生长、过久的培养导致营养不再充分或代谢物累积影响细菌状态等有关。 通过表达形式分析,本研究构建的小鼠IL-3表达质粒在大肠杆菌中主要以包涵体形式表达,这可能与其含2 对分子内二硫键有关(Uniprot ID:P01586),其在大肠杆菌中错误配对可能是形成包涵体主要原因。因此,为了获得具有生物活性的蛋白,必须进行包涵体变性和复性使IL-3恢复折叠和活性构象。我们首先使用Ni2+亲和层析对变性后的IL-3 进行粗捕获,并进一步利用氧化还原复性体系结合透析法对纯化产物复性以促进二硫键的再配对[6,14],随后将复性产物进行阴离子交换层析以获得最终的IL-3。尽管我们并未对二硫键的具体形成进行表征和鉴定,但随后其在促肥大细胞分化成熟中表现的生物活性间接地证明了本研究中小鼠IL-3的活性构象恢复,这也是本研究中最重要的目的。在后续的诱导肥大细胞分化成熟的活性测定中,我们选取了商业化的小鼠IL-3 作为对照。由于目前商业化IL-3 产品中尚无关于诱导肥大细胞分化相关的活性数据,而仅有促进NFS-60细胞增殖的活性信息,我们选择了现有常见的商品中该活性较佳的产品(ED50≤0.05 ng/mL)用于后续的参照。流式细胞术对原代细胞培养悬液的分析检测中发现使用研究中纯化的小鼠IL-3 配合商业化SCF 获得的FcεRI+CD117+肥大细胞比例略高于商业化产品对照,同时前者被激发后β-己糖胺酶释放率也略高于商业产品对照,该结果表明本研究中最终纯化的小鼠IL-3 具有与现有商业化产品相比具有相当甚至略高的诱导肥大细胞分化成熟的能力,进一步证明本研究中构建的小鼠IL-3 表达和纯化体系能够较好地满足体外肥大细胞模型的构建。另外,在小鼠原代肥大细胞分化培养中使用的IL-3终浓度为10 ng/mL,本研究中优化条件后获得的IL-3 浓度为0.08 mg/mL(=80 000 ng/mL),单次制备便可满足多次使用需求,同时该体系具有快速、方便、价格低廉的特性,能够降低原代细胞培养过程中对商业化小鼠IL-3 的依赖,提高模型构建的效率。 综上所述,本研究基于密码子和表达条件优化策略,不仅得出了小鼠IL-3的最佳原核表达参数还探索了其纯化和复性工艺,为体外肥大细胞模型的建立奠定坚实的物质基础。 猜你喜欢 肥大细胞商业化条件 排除多余的条件数学小灵通(1-2年级)(2021年10期)2021-11-05选择合适的条件数学小灵通(1-2年级)(2020年12期)2021-01-145G商业化倒计时开始新高考·英语进阶(高二高三)(2019年1期)2019-06-255G商业化倒计时开始新高考·英语基础(高一)(2019年1期)2019-06-25肥大细胞活化综合征中华临床免疫和变态反应杂志(2018年6期)2019-01-17借钱买房,是商业化行为,而不是啃老文苑(2018年19期)2018-11-09为什么夏天的雨最多小学阅读指南·低年级版(2016年10期)2016-09-10社会化和商业化思维对新产品开发的影响工业设计(2016年8期)2016-04-16肥大细胞在抗感染免疫作用中的研究进展医学研究与教育(2014年2期)2014-03-11认同或对抗——论执政条件下的党群关系互动江淮论坛(2011年2期)2011-03-20
|
【本文地址】




 南京医科大学学报(自然科学版)2023年2期
南京医科大学学报(自然科学版)2023年2期