| Annexin V/PI 双染法检测细胞凋亡实验步骤与常见问题分析 | 您所在的位置:网站首页 › 细胞凋亡英语怎么说呢 › Annexin V/PI 双染法检测细胞凋亡实验步骤与常见问题分析 |
Annexin V/PI 双染法检测细胞凋亡实验步骤与常见问题分析
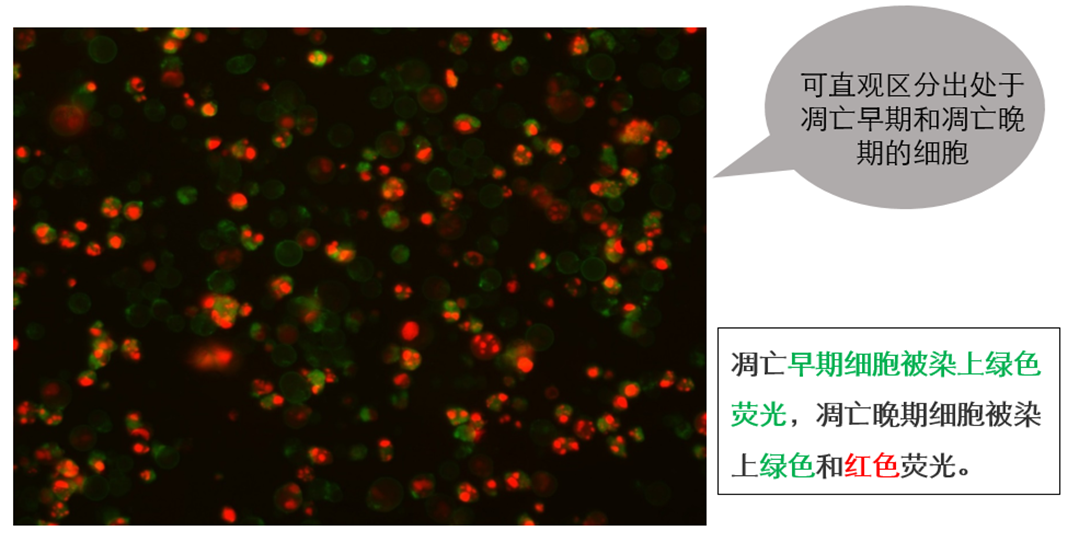
Annexin V/PI 双染法流式检测细胞凋亡是最常用的检测细胞凋亡的方法之一。在细胞开始早期凋亡时, PS 会外翻到细胞表面,即细胞膜外侧。用绿色荧光探针 YF488 标记的 Annexin V,可以结合外翻的磷酯酰丝氨酸,从而检测细胞凋亡的重要特征。 碘化丙啶( Propidium Iodide, PI)是一种 DNA 结合染料,它可以染色坏死细胞或凋亡晚期丧失细胞膜完整性的细胞的细胞核。 PI 可以由 488,532 或 546 nm 的激光激发,呈现红色荧光。 因此将 YF 488-Annexin V 与 PI 匹配使用,就可区分活细胞、早晚期凋亡细胞和死细胞。 YF488 染料与传统 FITC 相比,荧光亮度更高,且不受环境中 pH 的影响,具有良好的光稳定性。 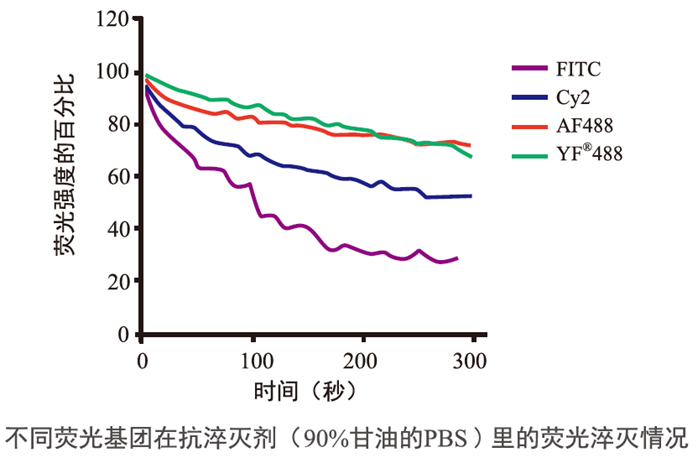 一、操作步骤(贴壁细胞为例) 1.1 对照管的设置 (1)空白管:诱导凋亡的细胞不加染料,用来调节电压; (2)单染管:分别需要只加 PI 和荧光标记的 Annexin V 两个单染管,用来调节补偿; (3)实验管:诱导凋亡的细胞加本次实验的所有荧光染料; (4)阴性管:正常培养细胞加入染料,确认细胞正常状态,排除假阳性 1.2 细胞处理及染色 (1)取对数生长期细胞接种于 6 孔板或 6cm 培养皿(用什么培养皿取决于所培养的细胞,保证最终收集的细胞数大于 5×105 个); (2)根据实验需要处理细胞。收集细胞时将培养液吸至离心管内,PBS 洗涤细胞一次,用不含 EDTA 的胰酶消化细胞,并收集于离心管中(悬浮细胞可直接离心收集); 注:用胰蛋白酶消化然后使细胞在最佳细胞培养条件和培养基中恢复约 30 分钟,然后再染色。 胰蛋白酶消化会暂时破坏质膜,允许Annexin V结合磷脂酰丝氨酸在细胞膜的细胞质表面上,从而导致假阳性染色。 (3)将收集的培养基和细胞混匀,4℃ 300g 离心 5min,弃上清。用预冷的 PBS 洗涤细胞 2 次,每次 4℃ 300g 离心 5min; (4)加入 1× Binding Buffer,将细胞调节成相同浓度(一般为 1×106/mL); (5)取 1-2×105 个细胞悬液于流式管中,加入适量标记了荧光染料的 Annexin V 和适量 PI,轻轻混匀; (6)室温避光孵育 15-20 min; (7)加入 300 μl PBS 重悬细胞,尽快(1 小时内)用流式细胞仪检测。 PS:对照管设置尤其重要 二、实验结果图 2.1 YF488-Annexin V 荧光显微镜实验效果 三、常见问题 3.1 各象限代表的细胞状态问题 3.2 补偿调节问题 (1)不同的染料组合,补偿大小不同。 (2)电压对补偿的影响不小,电压变补偿变,所以我们要先调节FSC、SSC和荧光通道的电压,电压调好之后再调补偿。 3.3 关于假阳性问题 (1)对贴壁细胞而言,消化是最关键的步骤,消化液需用不含 EDTA 的胰酶,因为 Annexin V 和 PS 的结合需要 Ca2+,而 EDTA 是 Ca2+ 螯合剂,使用含有 EDTA 的胰酶会造成假阴性。其次消化时间不宜过长,吹打细胞要轻柔,因为胰酶的过度消化和机械损伤都会引起细胞膜的损伤,造成假阳性。细胞消化下来后,建议在培养箱中在孵育 30min,使细胞膜恢复完整性,避免假阳性,或者将细胞报讯在含 2% BSA 的 PBS 中,防止进一步的损伤。 (2)神经细胞膜容易破坏外翻,导致假阳性,所以Annexin V/PI 双染法流式检测细胞凋亡不适用于神经细胞。 3.4 关于荧光染料选择的问题 (1) 对于荧光染料的选择,建议如果流式细胞仪带有 488 nm 和 633 nm 两个或以上激光管,首先考虑用 APC 或 YF647 标记 Annexin V,因为它和 PI 通道几乎不用考虑光重叠问题,可以减少调节补偿的烦恼,如果只有 488 nm 激光管则可选择YF488/FITC 标记的 Annexin V。 (2)再次需要考虑细胞是否自带荧光,因为感染病毒或质粒转染的细胞往往带 GFP 荧光,GFP 与 YF488/FITC 通道重叠,不能选择 YF488/FITC 标记的 Annexin V,此时如果只有 488 nm 一根激光管可以用 PE 标记 Annexin V,用 7-AAD 代替 PI,或者改用 YF647 Annexin V 代替 YF488。 (3)最后还要考虑处理因素是否带有荧光,本实验室就碰到过一个促凋亡药物 Doxorubicin 本身发红色荧光,对 PI 通道的检测造成严重干扰,而且浓度越大干扰越明显。这时建议选用其他检测方法。 3.5 设门问题 (1)要特别注意在FSC/SSC圈门时,所选细胞范围会对结果造成较大影响,所以在分析数据时,要把所有细胞都圈进FSC/SSC的门内,这样实验结果才会更可信。如图,使细胞群大概位于对角线上,并且细胞群较集中,群内细胞比例要在80%以上,如果细胞全部圈入,细胞比例才50%或者更低,说明细胞被压在了坐标轴上,这时要重新调节FSC和SSC。 3.6 免疫染色与凋亡染色顺序问题 Annexin V凋亡染色可以和抗体一起对细胞进行染色吗? 可以,但建议Annexin V和其它抗体分开染色。 例如Annexin V、PI和CD3、CD8同时标记淋巴细胞,可以先在PBS中标记CD3/CD8后洗去,再在Binding buffer(含钙离子)中标记Annexin V。 3.7 其他问题 (1)液氮保存的组织块,不建议再做流式细胞分析。因为流式细胞分析要求细胞分散、单个,活性好,组织在冻存、复温的过程中会有大量的细胞死亡,同时经过这一过程的组织在分离成单个细胞的时候会形成许多细胞碎片,不宜上流式检测,所以用于流式检测的标本最好是新鲜标本,即取材后立即检测,效果最好。 液氮保存的组织块,可以将组织标本进行切片,然后做原位染色,观察组织细胞的凋亡。 (2) Annexin V也可以用在植物和细菌中检测凋亡,具体实验步骤可参考相关文献。 (3) 如果样品来源于血液,必须去除血液中的血小板,因为血小板含有PS,能与Annexin V结合,干扰实验结果。 (4)操作中务必动作轻柔,离心后确认管底是否有细胞,经常有人液体一甩,细胞也给甩走了。操作中还要注意避光。 |
【本文地址】
| 今日新闻 |
| 推荐新闻 |
| 专题文章 |
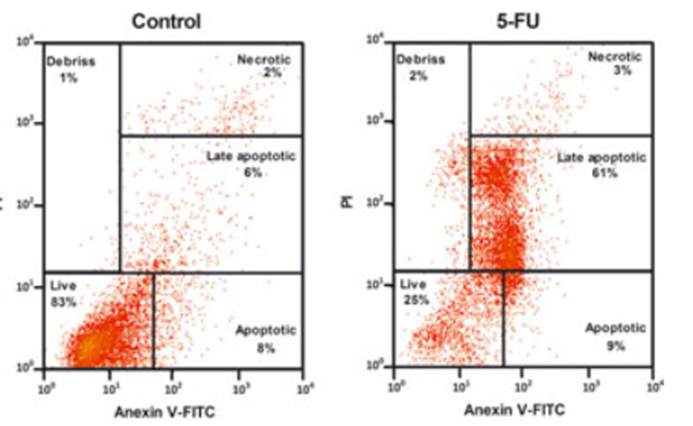
 2.2 YF488 -Annexin V 流式实验效果图
2.2 YF488 -Annexin V 流式实验效果图 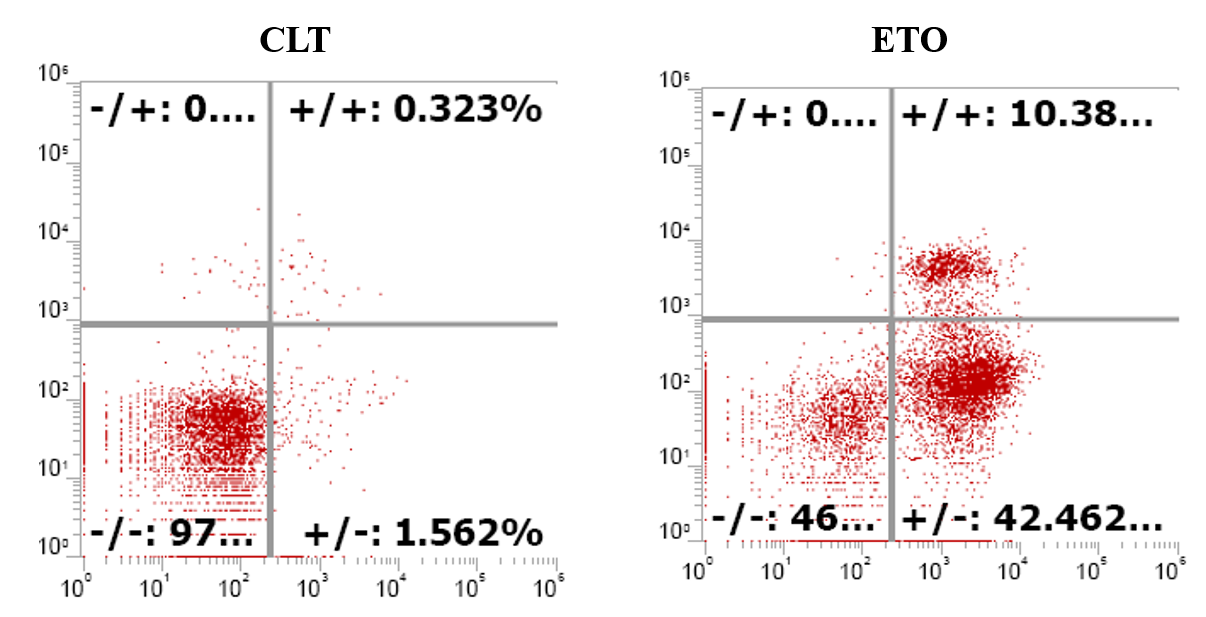 YF 488-Annexin V 与 PI 双染试剂盒能够完美的区分活细胞,早期凋亡细胞及晚期凋亡细胞/坏死细胞。
YF 488-Annexin V 与 PI 双染试剂盒能够完美的区分活细胞,早期凋亡细胞及晚期凋亡细胞/坏死细胞。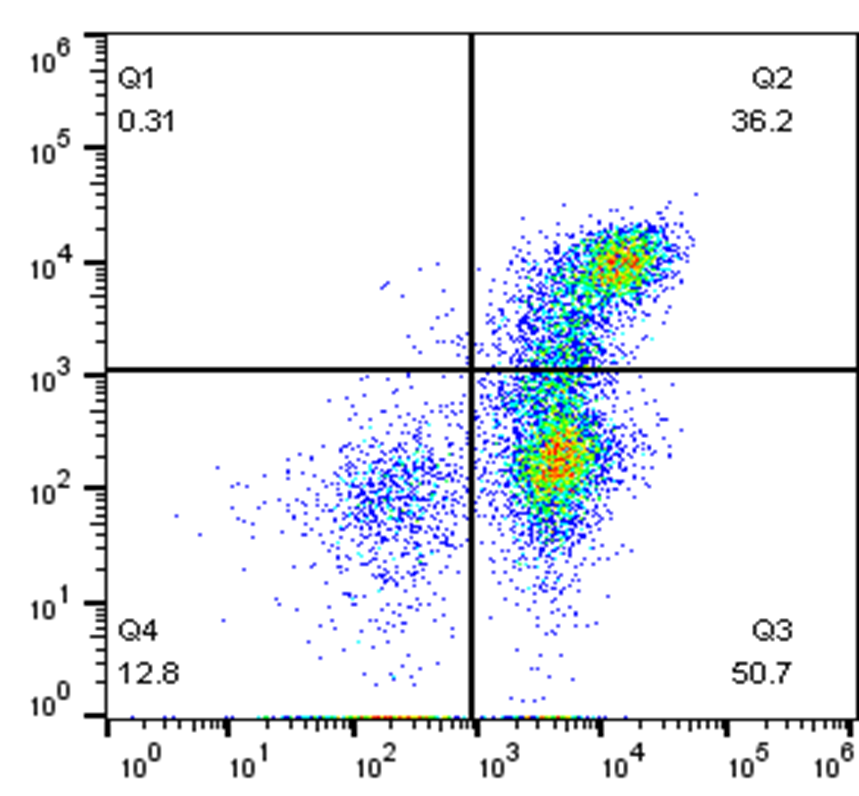 Q1:(AnnexinV-染料)-/PI+,此区域的细胞为坏死细胞。也可能有少数的晚期凋亡细胞在其中,甚至机械损伤的细胞也包含其中。
Q1:(AnnexinV-染料)-/PI+,此区域的细胞为坏死细胞。也可能有少数的晚期凋亡细胞在其中,甚至机械损伤的细胞也包含其中。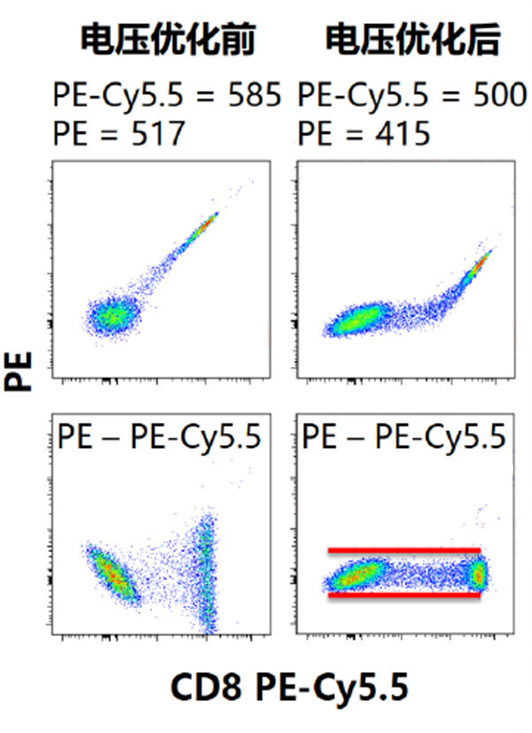 (3)细胞也是影响补偿大小的一个因素,如淋巴细胞和肿瘤细胞之间、活细胞与固定后细胞之间,标记相同的荧光素偶联抗体,使用相同的通道时,各通道之间的补偿可能不同。所以当细胞理化性质差异较大时,最好重新调节新的样品细胞的补偿,确保获得准确的流式结果。
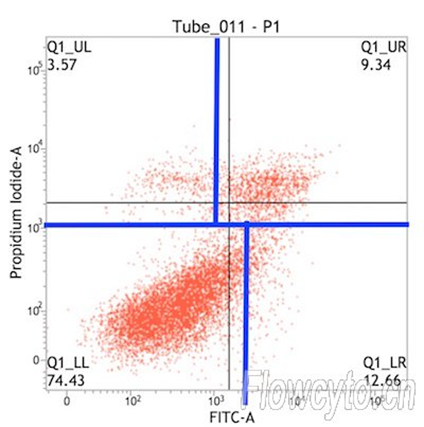
(3)细胞也是影响补偿大小的一个因素,如淋巴细胞和肿瘤细胞之间、活细胞与固定后细胞之间,标记相同的荧光素偶联抗体,使用相同的通道时,各通道之间的补偿可能不同。所以当细胞理化性质差异较大时,最好重新调节新的样品细胞的补偿,确保获得准确的流式结果。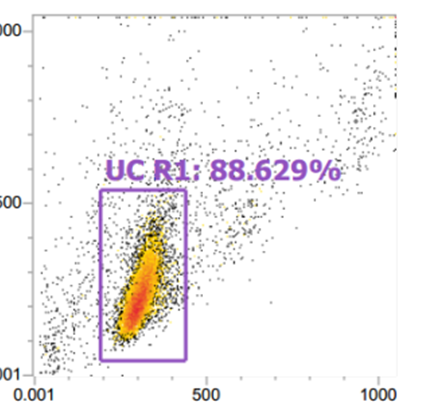 (2)贴壁细胞做Annexin V凋亡检测,通常分群不太规则,这时我们可以根据不加药细胞来画不规则的十字门。如下面图形的设门方式。
(2)贴壁细胞做Annexin V凋亡检测,通常分群不太规则,这时我们可以根据不加药细胞来画不规则的十字门。如下面图形的设门方式。