| 前20号部分元素在周期表中的位置如下表:(1)(2)(3)(4)(5) | 您所在的位置:网站首页 › 第二周期中原子半径最小的是 › 前20号部分元素在周期表中的位置如下表:(1)(2)(3)(4)(5) |
前20号部分元素在周期表中的位置如下表:(1)(2)(3)(4)(5)
|
前20号部分元素在周期表中的位置如下表: (1) (2) (3) (4) (5) (6) (7) (8) (9) (10) (11) (12) (13) 回答问题:(均用元素符号表示) (1)除(1)以外,原子半径最小的是_____,(4)(5)(6)(7)元素的简单离子中半径最大的离子是_____。 (2)相同物质的量的(4)和(10)的单质分别和(1)的单质化合时放出的热量最多的是_____
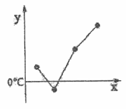
(3)写出(11)离子的结构示意图________。 (4)从原子结构角度解释(12)比(13)金属性强的原因:_____________。 (5)单质沸点可能符合右图(x是原子序数,y是单质沸点)的四个元素是_______。 A. (2)(3)(4)(5) B. (8)(9)(10)(11) C. (5)(6)(7)(8) D. (10)(11)(12)(13) 答案 F O2− O2 【解析】 根据元素周期表分析得到1-13号元素分别为H、C、N、O、F、Na、Mg、Si、P、S、Cl、K、Ca;原子半径同周期从左到右逐渐减小,同主族从上到下逐渐增大;离子半径根据同电子层结构,核多径小;非金属越强,单质与氢气化合放出的热量越多;同周期,核电荷数减小,原子核对最外层电子的吸引力增强,失电子能力减弱,得电子能力增强。 【详解】 (1)除(1)以外,同周期从左到右逐渐减小,同主族从上到下逐渐增大,因此原子半径最小的是F,根据同电子层结构,离子半径核多径小,因此(4)(5)(6)(7)元素的简单离子中半径最大的离子是O2−;故答案为:F;O2−。 (2)根据非金属越强,与氢气化合放出的热量越多,因此相同物质的量的(4)和(10)的单质分别和(1)的单质化合时放出的热量最多的是O2;故答案为:O2。 (3)(11)是氯,其离子的结构示意图 (4)从原子结构角度解释(12)比(13)金属性强的原因:两者原子核外电子层数相同,K原子核电荷数小于Ca原子,原子核对最外层电子的吸引力小于Ca原子,失电子能力大于Ca,因此K的金属性强于Ca;故答案为:两者原子核外电子层数相同,K原子核电荷数小于Ca原子,原子核对最外层电子的吸引力小于Ca原子,失电子能力大于Ca,因此K的金属性强于Ca。 (5)A.(2)(3)(4)(5)是碳、氮、氧、氟的对应单质,碳对应的单质是固体,熔沸点最高,故A不符合题意;B.(8)(9)(10)(11)是硅、磷、硫、氯的对应单质,硅对应的单质晶体硅,晶体硅的熔沸点最高,故B不符合题意;C.(5)(6)(7)(8)是氟、钠、镁、硅的对应单质,硅对应的单质晶体硅,晶体硅的熔沸点最高,故C不符合题意;D.(10)(11)(12)(13)是硫、氯、钾、钙的对应单质,熔沸点是Ca>K>S>Cl2,故D符合题意;综上所述,答案为D。 【点睛】 第二周期,碳形成的单质金刚石、石墨的沸点高,第三周期硅形成的反之晶体硅熔沸点高,分析熔沸点时要注意。 |
【本文地址】
 两者原子核外电子层数相同,K原子核电荷数小于Ca原子,原子核对最外层电子的吸引力小于Ca原子,失电子能力大于Ca,因此K的金属性强于Ca D
两者原子核外电子层数相同,K原子核电荷数小于Ca原子,原子核对最外层电子的吸引力小于Ca原子,失电子能力大于Ca,因此K的金属性强于Ca D 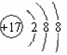 。
。