| 干货+福利 | 您所在的位置:网站首页 › 稳定蛋白质的作用力有哪些方面 › 干货+福利 |
干货+福利
|
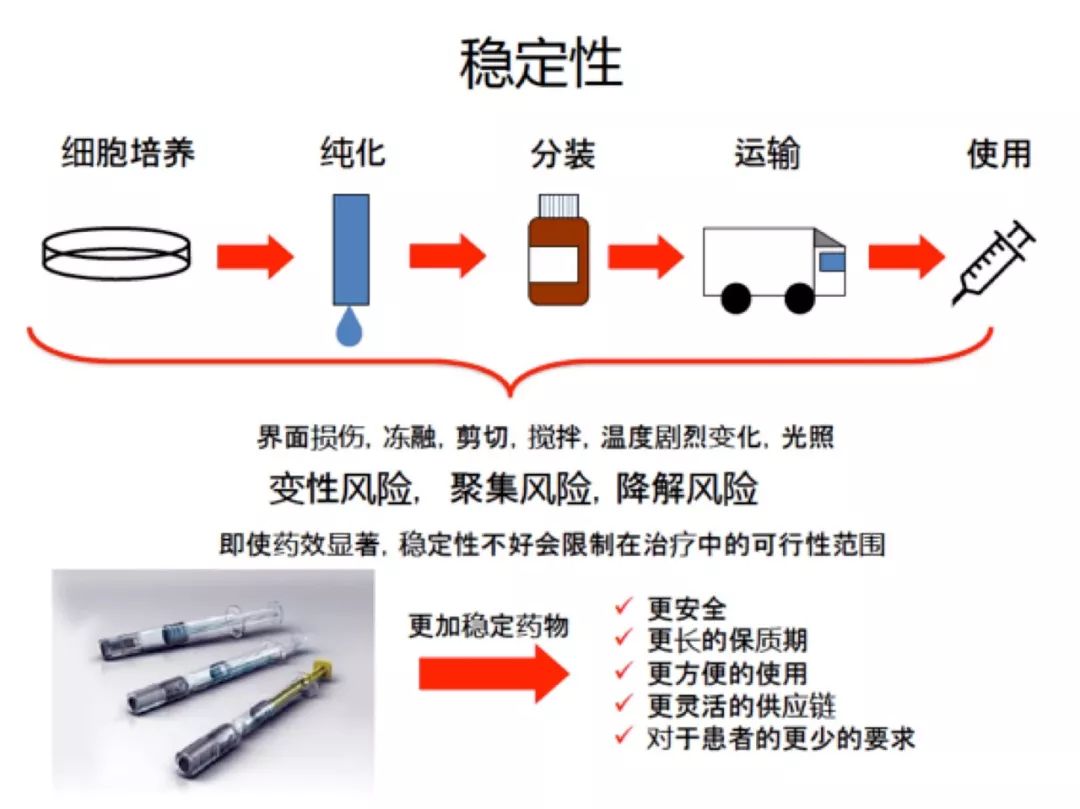
蛋白质制剂配方开发的科学 蛋白质制剂开发的主要目标是稳定蛋白质,使其可以耐受制造过程,并在运输、储存和给药过程中保持稳定/活性。另外,稳定化的蛋白质作为外来实体可能具有较低的潜在产品免疫原性的机会。
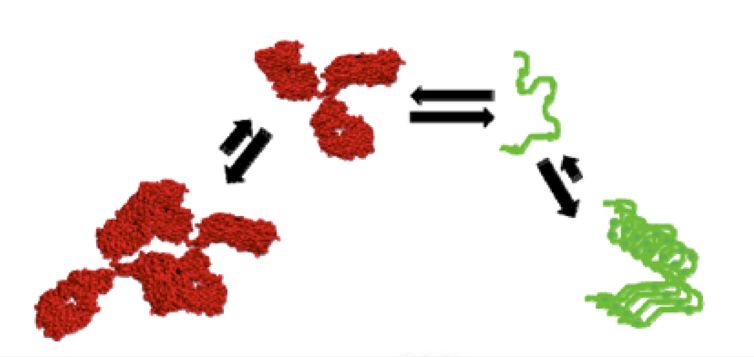
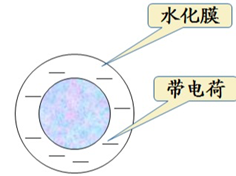
下面将讨论与蛋白质稳定性相关的影响因素、挑战和应对策略。 2.1 蛋白稳定性 蛋白质稳定性的一个方面通常被称为其构象稳定性。 在蛋白质的三个主要稳定力中(疏水相互作用,氢键和静电相互作用),疏水相互作用被证明是主要的,疏水相互作用导致形成疏水簇以稳定蛋白质。 蛋白质表面残基的瞬时和协同水合也从能量上有利于天然状态。 另外,已经发现蛋白质稳定性与分子的局部稳定性强烈相关。 蛋白质稳定性的另一个方面通常被成为胶体稳定性,可以通过蛋白质-蛋白质相互作用来描述,即吸引和排斥。两者都可以通过第二维里系数(B22)或蛋白质相互作用系数(Kd)进行常规定量。这两个参数相互之间具有很好的相关性,可以得出定量关系。最近引入了另一个多体相互作用参数(G22)来表征蛋白质-蛋白质相互作用,似乎比B22更广泛地适用,尤其是在较高浓度或存在强吸引力和排斥力的情况下。
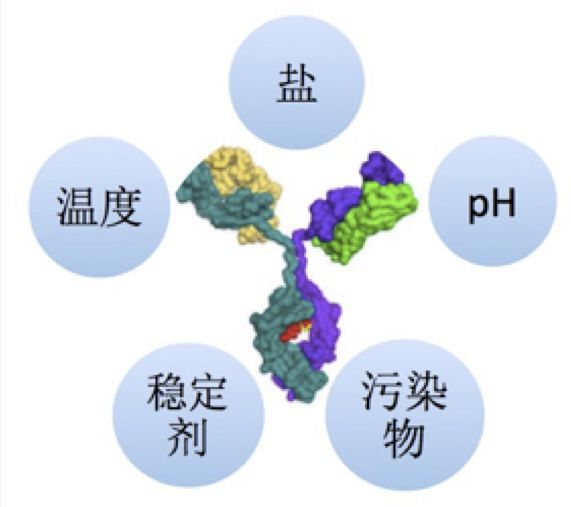
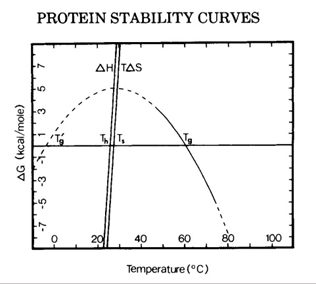
蛋白质结构、溶液组成、环境等,构象或胶体稳定性都可能决定长期的蛋白质稳定性行为。有很多数据说明蛋白质的相对构象稳定性与它们的长期聚集速率相关。基于此,解链温度(Tm)经常用于评估蛋白质构象稳定性,聚集温度(Tagg/Tonset)经常用于评估蛋白质胶体稳定性,B22/G22/Kd经常用于蛋白质聚集倾向的预测。 2.2 稳定性影响因素 蛋白质的稳定性影响因素分为几个主要的相互关联的类别:产品配方、制造工艺、容器/密闭系统和环境因素。
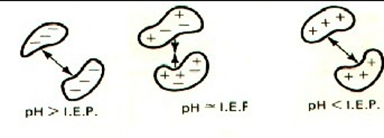
2.2.1 产品配方 配方中最关键的参数是pH。溶液的pH通过影响蛋白质的表面电荷类型、密度和分布来决定蛋白质的稳定性,这既会影响构象稳定性,又会影响胶体稳定性。因此,pH可以显著改变蛋白质聚集的速率以及化学降解的类型和速率。pH值还影响溶解度、粘度和相互作用。一般认为pH诱导的物理性质变化(例如蛋白质低聚)是可逆的。
离子强度可以通过中和蛋白质表面电荷直接影响蛋白质稳定性。与溶液pH值相似,离子强度可以影响蛋白质的构象和胶体稳定性。通常,由于一般的电荷作用,添加盐会增加蛋白质的聚集。盐的作用可能取决于盐的浓度和溶液的pH。像溶液pH一样,离子强度也会改变溶液的渗透压。
其他溶液添加剂/赋形剂的存在可能会显著改变蛋白质的稳定性。缓冲剂可能对蛋白质的稳定性产生不同的影响。研究表明,缓冲剂的类型和浓度会影响蛋白质的热稳定性、构象稳定性、聚集趋势、渗透压和黏度等。
通常为了增加蛋白质的稳定性,会在制剂中加入了稳定剂,但应仔细评估它们的加入情况,据报道,许多常用的赋形剂在一定浓度下会降低某些蛋白质的构象或胶体稳定性,包括糖、氨基酸(例如Arg和His)、表面活性剂(例如Pluoronic F-68和Tweens)以及聚合物。EDTA可能通过Fenton样反应增加了IgG1中光诱导的色氨酸氧化。某些赋形剂可以通过直接的化学键合(例如柠檬酸)或催化降解(例如丙二酸的Asn脱酰胺)来增强蛋白质的化学修饰。在大多数情况下,防腐剂会使蛋白质更不稳定。 2.2.2 环境因素 温度和光照是两个影响蛋白质稳定性的关键环境因素。 温度对蛋白质稳定性的影响已被很好地建立抛物线关系,冷和热变性温度都存在。实际上,冷变性温度可以高于0°C。例如,Yfh1是一种处于生理pH值的天然蛋白质,分别在0°C和40°C左右经历冷和热变性。将温度降低至12°C以下会导致蛋白沉淀,可能是由于冷变性引起的。冷变性和热变性状态具有相似但不相同的残留二级结构,并且水合度显著不同。
光可以诱导各种氧化、光解和交联降解产物的形成。这些光诱导产物包括易氧化残基的氨基酸氧化产物,例如Met和Trp或His、His-His二聚体、与缓冲剂的加合物、酸性或碱性变体、水解片段、其他可还原或不可还原的二聚体和低聚物、甚至不溶的颗粒。形成的聚集体还可能是氧化产物的混合物,它们可能导致颜色变化。文献证明,光会产生还原的半胱氨酸残基,二硫代半缩醛,硫醚和二硫键影响产物的形成。 可见光和紫外线照射都会产生活性氧和自由基,以促进氧化和裂解。蛋白质中的色氨酸在将光能转移到氧气方面非常活泼,并显著促进了降解的产生。这可以解释为什么色氨酸的存在会促进组氨酸在同一分子中的氧化和在不同分子中的Met在光照下的氧化。此外,免疫球蛋白能够催化O2与水之间的反应,生成过氧化氢以促进氧化。 光还可以促进蛋白质的聚集和固态氧化。 2.2.3 污染物 来自制造过程或原材料的许多潜在污染物可能会影响蛋白质的稳定性。
常见的污染物是金属,可能来自金属工艺设备或原材料。金属可以直接与蛋白质结合,降低构象稳定性,并促进金属催化的氧化、羰基化、裂解或聚集。使用一次性组件可以最大程度地减少来自工艺设备的金属渗出。 残留的有机溶剂可能会使蛋白质不稳定,这取决于它们的数量和蛋白质的敏感性。几种溶剂被证明可以增强蛋白质的聚集,如甘油、乙醇、2,2,2-三氟乙醇等。 同样,残留量的消毒剂(例如次氯酸和过氧乙酸)可以氧化蛋白质,导致蛋白质聚集。 残留的蛋白水解酶被证明可催化蛋白质片段化,导致形成颗粒并促进聚山梨酯的水解,从而间接影响蛋白质的稳定性。 来自各种产品接触表面的潜在浸出物可能会影响蛋白质的稳定性,例如预填充注射器,丁基橡胶塞以及聚偏二氟乙烯,聚醚砜和混合纤维素酯的过滤器。 常用赋形剂的杂质可能会影响蛋白质的稳定性,包括蔗糖中的纳米颗粒,PEG中的过氧化物和甲醛,以及聚山梨酯中的游离脂肪酸。 净化过程中残留的过氧化物或灭菌过程中残留的环氧乙烷可能会加速蛋白质降解。 商业一次性塑料袋中预先存在的颗粒可以增强较大颗粒的形成。 氧气可能会通过基于聚合物的注射器渗透,从而氧化其中所含的蛋白质。 二氧化碳可以扩散到各种容器中,从而降低溶液的pH值并促进蛋白质聚集。 2.2.4 其他各种表面 由于蛋白质的两亲性质,它们会遇到许多类型的表面并与它们相互作用,例如加工设备,容器/封闭系统和给药组件,这种相互作用可能导致蛋白质的简单损失,蛋白质不稳定/聚集或粘度增加等。 固体表面包括玻璃,硅化或硅烷化玻璃,不锈钢,铝以及各种类型的塑料表面。在不存在表面活性剂的情况下,硅烷化玻璃上IgG的吸附量约为0.5-0.8μg/cm2。吸附在不锈钢上的量可以在同一范围内,一次吸附层中的mAb最高可达0.34μg/cm2。相比之下,吸附在粉末状不锈钢,碳化硅和玻璃表面上的IgG的相对量分别高达0.2 mg/mL初始蛋白质浓度的49%,55%和76%。蛋白质在固体表面上的吸附程度在很大程度上取决于表面疏水性,表面电荷的类型/密度以及溶液条件,例如pH,离子强度以及赋形剂的类型和浓度。疏水气液界面可以吸引蛋白质分子,形成单层蛋白质覆盖。吸附的蛋白可以作为增强蛋白聚集的成核位点。几种模型蛋白质的聚集或颗粒形成随着空气-水界面面积的增加而显着增加。可以通过改变表面性质或简单添加表面活性剂来减少蛋白质表面吸附。 硅油广泛用于小瓶塞的表面或预填充注射器的针筒表面,以方便操作。各种尺寸的有机硅颗粒可能从容器表面脱落,特别是在搅拌过程中。蛋白质可与硅油相互作用,在硅油表面形成蛋白质单层。这种相互作用/吸附已被广泛证明可增强蛋白质聚集。 蛋白质可以与其他油性表面相互作用,从而增强蛋白质聚集。下面几种方式可用来最大程度地减少有机硅的影响,包括使用烘焙有机硅,共价连接有机硅,使用不含有机硅的塑料容器或简单添加表面活性剂等。 2.2.5 工艺流程 在蛋白质产品的生产中遇到的几种常见过程可能会影响蛋白质的稳定性,例如搅动,泵送,冷冻/融化和冻干。
搅拌包括以下过程描述之一:旋转,摇动,搅拌,混合和涡旋。
据报道,搅动会诱导蛋白质聚集和/或颗粒形成。搅拌过程中增加的空气/水界面或压缩/减压可能会促进蛋白质聚集。同样,喷气雾化可以产生大量的空气/液体界面,使蛋白质变性。震荡诱导的聚集体/颗粒可能由非共价和共价蛋白组成。 表面活性剂的添加可以使蛋白质在空气/水界面上的吸附最小化,从而使聚集最小化。应当注意的是,即使是冻干的蛋白质产品也可能会受到摇动诱导的蛋白质不稳定和聚集作用的影响。 泵送是产品灌装过程中的关键部分,可能会产生多种应力:剪切,降压/加压以及蛋白磨蚀/接触滑动,这会导致蛋白聚集。尽管某些蛋白质可以承受很大程度的剪切应力,但已有证据显示剪切在mAbs中会引起mAb的聚集和颗粒形成。减压可能会产生空化气泡,以增强蛋白质聚集。有数据表明接触滑动会导致颗粒形成,该颗粒与接触面积成正比。因此,蛋白质聚集的程度可能取决于所利用的泵送机制,此方面的研究目前仍然是科学家关注的重点。
很多工艺步骤中需要用到冻结或解冻。冷冻可能会破坏蛋白质的稳定性,并引起聚集甚至化学降解。这些负面影响可能是由于以下几种原因:结构扰动、蛋白质在冰界面上的吸附或陷于冰相、冷冻浓缩的赋形剂结晶、蛋白质或其他溶质的浓度以及pH值变化。因此,冷冻或解冻速率和最终冷冻状态温度可显著影响蛋白质稳定性或其聚集趋势。此外,由于反应物的浓缩,蛋白质化学降解(例如氧化)在冷冻状态下可能更快。 冻干涵盖两个连续事件——冷冻和干燥。蛋白质不仅会遭受冷冻诱导的压力,还会遭受干燥应力,即去除蛋白质水化层。因此冻干将潜在地破坏蛋白质的稳定性并促进蛋白质聚集。 2.3 最大化蛋白质稳定性 可以将几种策略用于蛋白质的稳定化——基因工程、化学修饰、buffer的调节、蛋白质浓度的控制、制剂赋形剂的使用和冻干。 2.3.1 基因工程 有时候通过单个氨基酸的突变就可以使蛋白质更稳定。
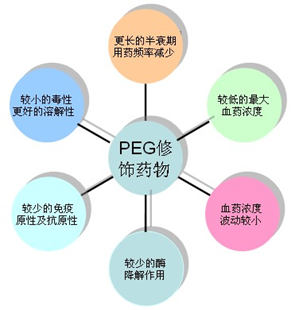
一般的稳定策略包括蛋白质中柔性区域的刚性化、分子内或分子间相互作用的改善或不稳定氨基酸的去除。由于蛋白质结构/折叠与稳定性之间缺乏明确的相关性,用于蛋白质稳定化的基因工程改造并不简单。可以基于蛋白质的序列和结构信息合理地预测蛋白质中的特定降解途径,结合使用多种稳定性预测工具或理论模型,可以更好地预测蛋白质的稳定性。 2.3.2 化学改性 可以通过连接亲水性更高的分子或聚合物来实现稳定,包括PEG、羟乙基淀粉,聚糖和β-环糊精。 聚乙二醇化可能是最流行的蛋白质修饰方法,因为它可以稳定蛋白质并同时增加蛋白质的半衰期。蛋白质的稳定化是通过两种明显的机制实现的:阳离子残基与PEG氧原子的有利相互作用,以及与PEG的疏水相互作用,以通过聚合物屏蔽减少溶剂可及的表面积。另一方面,取决于PEG的大小和结构,PEG的附着可能会在不同程度上影响蛋白质的活性,增加溶液的粘度并在某些个体中诱导抗PEG抗体的瞬时或持续形成,从而导致PEG的丢失。另外,将PEG或任何其他部分连接至蛋白质需要额外的制造步骤并增加了显著的表征负担。因此,通过化学修饰来稳定蛋白质可能需要对产品需求进行全面评估。
2.3.3 调整溶液属性 如上所述,pH和离子强度这两个常见的溶液参数对于控制蛋白质的稳定性(构象和胶体)至关重要,调节pH或离子强度均可有效增强蛋白质稳定性。某些情况下溶液pH值和离子强度的变化可能导致构象和胶体稳定性发生相反的变化,因此,这两个溶液参数可能需要组合评估。由于不同的缓冲液系统可能会对蛋白质稳定性产生重大影响,因此应适当选择缓冲液系统的类型和浓度。 2.3.4 配方赋形剂的使用 主要的配方赋形剂包括中性糖或糖醇、表面活性剂、氨基酸、螯合剂和聚合物, 其中许多也是天然渗透压剂或其衍生物。
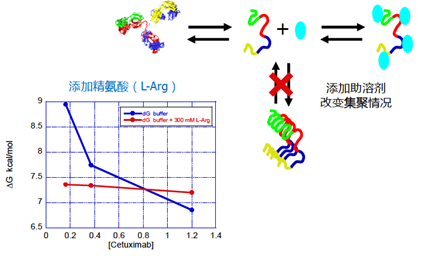
糖是广泛使用的制剂赋形剂。根据实验和模拟研究,糖的稳定程度不仅取决于糖的浓度,而且取决于其结构、大小、疏水性或水合数。糖和水分子之间的氢键比水-水氢键更紧密,因此,添加二糖会导致整体水重组率显着降低。在各种类型的糖中,最常用的是蔗糖和海藻糖。在两种二糖之间,海藻糖显示出更大优势。 多种氨基酸已用于蛋白质稳定化,例如甘氨酸,L-脯氨酸,精氨酸,其他碱性氨基酸,酸性氨基酸和蛋氨酸作为抗氧化剂。氨基酸作为氢键供体或受体,能够与蛋白质形成多个氢键以稳定化。此外,带电荷的氨基酸可以与带相反电荷的侧链发生静电相互作用。这样的相互作用可以导致蛋白质溶解度和/或构象稳定性的增加,同时蛋白质-蛋白质相互作用最小。因此,氨基酸的相对作用不仅取决于它们的氢键容量,还取决于它们的疏水性、盐的形式,当然也取决于溶液条件,例如pH和压力条件。 应当注意,取决于蛋白质、溶液性质、环境条件和相对氨基酸浓度,许多氨基酸可能同时具有稳定作用和去稳定作用。例如,由于其正电荷和胍基结构,L-精氨酸在最小化蛋白质聚集方面非常有效。另一方面,发现精氨酸可增强内皮抑素的胶凝作用,在喷雾冷冻干燥和长期储存过程中增强mAb的聚集,并在储存过程中由于蛋白构象的扰动而加速溶液和固态下mAb的聚集。 几种氨基酸(包括50mM的精氨酸,谷氨酰胺,甘氨酸和组氨酸)可以防止过氧化氢诱导的融合蛋白氧化至不同程度,但可加速搅拌诱导的聚集。氨基酸使蛋白质不稳定的作用通常与浓度有关,例如精氨酸,甘氨酸和高精氨酸的例子。 由于在低、中和高浓度下分别与蛋白质侧链,主链或水分子相互作用,因此提出了甘氨酸不同的浓度依赖性效应。 大分子可用于在特定浓度范围内选择性地稳定蛋白质。这些大分子包括PEG、蛋白质、聚乙烯亚胺、壳聚糖、右旋糖酐、羟乙基纤维素、糖单体或多糖和两性离子聚合物。 表面活性剂是制剂赋形剂的重要类别。实际上,欧洲60%以上的商品化蛋白质产品都含有表面活性剂。它们可以竞争性地积累在表面或界面上和/或直接与蛋白质相互作用,从而使蛋白质与表面以及彼此之间的相互作用最小化。因此,它们被广泛用于稳定蛋白质,以抵抗冷冻过程中的搅动压力,表面吸附,热失活,光应激或赋形剂结晶。 螯合剂(例如EDTA或DTPA)可以最大程度地减少金属催化的裂解,聚集体形成以及蛋氨酸或色氨酸的氧化。 环糊精可以稳定许多蛋白质。环糊精的稳定机制可能包括形成包合物或非包合物,与蛋白质竞争空气-水界面,以及在低温下抑制赋形剂结晶。 目前已经发现或设计出新的物质来增加蛋白质的稳定性,例如乙内酰脲可抑制蛋白质聚集,牛磺酸可稳定溶菌酶。 但是,应该注意的是,在药物产品中使用任何新型赋形剂都需要大量的安全性评估数据。 2.3.5 控制蛋白质浓度 蛋白质浓度可能在控制蛋白质稳定性中起重要作用。
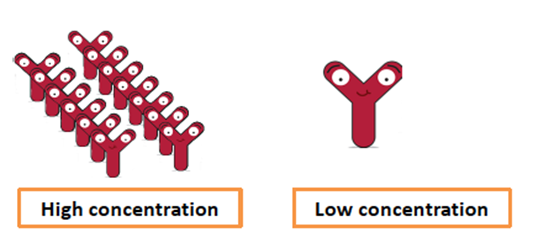
由于蛋白质浓度的提高而增强的相互作用经常导致蛋白质聚集的增加。实际上,取决于蛋白质结构、浓度范围和溶液条件,蛋白质的构象稳定性可以随着蛋白质浓度的增加而变得更高或更低。因此,通常需要通过实验确定蛋白质的最佳浓度。 2.3.6 蛋白质固化 如果以上方法均不能提供足够的稳定性,则可以固化蛋白质。蛋白质固化的最常见方法是冻干。与液态蛋白制剂相比,冻干剂的降解率降低了100倍。 但由于蛋白质可能对冻干过程敏感,因此需要优化蛋白质制剂配方,以在冻干和长期保存过程中稳定蛋白质。在这方面,二糖通常是优于糖醇(例如甘露醇或山梨糖醇或聚合物例如羟乙基纤维素)的稳定剂。缺乏空间位阻的较小糖比大型糖更有效地与蛋白质相互作用,并更有效地降低了局部迁移率,而较大的糖主要用于降低整体迁移率。由于冻干或储存过程中赋形剂的结晶或相分离通常对蛋白质的稳定性起负面作用,因此必须适当选择主要和次要赋形剂与蛋白质的相对量,以最大程度地减少此类情况。另外,可以优化许多冻干工艺参数以稳定蛋白质,包括改变初级干燥压力,冷却速率,去除或添加退火以及使用不同的填充量。 2.4 高浓度配方挑战 为了提高依从性和易用性,往往需要开发高浓度的皮下注射制剂,这是由于治疗性蛋白药物往往需要较高的治疗剂量。 高浓度蛋白质配方往往会增加蛋白质聚集倾向,并增加蛋白黏度,同时高浓度还会带来很多分析挑战,最典型的就是浓度测定。增强的蛋白质聚集可能会对产品质量、功效和安全性产生重大影响。高黏度也会给蛋白的生产带来挑战。
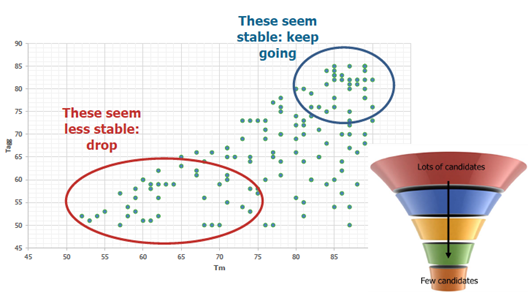
2.4.1 蛋白质聚集 通常,由于蛋白质-蛋白质相互作用的机会增加,在高蛋白质浓度下蛋白质的聚集趋势增强。由于分子之间距离的缩短,低浓度的蛋白质之间弱的吸引力可能会在高浓度下占主导地位,从而实现更快的蛋白质成核。模拟研究还表明,仅在高于临界浓度时,才会发生明显的蛋白成核/聚集。蛋白质浓度越高,聚集作用越快。随着时间的流逝,蛋白质聚集体的形成可能会进一步提高聚集率。高蛋白质浓度下增强的蛋白质-蛋白质相互作用可能会导致许多浓度依赖性溶液乳浊。 2.4.2 高溶液粘度 增加蛋白质浓度可成倍增加溶液粘度。 精氨酸由于参与静电和疏水相互作用而被认为是降低粘度的最佳添加剂。同时添加碱性氨基酸和酸性氨基酸可有效抑制分子间吸引力并降低mAb溶液的粘度。其他用于降低粘度的常用配制方法包括pH值和离子强度。 3 蛋白质配方开发的艺术 由于蛋白质稳定性的敏感性和不可预测性,需要配方开发来寻找最佳的制剂条件,以最大程度地提高不同制造步骤和长期存储的稳定性。 3.1 可开发性和稳定性指示物 如前所述,在开始制剂开发之前,通常应谨慎评估候选药物的可开发性。 可开发性评估应尽早进行,最好是在药物发现阶段。各种预测参数可用于评估可开发性的不同方面,往往包括蛋白质的热稳定性(Tm)、化学稳定性(ΔG)、聚集温度(Tagg/Tonset),聚集倾向(B22、G22、Kd等)
一旦认为可开发性可以接受,那么在制剂开发开始之前的一个主要任务是进行强制降解研究。这些研究将产生降解产物,将作为稳定性指示物以用于随后评估不同制剂或储存条件下的蛋白质稳定性。这些强制降解条件可以包括极端的pH,高温,光照,氧化条件和机械应力。 3.2 液体与冻干配方的选择 蛋白质药物产品通常以液体或冻干形式商业化。商品化的蛋白制剂中,液体与冻干产品的相对比例大约为2:1。液体剂型相对容易制造,并且便于给药,而冻干的产品更适合长时间的运输和存储。通常,如果在开发过程中蛋白质稳定性不是问题,则首选液体产品。制剂开发的复杂性和产品开发的时间紧迫性导致在开发早期就执行制剂开发是不切实际的。在这种情况下,早期可以将蛋白药物配制成平台制剂或经验配方,来支持临床前和早期临床试验。取决于资源和优先级、临床成功的机会、市场潜力和竞争格局,一般直到三期临床前才会开始大规模系统性的制剂开发。 3.3 传统配方开发思路 一般而言,配方开发是评估主要稳定性影响因素并找到最稳定的配方的过程。对这些因素的评估可以一次通过一个因素进行,也可以通过实验设计来更系统地进行。一般地,可以依次评估以下关键因素:pH——缓冲剂——离子强度——赋形剂。
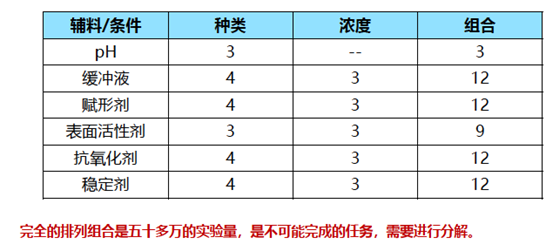
在评估过程中,经常使用压力条件来快速生成稳定性数据。典型的压力条件包括高温处理,机械应力,化学变性和冻融实验。 pH对蛋白质稳定性的影响可能很复杂,因此,可能必须通过在许多pH条件下进行稳定性研究来确定合适的pH。在此过程中,可以结合经验和文献以在狭窄的pH范围内最大程度地减少实验次数。在52种mAb产品中,超过一半的pH稳定范围为5.5至6.5,这可以支持在5-7 pH范围内进行稳定性研究的设计。由于高浓度的单克隆抗体可能表现出显着的缓冲能力,因此在蛋白质制剂中> 50 mg/mL时可以省略缓冲剂,尤其是当发现缓冲剂对蛋白质稳定性产生负面影响时。 在评估配方辅料时,可以筛选通常被认为是安全辅料。有时候必须使用一种以上的稳定化赋形剂才能达到协同或更理想的效果。氨基酸的组合使用已显示出协同作用,例如L-精氨酸和带负电荷的氨基酸(例如Glu或Asp),L-精氨酸和甘氨酸组合。但是,使用多种赋形剂不应是首选,因为这会使蛋白质制剂的表征大大复杂化。相反,具有多种功能的赋形剂(例如蛋氨酸)应作为制剂成分的首选,可以最大程度地降低氧化和酰胺化作用,同时作为缓冲剂和抗氧化稳定剂。由于安全性评估的要求,应谨慎选择未用于商业产品的新型赋形剂。 蛋白质制剂中赋形剂的量应进行谨慎评估,因为它们在储存过程中可能降解为有害物质。实例包括聚山梨酯,组氨酸或还原糖的降解。聚山梨酯降解产物包括过氧化物、不溶性脂肪酸、脂肪酸的聚氧乙烯酯、醛和许多其他产物。在储存、光照或冷冻/解冻过程中,它们可能导致进一步的蛋白质氧化,并形成游离脂肪酸颗粒。很多过敏反应可能与聚山梨酯的自氧化产物有关。 应当指出,许多常见的蛋白质稳定剂可能具有消极作用。糖可能会导致蛋白质溶液的粘度显着增加,尤其是在高浓度下。例如,果糖显示在经过-20°C的三个冷冻/解冻循环后会增加蛋白质Met的氧化,而抗坏血酸则显示出明显的蛋白质氧化羰基化作用,从而导致蛋白质聚集的增强。某些赋形剂可以是稳定剂,也可以是去稳定剂,具体取决于它们的浓度、蛋白质分子类型和实验条件。 3.4 冻干配方的开发 在许多情况下,由于稳定性问题或开发时间紧迫,可能必须开发冻干制剂。此类制剂的开发可以遵循上述开发过程,以评估不仅在液态而且在固态以及在冻干过程中影响稳定性的因素。蔗糖或海藻糖是冻干制剂中的主要稳定赋形剂。 3.5 科学的实验设计 应当根据配方开发的阶段或实验目的选择不同类型的实验方案。 显然,实验次数取决于设计的方案和要评估的稳定性影响因素的数量。全面考察所有的影响因素是不切实际的,可以使用合理的实验设计来最大程度地减少实验次数。
蛋白质制剂的系统开发应符合ICH Q8中定义的“QbD”的概念,DoE是配方开发的理想工具。 3.6 高通量工具的使用 自动化技术的进步和高通量分析工具使高通量配方开发成为现实。 高通量开发意味着以下一种或多种手段的组合:选择快速的压力条件以加速蛋白质降解,应用高通量分析方法,同时使用多种分析方法,使用自动化和集成系统等。
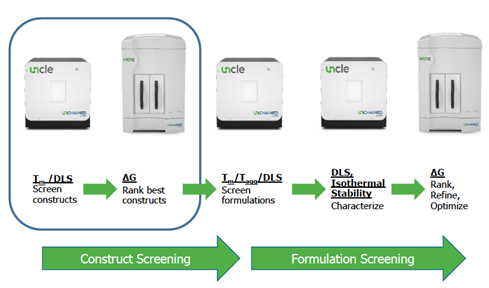
3.6.1 施加快速的压力条件 选择快速压力条件是开发高通量制剂的先决条件。实例包括等温(接近Tm)加速稳定性,快速热扫描或循环,高效变性剂滴定(吉布斯自由能),PEG诱导的蛋白质相分离,极端pH或pH的快速变化以及脉冲蛋白水解。这些条件可以单独使用,也可以组合使用,但要了解不同类型的压力条件可能导致不同的稳定性行为,例如聚集。应当注意,在一种压力条件下稳定蛋白质的赋形剂在另一种应激条件下可能成为去稳定剂。在这些压力方法中,热稳定性(Tm)的快速评估已广泛用于确定影响稳定性的关键因素或筛选配方。近年的研究表明,在低等温条件下对蛋白质施加压力更具吸引力,比如B22、G22和Kd。 3.6.2 高通量分析方法的应用 高通量分析方法的应用是高通量制剂开发的基础,包括DSF,DSC,DLS,SLS,浊度,MFI以及其他色谱法或光谱法。这些方法可以生成各种稳定性参数,例如Tm,疏水暴露温度,Tagg,C1/2,流体动力学尺寸,Kd,B22或色谱保留时间。这些方法还可以间接确定其他质量属性,例如相对溶解度和粘度。这些高通量方法通常需要微量样品量来进行分析。实际上,美国Unchained Labs推出的Stunner,低至2µL的样品就足够获得包括浓度、B22、Kd、分子半径等信息。 应当指出的是,由于DSF的灵敏度、高通量、超微量等特点,近年来它已替代DSC被广泛用作高通量测定Tm生物物理工具。 3.6.3 同时使用多种分析方法或使用自动化和集成系统 高通量制剂开发还意味着同时使用多种分析方法或使用多功能工具同时输出多种参数。 另外,采用集成的自动化系统整合多台仪器系统,可以实现无人值守的高通量自动化制剂处方开发。这种高通量自动化包括配方的高通量自动化样品准备(如称量、搅拌、震荡、滴定pH、透析或超滤等操作),在自动化系统中考察各种压力条件并对样品的输出参数如Tm/Tagg/B22/Kd/颗粒粒度/PDI/ΔG等进行测定。 4 总结 极短开发时间表、市场和监管部门对产品质量的需求无疑挑战了传统的配方挨罚方式,深入了解蛋白稳定性的影响因素,通过科学的实验设计结合高通量工具制剂开发工具可以很好地解决这个矛盾。 文末福利来啦! Unchained Labs公司的Uncle系统是一个非常优秀的工具,该系统整合了DSF/SLS/DLS三个功能模块于一体,可以在单一仪器上实现Tm/Tagg/颗粒粒度/PDI/等温稳定性/ΔG/B22/Kd/C1/2等多达十几种应用。使用UNcle系统,只需要9uL样品,单次实验可以同时对48个样品进行评估。
Unchained Labs最近开发/使用了一种新型的半自动缓冲液交换系统Big Tuna,可通过自动液体处理在96孔板中进行有效的缓冲液交换,还可以无菌过滤进入96个玻璃瓶中进行样品制备。
在制剂开发的过程中,往往需要同时准确测定大量样品的浓度,传统的测定方式如酶标仪/紫外分光光度计/nanoDrop等,面临线性范围窄、测定准确度差、重复性差、通量低、耗时等缺点。Unchained Labs推出的Lunatic系统,完美解决了以上所有问题!只需要2uL样品,同时测定高达96个样品仅需5min,线性范围达0.03~275OD,且完美符合各种法规需求!
Unchained Labs相关产品,如果感兴趣,点击"阅读原文",登记相关信息,我们还会随机抽取30位读者,赠送书籍或充电宝。
版 权 声 明 版权为生物制品圈所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制品圈”。返回搜狐,查看更多 |
【本文地址】
| 今日新闻 |
| 推荐新闻 |
| 专题文章 |