| 从脂肪组织中分离巨噬细胞,很难,但这里有一份详细的实验指南,供参考 | 您所在的位置:网站首页 › 离心转速超过多少细胞会破 › 从脂肪组织中分离巨噬细胞,很难,但这里有一份详细的实验指南,供参考 |
从脂肪组织中分离巨噬细胞,很难,但这里有一份详细的实验指南,供参考
|
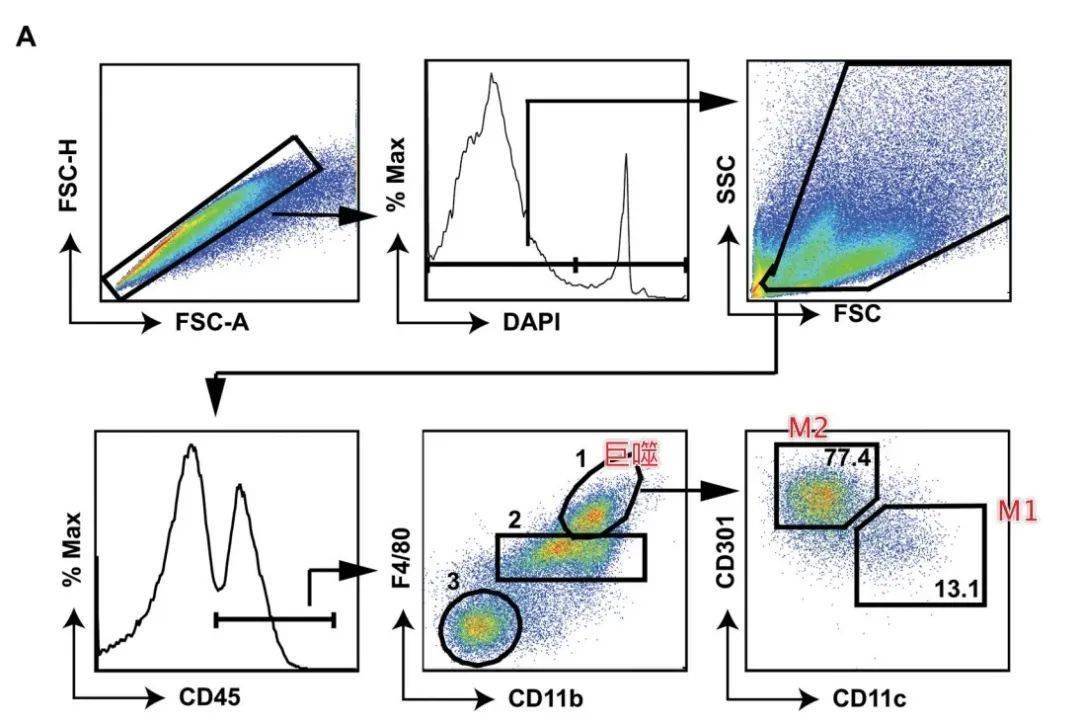
重要试剂 消化缓冲液:含 Ca2+ 和 Mg2+ 并添加 0.5% 牛血清白蛋白 (BSA) 的 Hanks 平衡盐溶液 10×胶原酶溶液(用消化缓冲液配制成10mg/ml):II 型胶原酶(Sigma-Aldrich,目录号 #C6885)。溶液应新鲜制备以获得最佳效果,可以过滤灭菌 (0.22 µm) 注意点 胶原酶消化脂肪组织时,碎组织大小、摇动强度和孵育时间是关键参数,应对其进行优化,以最大限度地提高从脂肪提取巨噬细胞的产量。通过尽可能切碎组织、在消化过程中频繁手动摇动增加接触面积,往往可增加巨噬细胞产量。 值得一提的是,胶原酶的消化时间应根据每批胶原酶分别进行优化。增加胶原酶缓冲液中的孵育时间,尤其是超过1小时,会显著降低细胞产量并增加细胞死亡几率,应避免。 步骤 •根据批准的程序对小鼠进行安乐死,并用 70% 乙醇对皮肤进行消毒。 •打开胸腔以暴露心脏。进行心脏灌注以去除组织中的血液。使用 10 cc 注射器和 25G 针头,用 10 ml PBS 缓慢灌注左心室。同时,穿刺右心房,将血液和灌注液抽出。 •无菌条件下分离生殖腺附近的脂肪组织,去除任何可见的性腺组织。分离肠系膜或腹股沟脂肪组织时,应注意去除淋巴结。 •称量分出的脂肪组织并记下具体数字,以此用于结果的标准化。 •用 PBS 清洗脂肪组织以去除任何污染物,如毛皮,并将组织放在冰上的培养皿中。 •用剪刀将脂肪组织切成小块(约 3-5 毫米)。 •将切碎的组织(≤~1 g)转移到含有 7 ml 冰冷消化缓冲液的 10 ml 圆底管中,并保持在冰上。对于 >1 g 的脂肪,将组织切碎并转移到含有 10 ml 冰冷消化缓冲液的 50 ml 锥形管中。 •加入1ml(如脂肪组织重量>1g则增加至1.5ml)10× 胶原酶缓冲液,并加入消化缓冲液使得 胶原酶的最终浓度为1mg/ml。 •在 37°C 下孵育 20-45 分钟,使试管剧烈摇晃。每 10 分钟用手大力摇动试管,可获得更高的细胞产量。30 分钟后,取 10µl产物进行显微镜观察,此时,脂肪细胞应显示为大的单细胞,白细胞和其他基质细胞会小得多。如果白细胞仍附着在脂肪细胞上,则应继续消化;如果没有,请继续下一步。 •消化后,将 EDTA 添加到 10 mM 的最终浓度,并在 37°C 下再孵育 5–10 分钟。这一步对于促进巨噬细胞的完全分离是必要的,但应限制EDTA的长时间作用,以避免对细胞活力产生不利影响。 •用 PBS 预湿 100 µm 尼龙过滤器,然后放置在 50 ml 锥形管上。使用移液管,将前述样本的细胞沉淀先转移到过滤器上过滤,然后再过滤含有脂肪细胞的上层。这可以防止较大的脂肪细胞堵塞过滤器从而影响其它细胞过滤效果。 •加入 10 ml FACS 缓冲液轻轻清洗过滤器两次。 •在 4 °C 下以 500×g 离心10 分钟以分离脂肪细胞和巨噬细胞。离心后,脂肪细胞在顶部形成白色层,而巨噬细胞等其它细胞在管底部形成红色或白色沉淀。 •轻轻吸出并丢弃脂肪细胞和上清液。此时,含有巨噬细胞的团块很容易受到干扰,因此应格外小心。 •通过轻弹试管将沉淀重悬于 0.5 ml红细胞裂解液中。在室温下孵育 5 分钟,偶尔轻轻摇晃。 •通过添加 5 ml FACS 缓冲液,中和红细胞裂解作用。 •在 4 °C 下以 500×g 离心 10 分钟。 •在 3–5 ml FACS 缓冲液中重悬细胞沉淀并在冰上孵育。 •将 10 µl 每个样品 1:1 与台盼蓝溶液混合。使用血细胞计数板仔细计数活细胞。根据计数得到的细胞数量,结合获得的样本总体积,可计算出每份脂肪组织巨噬细胞产量。典型的产量:瘦小鼠一般为1-3×10E6个细胞/g脂肪,肥胖小鼠一般为2-5×10E6个细胞/g脂肪。 设门分析
本文来自流式中文网(flowcyto.cn)欢迎转发到朋友圈,但谢绝复制粘贴转载如有需要请联系[email protected] Promotions below 返回搜狐,查看更多 责任编辑: |
【本文地址】