| 吴勇医生、吴小华教授:ADC药物在卵巢癌领域的未来方向和机遇 | 您所在的位置:网站首页 › 磷酸盐转运蛋白抗体阳性 › 吴勇医生、吴小华教授:ADC药物在卵巢癌领域的未来方向和机遇 |
吴勇医生、吴小华教授:ADC药物在卵巢癌领域的未来方向和机遇
|
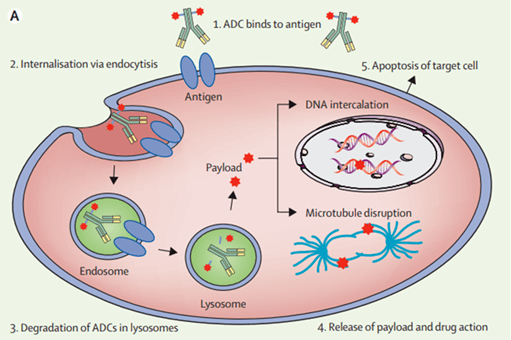
(图片来源:Drug Discov Today. 2014;19(7):869-81.) “ADC药物作用机制 ADC药物在肿瘤中发挥作用的机制主要通过以下途径进行 [5] :①注射进体内的ADC经过重重阻碍与靶细胞抗原结合;②ADC-抗原复合物通过网格蛋白(clathrin)介导的内吞作用进入细胞,包裹在核内体中(Endosome);③核内体与溶酶体融合;④药物释放至胞质。药物通过插入到DNA上或抑制微管聚合发挥作用;⑤靶细胞凋亡。当目标细胞死亡时,活跃的细胞毒性负载也可能杀死周围的肿瘤细胞。
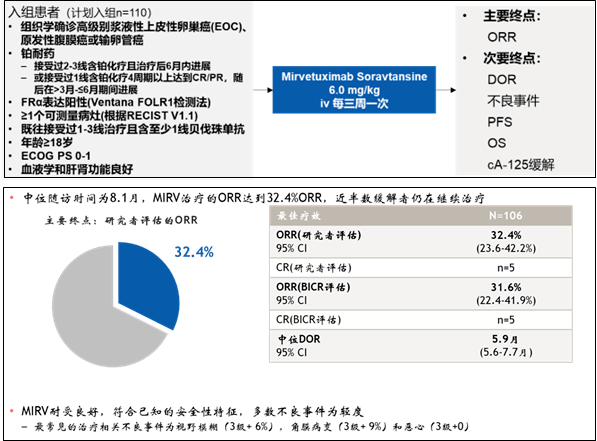
(图片来源:Lancet . 2019 Aug 31;394(10200):793-804.) “ADC 药物与卵巢癌 1、FRα-ADC Mirvetuximab soravtansine(MIRV)是靶向叶酸受体α(FRα)的抗体偶联药物(ADC),由FRα单抗和微管蛋白抑制剂美登素DM4偶联而成。2022年11月14日,FDA加速批准MIRV用于FRα阳性、铂耐药上皮性卵巢癌、输卵管癌或原发性腹膜癌患者,这些患者既往已接受1-3次全身治疗,且均使用过贝伐珠单抗。这项批准是基于关键性单臂SORAYA III期试验(NCT04296890)的结果 [6] ,在该试验中,研究者评估的ORR为32.4%(34例,其中5例CR、29例PR),DCR为78.1%,中位缓解持续时间(DOR)为5.9个月(95% CI: 5.6-7.7),中位PFS为4.3个月。安全性方面,大多数TRAE为低级别的可逆性眼部或胃肠道相关不良反应,≥3级TRAE发生率为28%。32%患者因TRAE延迟用药,7%患者终止治疗(仅1例患者因眼部AE终止治疗)。此外,1例患者因呼吸衰竭死亡,可能与研究药物相关(解剖检查未见药物相互作用或肺部转移灶)。
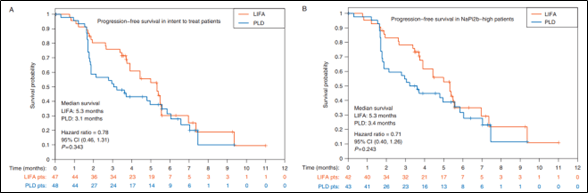
(图片来源: https://www.clinicaltrials.gov/ct2/show/NCT04296890; https://www.businesswire.com/news/home/20211130005310/en/) MIRASOL是另一个III期实验(NCT04209855),该试验入组患者为FRα高表达,既往接受过至少1线但不超过3线全身性抗肿瘤治疗,包括至少1线含有贝伐单抗的治疗的铂耐药卵巢癌(PSOC)患者。纳入的患者将按照1:1的比例随机接受MIRV或者研究者选择的化疗方案治疗。以研究者评估的PFS作为主要终点,估计样本量为430例 [7] 。目前该实验已完成患者入组,预计将于今年年初获得顶线数据。 在已结束的FORWARD II试验(NCT02606305)中 [8] ,数据表明MIRV联合贝伐在铂敏感复发卵巢癌(PSOC)亚组中的ORR为69% (11/16),mDOR为12.7个月,mPFS为13.3个月。MIRV联合卡铂治疗FRα阳性PSOC的mDOR为24个月。基于上述结果, MIRV也在探索单药或联用其他药物在PSOC中治疗的适应症。其中GLORIOSA实验主要评估MIRV与贝伐联用作为FRα高表达PSOC维持治疗的可能性。TRIAL420则是评估MIRV与卡铂联用治疗FRα低/中/高表达PSOC的有效性。这两项临床试验均在2022年第二季度启动。期待MIRV在PSOC中的临床数据。 2、NaPi2b-ADC 2b型钠依赖性磷酸盐转运体(NaPi2b)是一种多通道的膜蛋白,该家族由NaPi2a(SLC34A1)、NaPi2b(SLC34A2)和NaPi2c(SLC34A3)构成。其中NaPi-2b蛋白通过钠离子共转运介导无机磷酸盐进入上皮细胞,负责维持全身的磷酸盐平衡。NaPi2b在卵巢癌和非小细胞肺癌腺癌中广泛表达,但较少表达在正常组织中。 迄今为止,两种靶向NaPi2b的ADC已被报道过。Lifastuzumab vedotin(LIFA)是一种人源化抗NaPi2b单克隆抗体,与羟丙胺澳瑞他汀E(MMAE)偶联,通过阻断微管蛋白的聚合来抑制细胞分裂。英国学者报道了LIFA对比标准治疗在PROC患者中的疗效研究 [9] 。该研究共计95例患者进行随机分组(LIFA组47例,PLD组48例)。意向性分析(ITT)人群中PFS风险比为0.78(95%CI: 0.46-1.31,P=0.34,中位PFS为5.3个月 vs. 3.1个月)。在Napi2b高表达患者中PFS风险比为0.71(95%CI: 0.40-1.26,P=0.24,中位PFS为5.3个月vs. 3.4个月)。该研究PFS未达显著统计学改善。
(图片来源:Ann Oncol. 2018; 29(4):917-923.) 3、Mesothelin-ADC 间皮素(MSLN)是卵巢癌细胞表面过度表达的肿瘤分化抗原,参与肿瘤细胞的多种恶性行为,是卵巢癌研究的热门靶点之一。Anetumab ravtansine(AR)是一种针对间皮素抗原的完全人源化抗体,与微管蛋白聚合抑制剂偶联。2022ASCO大会上公布了一项临床试验 [11] ,评估AR+贝伐珠单抗(ARB)与每周紫杉醇+贝伐珠单抗(PB)在PROC患者中的安全性和疗效。在II期研究中,共计57名患者入组,其中包括28名入组ARB的患者和29名入组对照组的患者。MSLN阳性率为88%。在35例PFS事件时,ARB组观察到1例CR和4例PR(ORR = 18%),而PB组看到16例PR(ORR=55%)。ARB的预估中位PFS为5.3个月(95% CI: 3.7-7.4),PB为9.6个月(95% CI: 7.4-17.4)。该实验并未看到MSLN-ADC在PROC患者中的疗效。目前针对MSLN靶点,开发卵巢癌CAR-T产品也在如火如荼地开展中。 4、其他ADC与卵巢癌 针对HER2-ADC药物在卵巢癌中的研究数据目前较少。在一项多队列篮子试验中 [16] ,58名HER2扩增的肿瘤(包括晚期肺癌、子宫内膜癌、涎腺癌、胆道癌、卵巢癌、膀胱癌、结肠直肠癌和其他癌症)患者每3周接受一次3.6 mg/kg的静脉注射阿多曲妥珠单抗-emtansine治疗。关于卵巢癌的ORR为17%(1/6)。有一例(2%)出现3级中性粒细胞减少症。目前绝大多数HER2-ADC药物在卵巢癌中正进行I/II期临床试验。值得一提的是,考虑到HER2在卵巢癌中的表达情况,笔者认为有必要在卵巢癌不同组织类型中进行后续临床试验。 “ADC药物的耐药性 如前所述,ADC是兼具特异靶向能力和强大杀伤作用的“魔法子弹”。尽管ADC药物取得了突破性的进展,但其耐药机制也被不断地关注。目前的文献结果显示,ADC结构的任一组分发生异常或在周期性治疗压力下都会导致耐药的产生 [17, 18] 。ADC的耐药机制可能包括:①ADC暴露压力过大;②靶点抗原下调、缺失或抗原基因突变;③内化途径的缺失;④溶酶体蛋白水解功能降低;⑤溶酶体转运蛋白突变;⑥细胞周期停滞;⑦药物外排转运蛋白表达异常;⑧下游信号通路被激活;⑨凋亡失调。那么如何克服耐药,笔者认为ADCs与免疫检查点抑制剂、PARP、TKI抑制剂等联合治疗策略;新型技术的研发,如新型偶联技术、多肽偶联药物、不同payload载药的提升是未来主要探索的方向。
(图片来源:Cancer Res . 2018;78(9):2159-2165.) “ADC药物在卵巢癌中的未来和机遇 卵巢癌高复发率、低治愈率及易耐药性一直是妇科肿瘤领域的难点及热点。但近年来,卵巢癌治疗迅速发展,抗血管生成抑制剂和PARP抑制剂等靶向治疗药物有效地改善了卵巢癌的整体生存,ADC药物在卵巢癌中也展现了良好前景。但是值得注意的是,目前很多ADC药物在卵巢癌中单药治疗并没有显示出积极的疗效,联合其他药物或者新型双抗ADC药物的研发给卵巢癌带来了新的思路。展望未来,我们期待新的靶点ADC药物研究可以进一步深入,特别是可以筛选出可能潜在受益的人群,使卵巢癌患者有望像高血压、糖尿病等慢性病人一样获得长期生存! 参考文献(滑动查看): [1] HONG D S, CONCIN N, VERGOTE I, et al. Tisotumab Vedotin in Previously Treated Recurrent or Metastatic Cervical CancerTisotumab Vedotin in Recurrent or Metastatic Cervical Cancer [J]. Clinical Cancer Research, 2020, 26(6): 1220-8. [2] MARKHAM A. Tisotumab vedotin: first approval [J]. Drugs, 2021, 81(18): 2141-7. [4] EL BAIRI K, AL JARROUDI O, AFQIR S. Revisiting antibody-drug conjugates and their predictive biomarkers in platinum-resistant ovarian cancer [J]. Semin Cancer Biol, 2021, 77(42-55. [5] TYMON-ROSARIO J, GORMAN M, RICHARDSON D L, et al. Advances in antibody-drug conjugates for gynecologic malignancies [J]. Curr Opin Obstet Gynecol, 2023, 35(1): 6-14. [6] MOORE K N, LORUSSO D, OAKNIN A, et al. Integrated safety summary of single-agent mirvetuximab soravtansine in patients with folate receptor α (FRα)-positive recurrent ovarian cancer: Phase 1 and 3 clinical trials [J]. Journal of Clinical Oncology, 2022, 40(16_suppl): 5574-. [7] MOORE K N, VAN GORP T, WANG J, et al. MIRASOL (GOG 3045/ENGOT OV-55): A randomized, open-label, phase III study of mirvetuximab soravtansine versus investigator’s choice of chemotherapy in advanced high-grade epithelial ovarian, primary peritoneal, or fallopian tube cancers with high folate-alpha (FRα) expression [M]. American Society of Clinical Oncology. 2020. [8] O'MALLEY D M, MARTIN L P, GILBERT L, et al. Mirvetuximab soravtansine, a folate receptor alpha (FRα)-targeting antibody-drug conjugate (ADC), in combination with bevacizumab in patients (pts) with platinum-resistant ovarian cancer: Maturing safety and activity profile from the FORWARD II phase 1b study [M]. American Society of Clinical Oncology. 2018. [9] BANERJEE S, OZA A M, BIRRER M J, et al. Anti-NaPi2b antibody-drug conjugate lifastuzumab vedotin (DNIB0600A) compared with pegylated liposomal doxorubicin in patients with platinum-resistant ovarian cancer in a randomized, open-label, phase II study [J]. Ann Oncol, 2018, 29(4): 917-23. [10] RICHARDSON D L, BARVE M A, STRAUSS J F, et al. Phase I expansion study of XMT-1536, a novel NaPi2b-targeting antibody-drug conjugate (ADC): Preliminary efficacy, safety, and biomarker results in patients with previously treated metastatic ovarian cancer (OC) or non-small cell lung cancer (NSCLC) [J]. Journal of Clinical Oncology, 2020, 38(15_suppl): 3549-. [11] LHEUREUX S, ALQAISI H, COHN D E, et al. A randomized phase II study of bevacizumab and weekly anetumab ravtansine or weekly paclitaxel in platinum-resistant or refractory ovarian cancer NCI trial# 10150 [M]. American Society of Clinical Oncology. 2022. [12] WIEDEMEYER W R, BHEDDAH S, SAECHAO C, et al. Abstract NT-113: SC-003, AN ANTIBODY-DRUG CONJUGATE TARGETING DIPEPTIDASE 3, EXHIBITS POTENT ANTI-TUMOR ACTIVITY IN PATIENT-DERIVED XENOGRAFT MODELS OF HIGH GRADE SEROUS OVARIAN CANCER [J]. Clinical Cancer Research, 2019, 25(22_Supplement): NT-113-NT-. [13] HAMILTON E, O'MALLEY D M, O'CEARBHAILL R, et al. Tamrintamab pamozirine (SC-003) in patients with platinum-resistant/refractory ovarian cancer: Findings of a phase 1 study [J]. Gynecol Oncol, 2020, 158(3): 640-5. [14] EL BAIRI K, KANDHRO A H, GOURI A, et al. Emerging diagnostic, prognostic and therapeutic biomarkers for ovarian cancer [J]. Cell Oncol (Dordr), 2017, 40(2): 105-18. [15] LIU J F, MOORE K N, BIRRER M J, et al. Phase I study of safety and pharmacokinetics of the anti-MUC16 antibody-drug conjugate DMUC5754A in patients with platinum-resistant ovarian cancer or unresectable pancreatic cancer [J]. Ann Oncol, 2016, 27(11): 2124-30. [16] LI B T, MAKKER V, BUONOCORE D J, et al. A multi-histology basket trial of ado-trastuzumab emtansine in patients with HER2 amplified cancers [M]. American Society of Clinical Oncology. 2018. [17] COLEMAN N, YAP T A, HEYMACH J V, et al. Antibody-drug conjugates in lung cancer: dawn of a new era? [J]. NPJ Precis Oncol, 2023, 7(1): 5. [18] GARCIA-ALONSO S, OCANA A, PANDIELLA A. Resistance to antibody–drug conjugates [J]. Cancer research, 2018, 78(9): 2159-65.
吴小华教授 主任医师、教授、博士生导师 复旦大学附属肿瘤医院妇瘤科主任 妇科肿瘤多学科综合治疗团队首席专家 中国抗癌协会妇科肿瘤专业委员会主任委员 中华医学会妇科肿瘤学分会常务委员 中国临床肿瘤学会理事 上海市抗癌协会理事 上海市抗癌协会妇科肿瘤专业委员会主任委员 IGCS国际委员会委员、亚太理事候选人SGO教育委员会委员、执行委员美国西北大学Feinberg医学院妇产科系客座教授
吴勇医生 主治医师 复旦大学附属肿瘤医院肿瘤妇科 复旦大学肿瘤学博士 主持国家自然科学基金、上海科委青年扬帆课题、上海市卫健委青年课题、上海抗癌协会雏鹰计划A类课题,并参与多项国家级课题 以一作或共一第一发表文章SCI论著20余篇 熟练掌握妇科恶性肿瘤基本治疗原则,包括宫颈癌,卵巢癌,子宫内膜癌等 作者 | 吴勇医生、吴小华教授 编辑 | xu返回搜狐,查看更多 |
【本文地址】