| Phil Baran团队Acc. Chem. Res:有机电化学合成入门指南 | 您所在的位置:网站首页 › 电化学原理视频 › Phil Baran团队Acc. Chem. Res:有机电化学合成入门指南 |
Phil Baran团队Acc. Chem. Res:有机电化学合成入门指南
|
Phil Baran团队Acc. Chem. Res:有机电化学合成入门指南
有机合成是指利用化学方法将单质、简单的无机物或有机物制成比较复杂的有机物的过程。有机电化学合成是利用电化学氧化或者还原的方法合成有机物,与有机合成相比,有机电化学合成具有独特的优势:如通过反应物在电极上得失电子而实现,不需要加入氧化还原试剂;可以在常温常压下进行,反应条件温和,对反应设备要求低;通过调节电极电位和电流密度即可方便地控制电极反应及速率。这样大大简化了反应步骤,同时减少物质的消耗以及副反应的发生,十分符合原子经济性及绿色化学原理。随着对有机电化学合成反应机理的深入研究以及反应设备的标准化,该方法越来越受到人们的关注。 有机电化学合成按反应物与电极之间电子交换过程的不同,可分为直接电合成和间接电合成。直接电合成是电极直接给予反应物电子或者从反应物上获得电子以生成自由基中间体,该中间体再进行均相反应得到不同的产物或者中间体。而间接电合成则是利用氧化/还原价的金属离子来氧化或者还原有机化合物,生成的还原态或者氧化态金属离子,再在电极表面上失去或者得到电子而恢复原态,如此循环使反应进行。只不过直接电合成容易导致电极钝化或污染,使反应过程中电流密度急剧下降,不利于工业应用,本文中主要提到的是间接电合成反应。另外,根据提供电流的方式不同可以分为恒电压法和恒电流法。当在一个电极上形成的物质会在另一个电极上反应时可以使用带有隔膜的电解池,从而实现选择性地合成化合物。从机理上来说,反应中包含电子转移时即可利用电化学合成来实现。但是,在实际操作时还会受到很多因素的影响,比如电极电位、电流、溶剂、电解液和电极材料等,因此,设计一种新型的电化学合成反应对于经验丰富的有机化学家也是一种挑战。
图1. 电化学反应的基本特征与条件优化。图片来源:Acc. Chem. Res. 近日,美国斯克利普斯研究所(The Scripps Research Institute,TSRI)的Phil S. Baran教授(点击查看介绍)团队结合自身经验对有机电化学合成中的设计理念以及优化方法进行了总结,对他们实验室中典型的电催化反应进行了概述,通过对相关电催化反应机理以及问题解决思路的介绍,希望对有志于有机电化学合成方向的研究者提供指导作用。相关工作发表在Accounts of Chemical Research 期刊上。
图2. Phil S. Baran教授。图片来源:Baran Lab
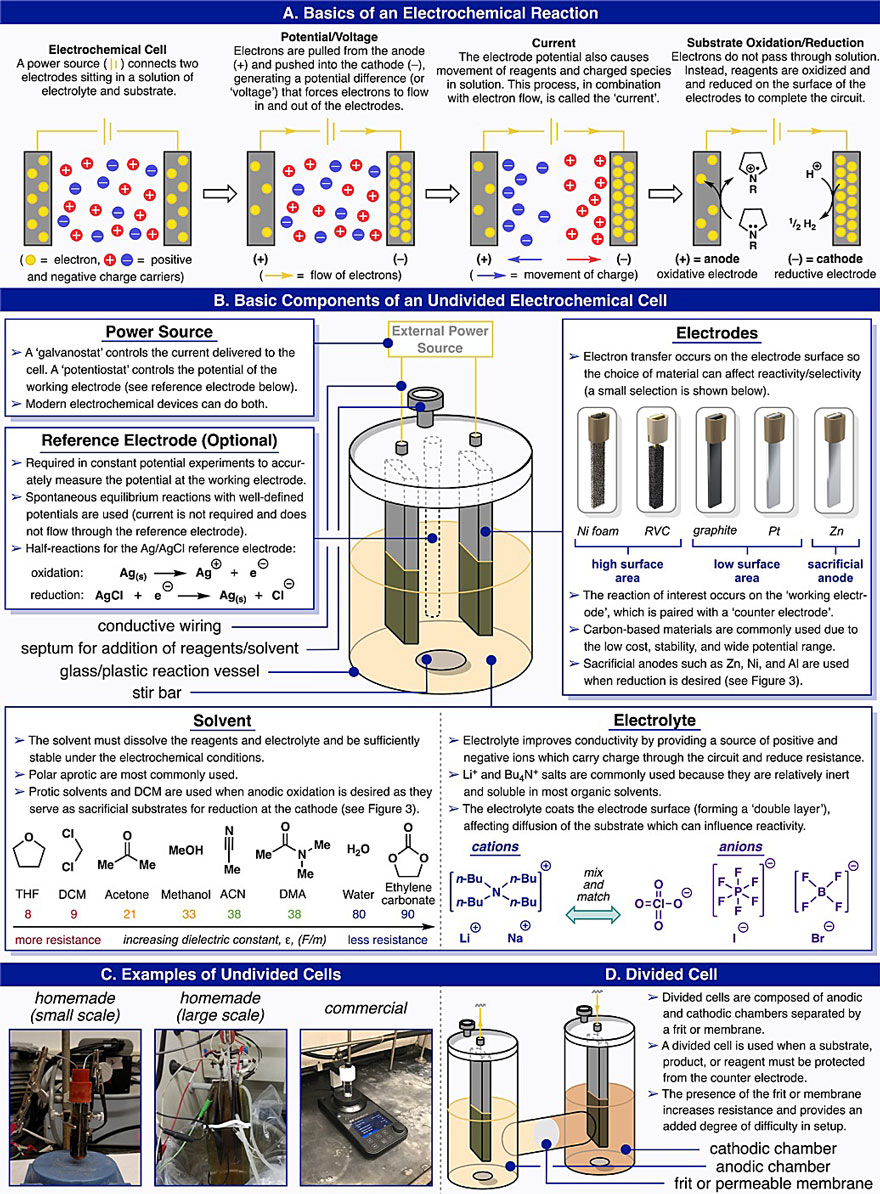
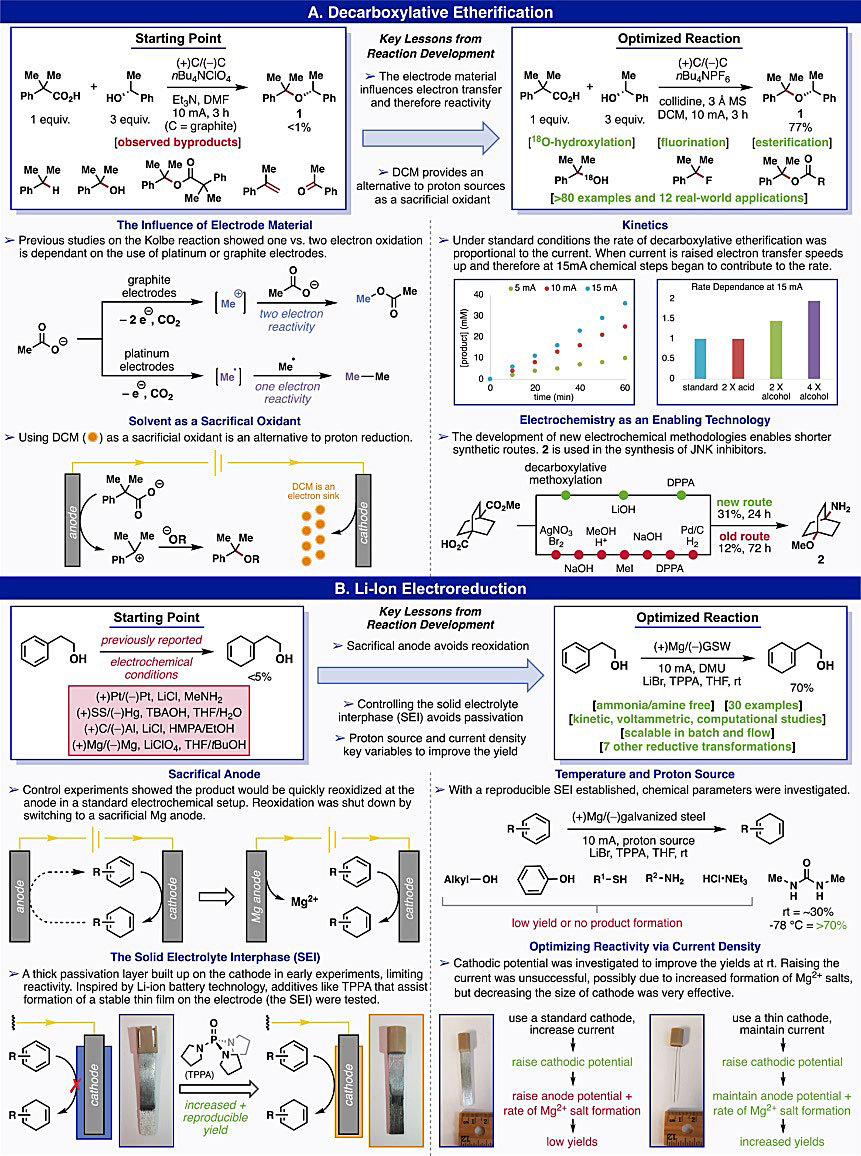
图3. 无隔膜电解池中电合成反应机理与设计原理。图片来源:Acc. Chem. Res. 在设计电化学有机反应之前,首先要考虑电极电势和相关转化的氧化还原机制(图3)。电极电势描述了氧化/还原条件的强度,例如了解反应物上官能团氧化还原反应(如胺的氧化、酮的还原)所需的电极电势是设计反应的关键。通常情况下,基于底物的特点来确定合成过程是通过电氧化、电还原或者成对电化学合成方法进行。通过对电化学合成醚(图4)、电催化C(sp3)-H键的氧化与氟化(图5)以及电催化的底物胺化(图6)等反应的总结,作者对电化学反应的设计和优化进行了说明。在电化学合成反应中,通常利用循环伏安法(CV)来确定反应物的氧化还原电位,由此确定合适的电催化剂。在反应中电催化剂需要具有良好的稳定性,与电极之间的电子转移速度快且不可逆。另外,对于电合成反应机理的研究更为重要,常用的方法有循环伏安法、质谱、电子顺磁共振和原位红外等,由此可以优化反应条件,比如电极材料、电解质的种类、溶剂的成分等。以电极材料为例,铂电极倾向于单电子氧化底物形成自由基,而石墨则能促进底物失去第二个电子以生成碳正离子,这两种电极反应活性的差异可能是由于电极表面电流密度不同,从而导致自由基的浓度不同。合成条件中很小的变化都会对反应产物有很大的影响,作者多次基于反应机理改进电合成的条件以扩大反应底物的应用范围。另外,作者也多次提到化学直觉在设计和优化反应中的重要性,直觉是一种直接的、不经严密的逻辑推理的思维。有时候可以帮助人们跨越复杂的推理过程,直接得出最终的结论。当然,这也是在对反应机理熟悉的基础上实现的。 1834年,法拉第首次发现了有机电化学合成反应——Kolbe电解反应(Ann. Phys., 1834, 109, 301−331),实现了自由基脱羧过程。然而,在某些情况下,阳极表面形成的自由基可以被进一步氧化为碳正离子,从而抑制了Kolbe电解反应。Hofer−Moest (H-M) 反应则通过使用醇类溶剂捕获碳正离子生成醚来避免被氧化(Ann. Chem., 1902, 323, 284−323)。然而,由于醇类溶剂量的限制,H-M反应并未得到广泛的应用。图4A显示在先前的H-M反应条件下,仅得到痕量的产物1(< 1%),同时伴有多种副产物。对反应条件进行优化,发现吡啶类化合物可力丁由于难氧化且空间位阻较大,可以将产物1的收率提高到5-10%。另外,DCM可以抑制碳正离子中间体的消除,这可能是由于醇的亲核性增强,从而提高反应收率。同时加入分子筛也能提高反应的收率。
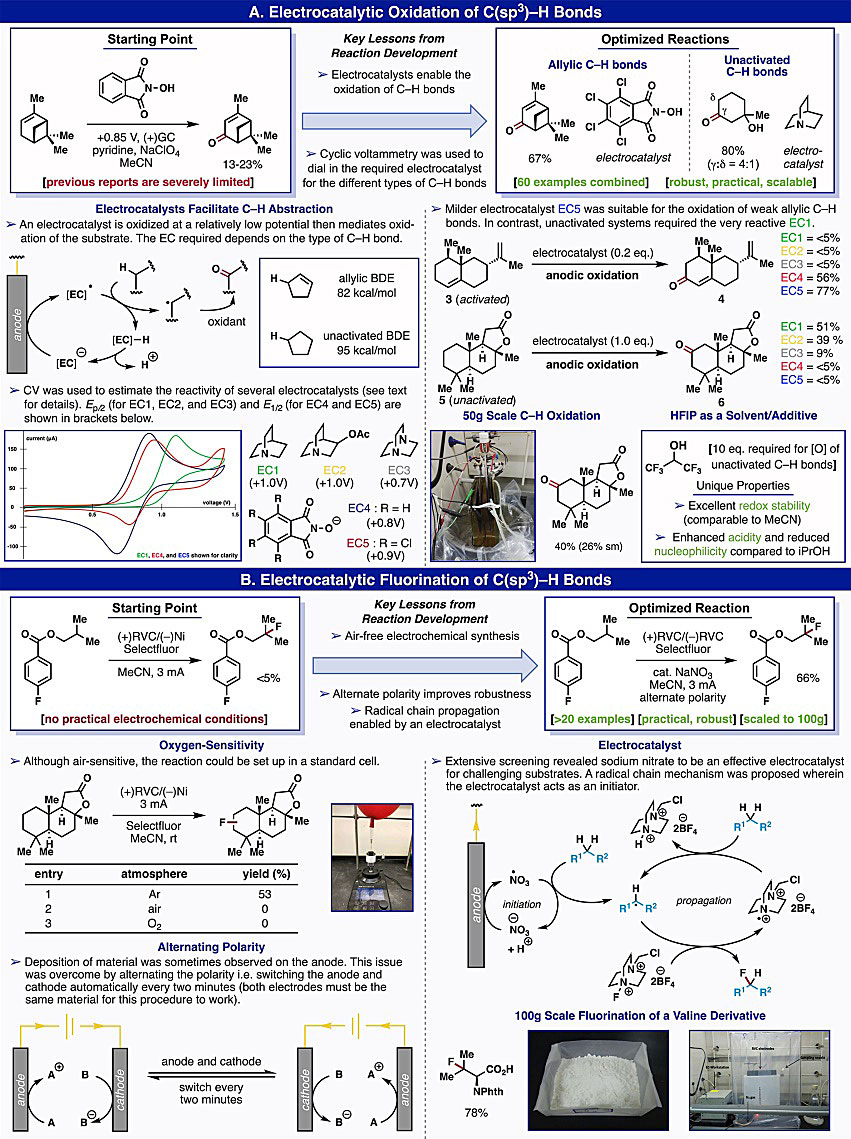
图4. 比较典型的电化学氧化还原反应。图片来源:Acc. Chem. Res. 早在1975年,就报道过C-H键的直接阳极氧化——Shono氧化反应(J. Am. Chem. Soc., 1975, 97, 4264−4268),但是该反应仅限于简单的底物或者含有较弱C-H键(α-杂原子)的底物。然而,由于无法大规模地实现烯丙基的C-H键氧化,化学家们尝试使用电催化来实现C-H键氧化(图5A)。Masui及其研究团队最初使用N-羟基邻苯二甲酰亚胺(NHPI)作为电催化剂,通过电化学实现烯丙基的C-H键氧化(Chem. Pharm. Bull., 1983, 31, 4209−4211),其中阳极氧化产生的N-氧自由基通过氢原子转移(HAT)将烯丙基C-H键断裂,随后被空气捕获形成烯酮。对反应条件进行优化,发现NHPI的四氯衍生物(TCNHPI)能够显著提高收率,这是由于与NHPI相比,TCNHPI 的N-氧自由基更缺电子。随后,将反应底物扩展到未活化的C-H键氧化,在此条件下,奎宁环无法实现亚甲基的C-H键氧化。对反应条件进行优化,结果显示电解质是至关重要的,这可能是由于Li与奎宁环的配位作用增强了反应活性。此外,酸(HFIP)作为添加剂也是至关重要的。类似地,电催化也可以实现C(sp3)-H键的氟化。
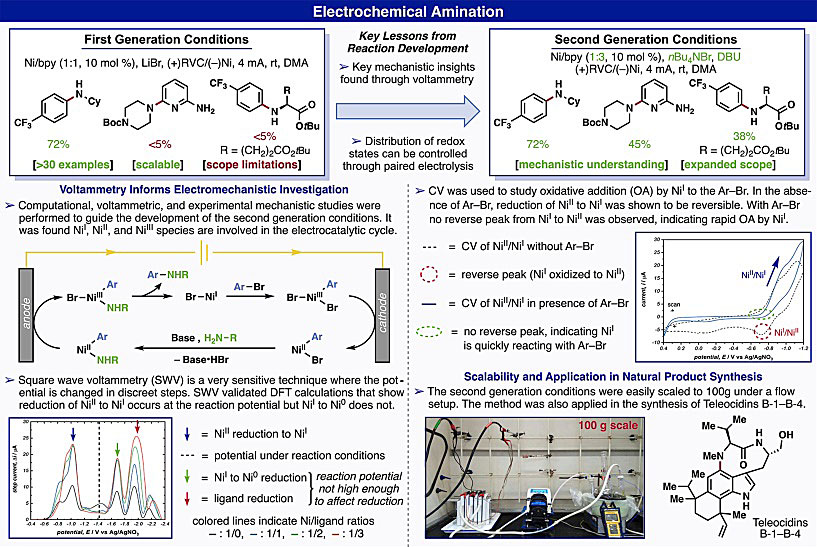
图5. 电催化C(sp3)-H键的氧化与氟化。图片来源:Acc. Chem. Res. 2017年,Baran课题组报道了电化学驱动的Ni催化的芳基胺化反应(Angew. Chem., Int. Ed., 2017, 56, 13088−13093),实现了芳基卤化物、芳基三氟甲磺酸酯与胺、醇、酰胺的偶联(图6)。当反应中同时需要氧化和还原电催化剂时,成对电解非常适合,因为氧化和还原过程可分别在阳极和阴极进行。但是,第一种条件仅限于缺电子的芳基卤化物以及伯、仲烷基胺,杂芳基卤化物则不能兼容该反应。为了解决这一问题,作者对反应机理进行了研究。循环伏安法(CV)显示Ni(0)和Ni(I)都可以通过阴极还原Ni(II)前体生成,同时还可以观察到Ni(I)对芳基溴化物进行氧化加成的过程。此外,紫外可见光谱表明Ni(II)前体在溶液中以多种物质的混合物形式存在。总体而言,这些探究促进了第二种条件的形成,使得底物范围更广泛,氨基酸、杂芳基卤化物、核苷类似物、DNA、天然产物和寡肽都能够兼容该反应,同时也可用于Teleocidins B1−B4的全合成中。
图6. 基于成对电解反应实现底物胺化。图片来源:Acc. Chem. Res. 总结 随着电化学仪器的发展和标准化,为电化学合成提供了良好的基础。电化学合成操作简单,处理方便,然而人们对于电化学合成的实际操作和设计还是比较缺乏。本文阐述了电化学的基本原理,为刚接触电化学合成的研究人员提供了指导,尤其是对电化学合成反应设计的前因后果进行的解释以及对反应条件优化过程的分析,使得读者更清楚地了解电化学合成的规则,对设计新型的电化学反应具有重要的意义。 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):
A Survival Guide for the “Electro-curious” Cian Kingston, Maximilian D. Palkowitz, Yusuke Takahira, Julien C. Vantourout, Byron K. Peters, Yu Kawamata, Phil S. Baran Acc. Chem. Res., 2020, 53, 72-83, DOI: 10.1021/acs.accounts.9b00539 导师介绍 Phil S. Baran https://www.x-mol.com/university/faculty/668 如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载! 点击分享 收藏 取消收藏 评论: 0 |
【本文地址】