| “水”一篇Science | 您所在的位置:网站首页 › 甲烷燃烧产物的检验方法是 › “水”一篇Science |
“水”一篇Science
|
“水”一篇Science——甲烷催化氧化制甲醇,水是关键
甲烷(CH4)是天然气的主要成分,由于其C-H键键能较强(104 kcal/mol),因此难以转化为高附加值产品如芳烃、烯烃、氧化产物。相比于甲烷,常温常压下为液态的甲醇无疑更适合作为燃料或者化工原料。目前,工业上主要利用合成气(H2和CO)来生产甲醇(CH3OH),由甲烷至甲醇却很少见到。而在自然界中,生物酶利用含氧分子(如H2O、O2、CO2)在室温下便可将CH4直接转化为CH3OH。然而,要想将此类仿生策略应用于非均相催化,通常需要高温,从而导致选择性差。一些氧化物和金属氧化物的表面会在室温下分解CH4,这为CH4至CH3OH的直接转化提供了可能性。实际上,Ni/CeO2(111)催化剂能将CH4、O2和H2O的混合物直接转化为CH3OH,但是反应的选择性较低(< 40%)。而CeO2/Cu2O/Cu(111)催化剂在H2O存在下,CH4至CH3OH的选择性接近70%。尽管学界已经对反应机理进行了广泛的研究(J. Am. Chem. Soc., 2005, 127, 1394–1395; J. Am. Chem. Soc., 2018, 140, 7681–7687; J. Am. Chem. Soc., 2010, 132, 14736–14738; J. Catal., 2016, 338, 305–312),如活性位点、反应中间体的性质、反应途径以及O2和H2O在CH4至CH3OH转化中的作用,但对活性催化剂CeO2/Cu2O/Cu(111)高选择性地生产CH3OH(〜70%)的相关机理,目前仍是迷雾蒙蒙。 近期,美国布鲁克海文国家实验室(BNL)化学部的Ping Liu、José A. Rodriguez和Sanjaya D. Senanayake等科学家深入研究了CeO2/Cu2O/Cu(111)催化剂在CH4、O2和H2O的反应条件下高选择性地生产CH3OH的机理,发现选项性的关键在于H2O。研究表明,H2O主要有以下三方面作用:(1)活化CH4,通过断裂一个碳氢键并提供一个-OH,将CH3直接转化为CH3OH;(2)阻断可能将CH4和CH3OH转化为 CO和CO2的反应位点;(3)促进表面上形成的CH3OH转移到气相中。相关成果发表在Science 上,第一作者为Zongyuan Liu和Erwei Huang。
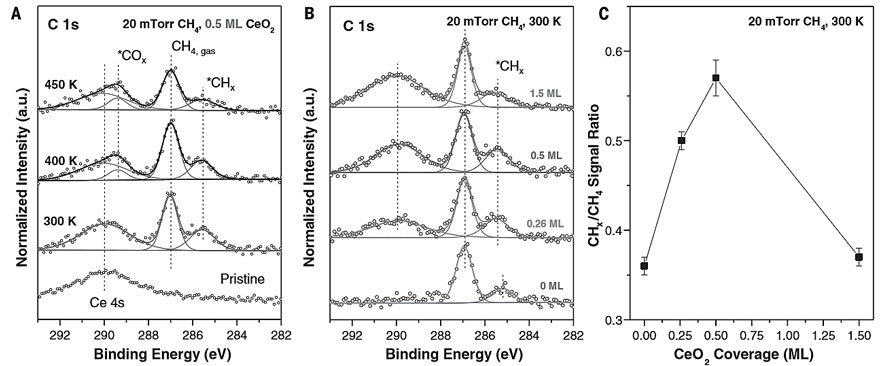
研究团队合影,Zongyuan Liu(后排右二)、Erwei Huang(后排右一)、Ping Liu(前排右二)、José A. Rodriguez(前排右三)、Sanjaya D. Senanayake(前排左一)。图片来源:BNL [1] 如图1A所示,作者将CeO2/Cu2O/Cu(111)表面[θCeO2 = 0.5 ML]在300 K下暴露于20 mTorr CH4中,环境压力X-射线光电子能谱(AP-XPS)的C 1s区域出现两个峰:〜287.0和285.3 eV,分别归因于CH4气相和表面*CHx物种(室温下CH4的解离吸附所致,覆盖范围〜0.15 ML)。此外,在400-450 K之间出现一个新的特征峰(289.4 eV),对应于*COx物种(由表面O位点与CH4完全分解产生的C原子形成)。随后,作者将不同CeO2覆盖率的CeO2/Cu2O/Cu(111)表面在300 K下暴露于20 mTorr CH4中,并将得到的AP-XPS C 1s谱图(图1B)归一化为气态CH4的峰强度后,发现活性最高的CeO2/Cu2O/Cu(111)体系中CeO2覆盖率接近0.5 ML(图1C)。也就是说,具有0.5 ML CeO2的CeO2/Cu2O/Cu(111)体系表现出最佳的CH4活化和转化性能。
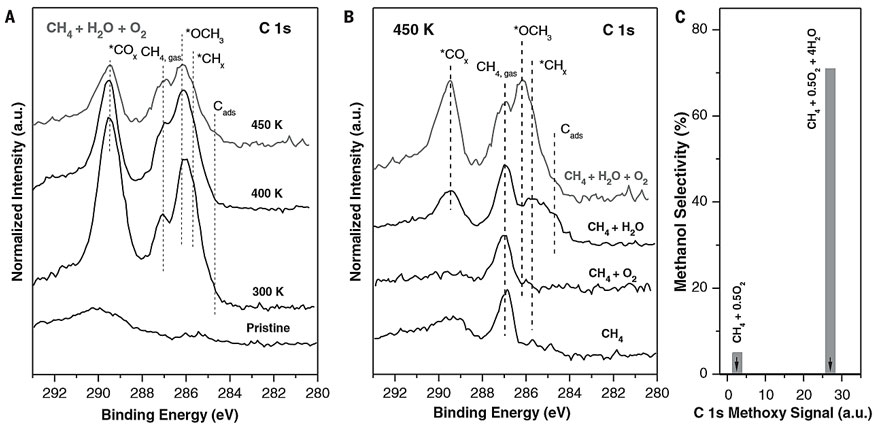
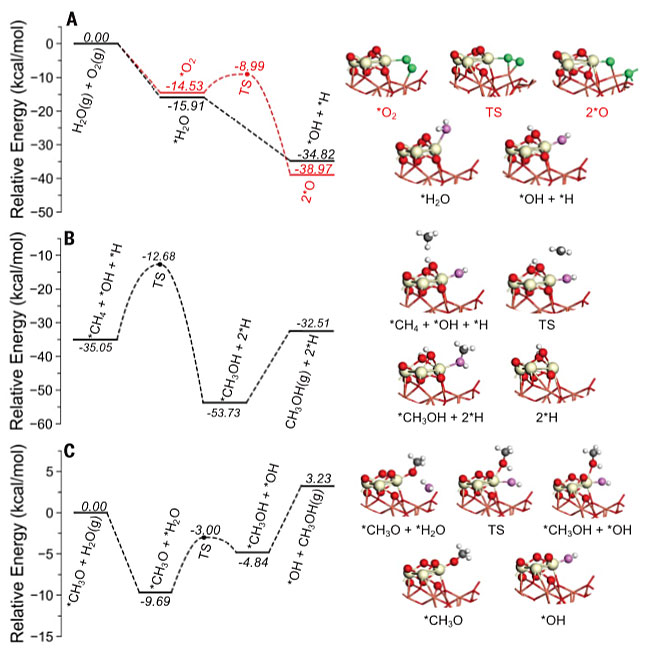
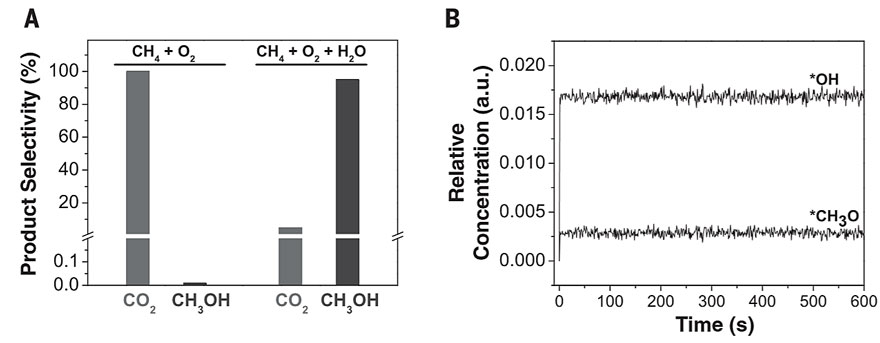
图1. 甲烷与CeO2/Cu2O/Cu(111)的相互作用。图片来源:Science 于是,作者将CeO2/Cu2O/Cu(111)表面[θCeO2 = 0.5 ML]在300-450 K下暴露于CH4/O2/H2O中,AP-XPS C 1s谱图显示在400 K和450 K中观察到~286.2 eV的特征峰(图2A),作者将其归因于吸附的CH3O,这是CH4→CH3OH转化的起点。随后,作者将CeO2/Cu2O/Cu(111)表面[θCeO2= 0.5 ML] 在450 K(CH3OH生产的温度阈值)下分别暴露于CH4、CH4 + O2、CH4 + H2O和CH4 + H2O + O2中,其中纯CH4、CH4/O2中催化剂表面上的*CHx和*CH3O可忽略不计。也就是说,CH4/O2主要生成(〜95%)CO和CO2。当向反应中添加H2O时,会生成*CH3O和*CHx,但是当用CH4/O2/H2O混合物时,*CH3O的量会更多,并且AP-XPS中的*CH3O信号与催化测试中CH3OH的选择性相关(图2C)。尽管CeO2/Cu2O/Cu(111)体系能够分解CH4(图1),但其某些位点可能太活泼以至于无法形成*CH3O。而源于水分解的OH对于阻止这些位点是至关重要的,并且还可以参与CH4活化和转化的其他反应路径。此外,作者还在实验条件下(压力比:CH4:O2 = 2:1或CH4:O2:H2O = 2:1:8;温度:450 K)进行了密度泛函理论(DFT)计算和动力学蒙特卡洛(KMC)模拟,结果与AP-XPS的测量结果完全一致。DFT结果显示CeO2/Cu2O/Cu(111)体系按照放热反应的路径进行,使得CH4/O2混合物主要生成CO2。如图3A所示,当暴露于CH4/O2时,CeO2-Cu2O/Cu(111)界面上的活性Ce位点会稳定O2(结合能Eads = -14.53 kcal/mol),并与Cu2O膜中的Cu协同作用,从而实现O-O键的断裂(反应能ΔE = -24.44 kcal/mol;活化能垒Ea = 5.54 kcal/mol)。有意思的是,CH4也优先选择相同的Ce位点,但KMC模拟表明它无法与O2竞争,因为其结合力弱(Eads = -2.54 kcal/mol)、解离能高(Ea = 11.76 kcal/mol)。也就是说,CeO2/Cu2O/Cu(111)表面上所有的活性Ce位点都被*O(源于O2解离)占据,所形成的双桥联氧Ce-O-Cu物种的吸附活性较强(Eads = -1.15 kcal / mol),并通过优先的C-O键缔合活化CH4,直接在界面处形成甲氧基(*CH3O)物种(ΔE = −37.82 kcal/mol; Ea = 18.45 kcal/mol)或*CH3OH(Ea = 16.37 kcal/mol)。然而,KMC模拟表明生成的*CH3OH不稳定,并且优先解离为*CH3O(ΔE = -14.53 kcal/mol)。另外,DFT计算显示*CH3O很可能依次脱氢生成甲醛(*CH2O)、甲酰基(*HCO),最终生成CO2。事实上,KMC快照显示在稳定状态下,将CeO2/Cu2O/Cu(111)表面暴露于CH4/O2中,并没有观察到*CH3O或其他吸附的表面物质,这表明CeO2/Cu2O/Cu(111)暴露于CH4/O2时,对CO2和CO具有很高的选择性,而不是CH3OH(图4A)。
图2. 水对CeO2/Cu2O/Cu(111)上甲氧基形成的影响。图片来源:Science 向CH4/O2中添加H2O会改变催化剂表面的反应途径。首先,H2O会阻止活性Ce位点上O2的吸附和解离(图3A)。KMC模拟表明源于水分解的羟基(*OH)占据了90%的活性Ce位点,只有10%形成了Ce-O-Cu物种。其次,H2O在界面处的Ce位点解离成活性*OH,促进CH4→CH3OH的直接转换(图3B)。也就是说,这一转化基本上由Ce位点上活性*OH通过C-O键缔合和C-H解离(ΔE = -18.68 kcal/mol;Ea = 22.37 kcal/mol)进行。该步骤代表了该路径的决速步,势垒的负位移为2.31 kcal/mol,可将CH4的转化率提高至93.79%,CH3OH的选择性提高3.78%。最后,H2O还可以促进*CH3O氢化为CH3OH,并易于从表面转移到气相中(图3C),即通过氢键形成*CH3O•••HOH,促进质子从H2O向*CH3O的跃迁(ΔE = 4.85 kcal/mol;Ea = 6.69 kcal/mol)并阻止*CH3O脱氢。
图3. DFT计算的在CeO2/Cu2O/Cu(111)上O2和H2O氧化CH4涉及的三个重要步骤的势能图。图片来源:Science KMC模拟显示,当CH4被O2和H2O氧化后,在CeO2/Cu2O/Cu(111)表面形成了两个稳定的物质*OH和*CH3O(图4B),并且表面上存在的*OH数量远大于*CH3O,从而可以防止*CH3O物种被完全氧化。其中*OH的形成与H2O和CH4的解离有关,而*CH3O的形成是由于*CH3OH的O-H键裂解与H2O从*CH3O中活化提取CH3OH的相互作用(图3C)。根据KMC模拟,通过向CH4/O2混合物中添加H2O可以使主产物由CO2变为CH3OH(图4A),从而调节了CeO2/Cu2O/Cu(111)的选择性。
图4. KMC模拟的产物选择性和反应中间体。图片来源:Science 总结 本文解释了活性催化剂CeO2/Cu2O/Cu(111)高选择性地生产CH3OH(〜70%)的相关机理,研究表明水是该反应的关键,在该反应过程中可发挥三项基本作用:通过破坏一个碳氢键并提供一个-OH基团将CH3转化为甲醇来活化CH4;阻断可能将甲烷和甲醇转化为 CO和CO2的反应位点;促进表面上形成的甲醇向气相中转移。相关成果对于指导甲烷选择性氧化制甲醇催化剂的设计有着重要意义。 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):
Water-promoted interfacial pathways in methane oxidation to methanol on a CeO2-Cu2O catalyst Zongyuan Liu, Erwei Huang, Ivan Orozco, Wenjie Liao, Robert M. Palomino, Ning Rui, Thomas Duchon, Slavomir Nemšák, David C. Grinter, Mausumi Mahapatra, Ping Liu, José A. Rodriguez, Sanjaya D. Senanayake Science, 2020, 368, 513-517, DOI: 10.1126/science.aba5005 参考文献: 1. Water is Key in Catalytic Conversion of Methane to Methanol https://www.bnl.gov/newsroom/news.php?a=117178 如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载! 点击分享 收藏 取消收藏 评论: 0 |
【本文地址】