| 一种化学修饰的甘油 | 您所在的位置:网站首页 › 甘油制作方法 › 一种化学修饰的甘油 |
一种化学修饰的甘油
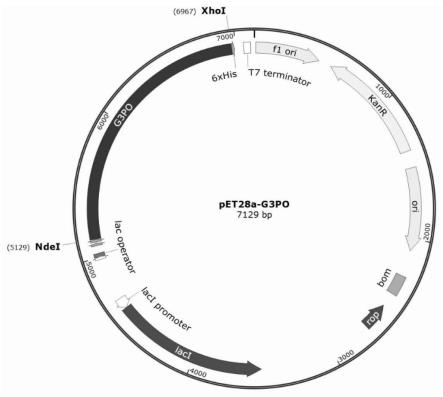 1.本发明涉及一种化学修饰的甘油-3-磷酸氧化酶及其应用,属于诊断用酶技术领域。 背景技术: 2.甘油-3-磷酸氧化酶,即glycerol-3-phosphate oxidase(g3po),是临床检测血清中甘油三酯含量的重要酶原料,测定血清中的甘油三酯含量可为临床诊断疾病提供依据。3.甘油三酯(tg)是脂质的组成成分,是甘油分子中的3个羟基被脂肪酸酯化而形成。它在人体血脂检测和监控中具有重要的临床意义,根据《中国成人血脂异常防控指南(2016年修订版)》的划分标准:空腹甘油三酯《1.7mmol/l(或150mg/dl)为合适水平;≥1.7mmol/l(或150mg/dl)且《2.3mmol/l(或200mg/dl)为边缘升高;≥2.3mmol/l(或200mg/dl)为升高。甘油三酯水平轻度至中度升高会增加患冠心病的危险性,同时甘油三酯升高可见于肥胖、糖尿病、肾功能衰竭、肝脏疾病、甲状腺功能减退症、脂肪萎缩症、骨髓瘤、多囊卵巢综合征等疾病,因此当其升高时应及时采取对应的治疗措施如控制饮食或药物治疗。4.血清中甘油三酯的测定方法有化学法和酶法,但化学法由于特异性差、手续复杂等因素而被市场所淘汰,目前临床上检测tg的方法主要是酶法。酶法检测tg主要包括以下几个基本反应步骤:血清中的甘油三酯经脂蛋白酯酶(lipoprotein lipase,lpl)水解成甘油和3个游离脂肪酸(free fatty acid,ffa);甘油在atp和甘油激酶(glycerokinase,gk)的作用下生成3-磷酸甘油和adp;3-磷酸甘油再在甘油-3-磷酸氧化酶(glycerol-3-phosphate oxidase,g3po)的作用下进一步反应,被氧气氧化生成磷酸二羟丙酮和过氧化氢(h2o2);过氧化氢在过氧化物酶(peroxidase,pod)的催化下又与4-氨基安替比林(4-aap)和色原(如n-乙基-n-(2-羟基-3-磺丙基)-3-甲基苯胺钠盐(toos))发生trinder反应,生成红色醌亚胺化合物,其显色程度与tg的浓度呈正比,反应生成的醌亚胺化合物的量可用紫外分光光度计在555nm检测。反应原理如下:[0005][0006][0007][0008][0009]有文献报道,g3po催化甘油-3-磷酸氧化生成h2o2的反应是甘油三酯检测过程的限速步骤,该酶的热稳定性很大程度上影响着酶法测定的结果。野生型g3po在检测试剂(水溶液)中稳定性较差,在46℃水浴30min就会失去大部分活性,不适合应用到自动生化分析仪上检测甘油三酯。根据市场调研,目前市售的热稳定性较好的g3po产品比较少,这些产品在46℃水浴30min后能保留50%以上的活性,而野生型g3po的热稳定性达不到这个程度。[0010]因此,为了满足市场对热稳定性好的甘油-3-磷酸氧化酶的需求,本领域迫切需要研究开发新的g3po生产技术,以期获得在水溶液中稳定性好的甘油-3-磷酸氧化酶。 技术实现要素: [0011]本发明所要解决的技术问题是,解决上述现有技术的不足,提供一种在水溶液中热稳定性好的甘油-3-磷酸氧化酶(g3po)的制备方法及应用该方法修饰的酶,使其利于在甘油三酯检测试剂中的应用。[0012]本发明提供了一种热稳定性提高的甘油-3-磷酸氧化酶改性酶,该酶在k3、k7、k10、k17、k45、k135、k212、k225、k248、k267、k486、k523、k573、k595中一个或多个位点的赖氨酸发生了修饰改性;所述修饰改性是指赖氨酸的ε-氨基与含羧基或酯基的化合物发生酰胺化交联。[0013]在一种实施方式中,所述ε-氨基的修饰率≥40.3%,或≥63.6%,或≥64.7%,或≥68.5%,或≥71.6%,或≥72.4%,或≥73.5%,或≥76.9%,或≥86.3%。[0014]在一种实施方式中,所述化合物包括但不限于大分子修饰剂或小分子修饰剂。[0015]在一种实施方式中,所述大分子修饰剂包括但不限于右旋糖苷、牛血清白蛋白(bsa)、甲氧基peg活性酯(mpeg-nhs)、聚丙烯酸(pa)。[0016]在一种实施方式中,所述小分子修饰剂包括但不限于均苯四甲酸酐(pmda)、丁二酸酐(saa)或丁二酸钠。[0017]在一种实施方式中,所述甘油-3-磷酸氧化酶来源于绿色气球菌(aerococcus viridans),具有seq id no.1所示的氨基酸序列。[0018]本发明还提供了一种提高甘油-3-磷酸氧化酶热稳定性的方法,所述方法是用含羧基或酯基的化合物与甘油-3-磷酸氧化酶氨基酸序列中一个或多个赖氨酸的ε-氨基发生交联,形成具有酰胺基的修饰改性酶。[0019]在一种实施方式中,所述赖氨酸是位于甘油-3-磷酸氧化酶氨基酸序列中第3位、第7位、第10位、第17位、第45位、第135位、第212位、第225位、第248位、第267位、第486位、第523位、第573位、第595位中的一个或多个赖氨酸。[0020]本发明还提供了一种制备所述热稳定性提高的甘油-3-磷酸氧化酶改性酶的方法,所述方法是用含羧基或酯基的化合物对甘油-3-磷酸氧化酶在k3、k7、k10、k17、k45、k135、k212、k225、k248、k267、k486、k523、k573、k595中一个或多个位点的赖氨酸进行修饰改性;所述改性是将含羧基或酯基的化合物与所述赖氨酸的ε-氨基进行酰胺化交联。[0021]在一种实施方式中,所述方法是利用高碘酸钠将右旋糖酐(dextran,平均分子量40000)醛基化后,将形成的醛基再与所述赖氨酸的ε-氨基共价结合生成改性酶。[0022]在一种实施方式中,所述方法是利用高碘酸钠将右旋糖酐(dextran,平均分子量40000)醛基化后,再增加一个连接臂6-氨基己酸使右旋糖酐羧基化,将形成的羧基化合物再在交联剂的作用下与所述赖氨酸的ε-氨基进行偶联生成改性酶。[0023]在一种实施方式中,所述方法是利用均苯四甲酸酐或丁二酸酐对右旋糖酐(dextran,平均分子量100000)进行羧基化,将形成的羧基化合物再在交联剂的作用下与所述赖氨酸的ε-氨基进行交联生成改性酶。[0024]在一种实施方式中,所述方法是利用交联剂的作用将bsa分子上的羧基与所述赖氨酸的ε-氨基进行交联生成改性酶。[0025]在一种实施方式中,所述方法是利用活性酯修饰法以mpeg-nhs为修饰剂修饰g3po。[0026]在一种实施方式中,所述方法是将pa上的羧基先与edc反应生成中间体,sulfo-nhs再与中间体反应生成酯,再与所述赖氨酸的ε-氨基反应生成酰胺,形成改性酶。[0027]在一种实施方式中,所述方法是首先将小分子化合物如pmda、saa、丁二酸钠等水解后,再先后加入edc和sulfo-nhs进行反应生成酯,生成的酯再与所述赖氨酸的ε-氨基反应生成酰胺,形成改性酶。[0028]在一种实施方式中,所述甘油-3-磷酸氧化酶来源于绿色气球菌(aerococcus viridans),具有seq id no.1所示的氨基酸序列。[0029]在一种实施方式中,所述甘油-3-磷酸氧化酶是以pet系列质粒为表达载体,将seq id no.2所示的基因在大肠杆菌中表达获得的。[0030]在一种实施方式中,所述表达载体为pet28a质粒。[0031]在一种实施方式中,所述表达载体是将编码所述g3po的基因连接至pet28a质粒的ndei和xhoi之间构建获得的。[0032]在一种实施方式中,所述大肠杆菌为e.coli bl21(de3)。[0033]在一种实施方式中,所述大肠杆菌表达的甘油-3-磷酸氧化酶还经过纯化处理。[0034]本发明还要求保护所述甘油-3-磷酸氧化酶改性酶在血清甘油三酯含量测定方面的应用。[0035]在一种实施方式中,所述应用包括但不限于作为参与血清甘油三酯含量测定的试剂,或制备用于测定血清甘油三酯含量的产品。[0036]有益效果:[0037](1)本发明通过化学修饰手段成功提高了g3po的热稳定性。46℃处理30min后,酶活保留率可达70%以上。[0038](2)本发明获得的g3po,热稳定性好,可以提高其在水溶液中的热稳定性,有利于在甘油三酯检测试剂中的应用。[0039](3)本发明基于相同的原理,通过不同化合物实现了修饰后的酶的热稳定性提高,具体包括:[0040]本发明的一种实施方式中,利用高碘酸钠将右旋糖酐醛基化后,再将右旋糖酐羧基化,再将形成的羧基化合物在交联剂的作用下与g3po表面的氨基进行偶联生成改性酶,修饰后的g3po酶活回收率为75.9%,并且46℃处理30min后酶活保留率为42.1%;[0041]本发明的一种实施方式中,利用均苯四甲酸酐或丁二酸酐对右旋糖酐进行羧基化,再将形成的羧基化合物在交联剂的作用下与g3po表面的氨基进行交联生成改性酶,修饰后的g3po酶活回收率分别为74.1%、83.8%,并且46℃处理30min后酶活保留率分别为67.7%、70.8%;[0042]本发明的一种实施方式中,在交联剂的作用下将bsa分子上的羧基与g3po分子上的氨基进行交联,形成改性酶,修饰后的g3po酶活回收率为90.4%,并且46℃处理30min后酶活保留率为50.2%;[0043]本发明的一种实施方式中,以mpeg-nhs为修饰剂修饰g3po,修饰后的g3po酶活回收率为76.1%,并且46℃处理30min后酶活保留率为63.2%;[0044]本发明的一种实施方式中,将pa上的羧基先与edc和sulfo-nhs反应生成中间体酯,再与g3po上的氨基反应生成酰胺,形成改性酶,修饰后的g3po酶活回收率为82.5%,并且46℃处理30min后酶活保留率为78.7%;[0045]本发明的一种实施方式中,将小分子化合物如pmda、saa、丁二酸钠等水解后,再先后加入edc和sulfo-nhs反应生成酯,再与g3po上的氨基反应生成酰胺,形成改性酶,修饰后的g3po酶活回收率为65%~81%,46℃处理30min后酶活保留率为60%~75%。附图说明[0046]图1:甘油-3-磷酸氧化酶g3po重组表达载体示意图;[0047]图2:高碘酸钠氧化法活化右旋糖酐40及酶的修饰;[0048]图3:右旋糖酐40修饰g3po的sds-page图;泳道m:蛋白marker;泳道1:intact g3po;泳道2:dextran-g3po‑ⅰ;[0049]图4:右旋糖酐40的羧基化及酶的修饰;[0050]图5:右旋糖酐40修饰g3po的sds-page图;泳道1:dextran-g3po‑ⅱ;泳道2:intact g3po;泳道m:蛋白marker;[0051]图6:右旋糖酐100的羧基化及酶的修饰;[0052]图7:右旋糖酐100的羧基化及酶的修饰;[0053]图8:右旋糖酐100修饰g3po的sds-page图;泳道1:pmda-dextran-g3po;泳道2:saa-dextran-g3po;泳道m:蛋白marker;[0054]图9:bsa修饰剂修饰酶分子;[0055]图10:bsa修饰g3po的sds-page图;泳道1:bsa-g3po;泳道2:intact g3po;泳道m:蛋白marker;[0056]图11:大分子修饰剂mpeg-nhs修饰酶分子;[0057]图12:mpeg-nhs修饰g3po的sds-page图;泳道1:mpeg-nhs-g3po;泳道2:intact g3po;泳道m:蛋白marker;[0058]图13:pa修饰g3po的sds-page图;泳道1:intact g3po;泳道2:pa-g3po;泳道m:蛋白marker;[0059]图14:小分子化合物修饰g3po;[0060]图15:小分子化合物修饰g3po的sds-page图;泳道1:pmda-g3po;泳道2和3:intact g3po;泳道4:saa-g3po;泳道5:ss-g3po;泳道m:蛋白marker。具体实施方式[0061]技术术语[0062]甘油-3-磷酸氧化酶:本发明所提及的“甘油-3-磷酸氧化酶”(glycerol-3-phosphate oxidase,g3po)是指如酶命名法所定义的ec 1.1.3.21类中的酶。在本发明的一些实施方式中,所述甘油-3-磷酸氧化酶是将来源于绿色气球菌(aerococcus viridans)的甘油-3-磷酸氧化酶利用基因工程手段在动物细胞或微生物细胞中表达获得的,或是从野生型绿色气球菌的细胞培养液中分离提取获得的。采用基因工程手段表达甘油-3-磷酸氧化酶的外源表达系统包括但不限于大肠杆菌表达系统、枯草芽孢杆菌表达系统、昆虫细胞表达系统、哺乳动物细胞表达系统或酵母表达系统。[0063]改性修饰:利用含有某种化学基团(例如醛基、羧基、酯基)的某一化合物作为修饰剂对g3po上的某一/某些赖氨酸的ε-氨基进行修饰,其反应机理是:在碱性条件下,将修饰剂上的醛基直接与g3po上的某一/某些赖氨酸的ε-氨基发生共价修饰生成修饰酶;或者,通过某一/某些交联剂的作用,使带有羧基基团的某一化合物形成中间体酯,再与g3po上的某一/某些赖氨酸的ε-氨基发生偶联反应,形成修饰酶;或者,利用活性酯修饰法,即利用酯类化合物在弱碱性(ph 7-7.5)条件下直接与g3po上的某一/某些赖氨酸的ε-氨基发生缩合反应,生成修饰酶。[0064]根据上述所述反应机理,本发明的改性修饰可以包括:将右旋糖酐40进行醛基化,再与g3po上的某一/某些赖氨酸的ε-氨基发生共价结合,形成g3po改性酶,反应流程如图2所示;或者,将右旋糖酐40或右旋糖酐100进行羧基化,再在交联剂edc和sulfo-nhs的作用下形成中间体酯,然后进一步与g3po上的某一/某些赖氨酸的ε-氨基发生共价偶联,生成g3po改性酶,反应流程如图4、图6、图7所示;或者,在水溶液中,直接将含有羧基的某一化合物先与交联剂edc和sulfo-nhs发生反应生成中间体酯,再进一步与g3po上的某一/某些赖氨酸的ε-氨基发生共价偶联,生成g3po改性酶;所述某一化合物包括牛血清白蛋白、聚丙烯酸、均苯四甲酸酐、丁二酸酐、丁二酸钠,反应流程如图9、图14所示;或者,利用甲氧基peg活性酯(mpeg-nhs)直接与g3po上的某一/某些赖氨酸的ε-氨基发生缩合反应,生成g3po改性酶,如图11所示。[0065]改性酶:本发明所提及的“改性酶”(或“修饰酶”)是指通过各种方法(例如本发明所提供的改性修饰方法)使甘油-3-磷酸氧化酶的催化特性和/或稳定性(包括但不限于热稳定性、ph稳定性)得以改进后的仍具有甘油-3-磷酸氧化酶的催化功能的酶。[0066]甘油-3-磷酸氧化酶酶活及相关定义:[0067]酶活性单位定义:在下述具体实施方式所述的酶活测定条件下,每分钟消耗1μmol甘油-3-磷酸所需的酶量定义为一个酶活单位(u)。[0068]比酶活:比酶活定义为每毫克酶蛋白所具有的活力单位,单位以u/mg表示。酶活回收率:酶修饰后的比酶活和酶修饰前的比酶活的比例,即酶活回收率=修饰后的比酶活/修饰前的比酶活×100%。[0069]酶活回收率:g3po化学修饰后的比酶活与化学修饰前的比酶活的比;例如,化学修饰前的g3po(即intact g3po)的比酶活为75.3u/mg,经实施例2所述方法修饰后的g3po(即dextran-g3po‑ⅰ)的比酶活为24.9u/mg,则修饰后g3po的酶活回收率为24.9÷75.3×100%=33.1%。[0070]酶活保留率:热处理后的比酶活与热处理前的比酶活之比,即酶活保留率=热处理后的比酶活/热处理前的比酶活×100%。在本发明的一些实施方式中,所述酶活保留率是指g3po在46℃孵育30min后的比酶活与46℃孵育0min时的比酶活的比;例如:intact g3po在46℃孵育0min时的比酶活为75.3u/mg,经46℃孵育30min后的比酶活为12.3u/mg,则热处理后g3po的酶活保留率为12.3÷75.3×100%=16.3%。[0071]g3po改性酶修饰率的测定:[0072](1)试剂准备:[0073]0.1g/l tnbs溶液:称取2,4,6-三硝基苯磺酸(tnbs)0.01g,溶解于50ml蒸馏水中,混合均匀,用蒸馏水定容至100ml;[0074]1mol/l的盐酸:精确量取9ml盐酸,加蒸馏水定容至100ml,混合均匀;[0075]酶稀释液:ph 7.5、20mmol/l磷酸盐缓冲液(ph 7.5、20mmol/l pbs buffer)。[0076](2)待测样品的制备[0077]用酶稀释液将待测酶液稀释至蛋白浓度为1mg/ml,即为待测样品。[0078](3)测定修饰率的具体步骤[0079]采用2,4,6-三硝基苯磺酸(tnbs)法测定g3po的氨基修饰率。2,4,6-三硝基苯磺酸能够与g3po表面的赖氨酸(k3,k7,k10,k17,k45,k135,k212,k225,k248,k267,k486,k523,k573,k595)ε-氨基发生反应,该反应生成的三硝基苯衍生物在420nm处有特殊吸收峰,通过该反应可以计算出g3po的自由氨基数目,从而根据化学修饰前后的自由氨基变化可以计算出g3po改性酶的修饰率。空白组:取2.0ml的0.1g/l tnbs至3.0ml超纯水中,混合均匀后,室温放置40min,再加入1mol/l的盐酸0.5ml终止反应,420nm处测定吸光度值并进行校零;野生型酶组:取2.0ml的0.1g/l tnbs至3.0ml野生型酶中,混合均匀后,室温放置40min,再加入1mol/l的盐酸0.5ml终止反应,420nm处测定吸光度值a0;改性酶组:取2.0ml的0.1g/l tnbs至3.0ml改性酶中,混合均匀后,室温放置40min,再加入1mol/l的盐酸0.5ml终止反应,420nm处测定吸光度值a1。[0080]g3po改性酶修饰率计算公式:[0081][0082]g3po的酶活测定方法:[0083](1)g3po酶活测定的试剂准备:[0084]试剂i:0.2mol/lα-甘油磷酸二钠水合物:取80ml 0.125mol/l,ph 8.0tris-hcl,加入终浓度为0.125%的triton x-100,加入4.32gα-甘油磷酸二钠水合物,溶解,用盐酸调节ph至8.1,双蒸水定容至100ml;[0085]试剂ii:50mmol/l 4-aap;[0086]试剂iii:1ku/ml pod;[0087]试剂iv:50mmol/l toos;[0088]按照下表1配制反应混合物:[0089]表1反应混合物配制体系[0090]试剂i50ml试剂ii1.5ml试剂iii0.5ml试剂iv1.5ml双蒸水定容至100ml总体积100ml[0091]酶稀释液:20mmol/l tris-hcl缓冲液,ph 7.5,含0.2%bsa;[0092](2)待测样品的制备:[0093]用酶稀释液将待测酶液稀释至0.15-0.35u/ml,即为待测样品。[0094](3)g3po的酶活测定步骤:[0095]1.将反应混合物置于37℃水浴锅中预热;[0096]2.在1.0ml比色皿中加入1.0ml反应混合物;[0097]3.加入0.02ml待测样品,混匀;[0098]4.用分光光度计在波长为555nm下测定待测样品1min内的吸光度变化(δas);[0099]5.用0.02ml酶稀释液代替上述步骤3中0.02ml待测样品,其它操作步骤与上述所述[0100]步骤1、2、4相同,记录空白的吸光度变化(δab),则δa=δas-δab。[0101](4)g3po酶活计算公式为:[0102][0103]weight activity(u/mg)=volume activity×1/c[0104]其中,1.02:反应液总体积(ml);0.02:酶液体积(ml);1.0:光路长度(cm);df:稀释倍数;1/2:1mol过氧化氢生成1/2mol醌亚胺染料;c:酶浓度(mg/ml);39.2:标准反应条件下,发色基团在555nm处摩尔吸光系数(cm2/μmol)。[0105]sds-page凝胶电泳法分析:[0106]酶分子被大分子修饰剂成功修饰后其分子量会明显增大,可由sds-page凝胶电泳法判断g3po是否被化学修饰。野生型g3po的分子量约为72kd,被大分子修饰剂修饰后的g3po分子量一定会明显增大(即>72kd),由此初步确定g3po被成功修饰。而小分子修饰剂的分子量远远小于酶分子,经过小分子化合物修饰的g3po的分子量不会明显变化,通过sds-page凝胶电泳法无法直接判断是否成功修饰,需要进一步通过热稳定性研究判定。[0107]g3po热稳定性检测:[0108]分别取1ml intact g3po和不同实施方式下制备获得的g3po改性酶于2ml离心管中,46℃孵育不同时间,然后快速将其冷却,即得46℃孵育后样品。根据前述g3po酶活测定方法测定g3po 46℃孵育前后的比酶活,并比较野生型g3po(命名为:intact g3po)与不同实施方式下制备获得的g3po改性酶的热稳定性。[0109]甘油三酯的含量检测方法:[0110](1)甘油三酯的含量检测原理:[0111]甘油三酯的含量检测原理如上述背景技术所述,通过检测反应生成的醌亚胺化合物在555nm下的吸光度变化可计算出血清中甘油三酯的含量。[0112](2)检测试剂准备:[0113]试剂i:血清样本:取新鲜小鼠血液,在25℃条件下静置30min使血液凝结,4℃,2000×g离心20min,取上层淡黄色澄清液体即为血清。血清置于冰上待测,若不能当天检测,于-80℃保存,可保存1个月;[0114]试剂ii:标准品:购买的甘油三酯标准品浓度为2.26mmol/l;[0115]试剂iii:100mmol/l mes缓冲液,ph 6.5:将9.76g吗啉乙磺酸(mes)溶解在800ml双蒸水中,用naoh调节ph至6.5,再用双蒸水定容至1l;[0116]试剂iv:酶工作液:按照表2依次加入如下试剂配制100ml试剂iv:[0117]表2试剂iv组分[0118]试剂iii50ml5%triton x-1002ml50mmol/l toos(色原)3ml50mmol/l 4-aap3mlatp·na2·3h2o12.1mgmgcl2·6h2o20.35mg300u/ml脂蛋白酯酶(lpl)1.0ml200u/ml甘油激酶(gk)0.5ml甘油-3-磷酸氧化酶(g3po)200u1000u/ml过氧化物酶(pod)0.2ml双蒸水加双蒸水补足100ml[0119]表2所述甘油-3-磷酸氧化酶为下述实施例1制备的intact g3po或不同实施方式下制备获得的g3po改性酶。[0120](3)甘油三酯的含量检测操作步骤:[0121]1.空白组:取2.5μl双蒸水,加入到5ml离心管中;[0122]标准组:取2.5μl试剂ii(即标准品),加入到5ml离心管中;[0123]待测样本组:取2.5μl试剂i(即血清样本),加入到5ml离心管中;[0124]2.向步骤1中的各5ml离心管中加入250μl试剂iv,混匀;[0125]3.37℃孵育15min;[0126]4.用紫外分光光度计检测上述各样品在555nm处的吸光度(即od值);[0127]5.重复上述步骤1、2、3、4三次,取三次od值的平均值;其中,空白组od值的平均值记为od0,待测样本组od值的平均值记为od1;标准组od值的平均值记为od2;[0128]操作表如表3所示。[0129]表3甘油三酯含量检测操作表[0130][0131]血清中甘油三酯含量的计算公式如下:[0132][0133]其中,δa1:od1-od0;δa2:od2–od0;c:标准品的浓度,即2.26mmol/l;f:待测样本加入检测体系之前的稀释倍数;本发明的血清样本不稀释,故f为1。[0134]具体实施方式中涉及的序列[0135]aerococcus viridans来源的野生型g3po的完整蛋白具有如seq id no.1所示的氨基酸序列,所述序列中含有ε-氨基的氨基酸只有赖氨酸(k),而赖氨酸残基在所述序列中共有38个。其中,k3,k7,k10,k17,k45,k135,k212,k225,k248,k267,k486,k523,k573,k595这些位点的赖氨酸位于甘油-3-磷酸氧化酶的蛋白表面,极容易被修饰。根据这一特性,可以将酶蛋白上任一位置的ε-氨基与某些化学基团特别是具有生物相容性的大分子或者小分子进行共价连接形成改性酶,从而改变其酶学性质,以增强酶的热稳定性。[0136]根据大肠杆菌密码子偏好性优化的编码seq id no.1所示g3po的基因的核苷酸序列如seq id no.2所示。[0137]具体实施方式中涉及的培养基[0138]lb培养基(g/l):酵母浸提物5,蛋白胨10,nacl 10。[0139]实施例1野生型g3po的表达和纯化[0140]aerococcus viridans来源的野生型g3po的完整蛋白具有如seq id no.1所示的氨基酸序列,将seq id no.1所示氨基酸序列进行反转录后按照大肠杆菌密码子偏好性进行优化,得到seq id no.2所示核苷酸序列,再利用全基因合成技术合成seq id no.2所示核苷酸序列,即得野生型g3po的编码序列。[0141]将合成的seq id no.2所示的基因片段插入到pet28a载体的ndei和xhoi之间(图1所示g3po所在位置),获得重组表达质粒pet28a-g3po。将该重组表达质粒pet28a-g3po通过热击转化(或电击转化)的方式转化到e.coli bl21(de3)感受态细胞中,挑选阳性克隆子,在lb培养基中于37℃,200rpm培养过夜,获得表达野生型g3po重组表达菌株(命名为intact-g3po)。虽然本实施例以表达宿主大肠杆菌为例进行说明,但携带该基因的重组质粒的构建及基因的表达同样适用于其它微生物细胞,例如枯草芽孢杆菌、毕赤酵母等。[0142]将构建的重组表达菌株intact-g3po接种于20ml lb液体培养基(含有50μg/ml卡那霉素抗生素)的试管中,37℃培养5h至菌体浓度为od600=0.6~0.8;将培养物按1:100的比例转接于200ml lb液体培养基(含有50μg/ml卡那霉素抗生素)的锥形瓶中,37℃培养3h至菌体浓度为od600=0.6~0.8;将培养物放置于冰水浴中预冷至20℃±0.5℃,加入终浓度为0.5mm的诱导剂异丙基-β-d-硫代半乳糖苷(tptg),于20℃下诱导培养12h~16h,直至培养液中的菌体浓度为od600=4~10,收集培养物;再将培养物于4℃,8000rpm,离心10min,收集离心后的发酵液沉淀,再以0.1g/ml的菌体终浓度加入20mm tris-hcl(ph 8.0)进行重悬;重悬液使用超声波细胞破碎仪进行细胞破碎(超声破碎条件:破碎3s,间隔5s,总时间15min,功率400w);细胞破碎液于4℃,8000rpm,离心15min,收集离心后的细胞破碎上清液。经检测,表达野生型g3po的重组大肠杆菌细胞破碎上清液中的g3po活性为100~120u/ml。[0143]收集上述方法制备的含g3po的重组大肠杆菌细胞破碎上清液,过滤除杂,加入终浓度为500mm的nacl,混合均匀,得到待纯化样品。g3po纯化步骤具体如下:[0144]①制备ni亲和层析柱:用移液枪向柱子中加入适合体积ni柱填料,待填料自然沉降后,将垫片压平至与填料齐平的位置,用超纯水多次冲洗层析柱(每次洗5个柱体积,[0145]冲洗5~8次);[0146]②将ni亲和层析柱用5个柱体积的平衡buffer进行平衡;所述平衡buffer含有20mm tris-hcl,500mm nacl,ph 8.0;[0147]③向ni亲和层析柱中加入所述待纯化样品(量多可分多次加入),收集流穿液;[0148]④用5个柱体积的平衡buffer进行平衡,收集平衡液;所述平衡buffer含有20mm tris-hcl,500mm nacl,ph 8.0;[0149]⑤用10个柱体积的洗杂buffer进行洗杂,收集洗杂液;所述洗杂buffer含有20mm tris-hcl,500mm nacl,20mm咪唑,ph 8.0;[0150]⑥用5个柱体积的洗脱buffer进行洗脱,收集含目的蛋白的洗脱液;所述洗脱buffer含有20mm tris-hcl,500mm咪唑,ph 8.0;[0151]⑦用10个柱体积的洗柱buffer进行洗柱,将残留柱子上的杂蛋白全部冲洗干净;所述洗柱buffer含有500mm咪唑;[0152]⑧用5个柱体积的超纯水冲洗层析柱,洗5~8次;[0153]⑨用20%的乙醇保存ni亲和层析柱;[0154]⑩将上述步骤⑥得到的洗脱液用赛多利斯(sartorius)切向流超滤系统超滤浓缩至蛋白浓度为20mg/ml,并将蛋白所在的溶液体系置换成透析buffer,即得到蛋白浓度为20mg/ml的纯化后野生型g3po酶液,将其命名为intact g3po;所述透析buffer为ph 7.5、20mmol/l磷酸盐缓冲液(ph 7.5、20mmol/l pbs buffer)。[0155]根据上述具体实施方式所述的g3po酶活测定方法对上述步骤⑩收集到的intact g3po酶液进行检测,结果显示,intact g3po的比酶活为75.3u/mg。[0156]实施例2高碘酸钠氧化法活化右旋糖酐及g3po的化学修饰[0157]如图2所示,高碘酸钠可以将右旋糖酐上的邻双羟基氧化成醛基,醛基再与酶分子上的氨基共价结合生成改性酶。[0158]称取2.7g高碘酸钠和5g右旋糖酐40(dextran,平均分子量40000)完全溶解于100ml蒸馏水中,室温避光搅拌反应24h,滴加0.5mol/l nahso3溶液以还原过量的naio4,将滴定后的右旋糖酐用赛多利斯(sartorius)切向流超滤系统进行超滤除杂,并将右旋糖苷所在的溶液体系置换成ph 7.5、20mmol/l pbs buffer,即得活化的右旋糖酐溶液。[0159]取5ml活化后的右旋糖酐溶液与1ml实施例1制备的intact g3po,混合均匀,于4℃避光静置反应24h,用硼氢化钠中和右旋糖酐上剩余的醛基,然后将反应溶液用截留分子量为10000的透析袋在ph 7.5、20mmol/l pbs buffer(2l×3次)中透析24h,即得右旋糖酐修饰的g3po,并将其命名为dextran-g3po‑ⅰ(酶活回收率为33.1%)。经sds-page验证,确定g3po被右旋糖酐成功修饰,结果如图3所示。对改性酶的修饰效果进行检测,结果显示dextran-g3po‑ⅰ的ε-氨基修饰率为86.3%。[0160]将dextran-g3po‑ⅰ和实施例1制备的intact g3po分别在46℃的水浴锅中孵育30min,检测g3po的酶活,评价酶的热稳定性,热稳定性测定结果如表4所示。本实施例获得的改性酶dextran-g3po‑ⅰ的热稳定性相比于实施例1制备的intact g3po,在46℃孵育30min后的酶活保留率从16.3%提高到41%。[0161]表4改性酶与未修饰酶的热稳定性比较[0162][0163]实施例3羧基化右旋糖酐40修饰g3po[0164]在实施例2活化右旋糖酐的方法的基础上,对其反应过程进行改进,在酶和右旋糖苷之间增加一个连接臂,例如6-氨基己酸(如图4所示),可以避免修饰酶直接与硼氢化钠反应,减少酶的失活;所述连接臂是具有端位氨基和端位羧基的c3~c8化合物。[0165]取实施例2获得的活化右旋糖酐溶液50ml,加入9.5g 6-氨基己酸并使之完全溶解,混合均匀,室温反应24h,再加入1g硼氢化钠终止反应。反应溶液用赛多利斯(sartorius)切向流超滤系统进行超滤除杂,并将右旋糖酐所在的溶液体系置换成ph 7.5、100mmol/l 2-(n-吗啉)乙磺酸缓冲液(ph 7.5、100mmol/l mes buffer),即得羧基化的右旋糖酐溶液。[0166]取5ml羧基化的右旋糖酐溶液,向其加入100.5mg 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(简称:edc·hcl),溶解混匀,再加入227.9mg n-羟基硫代琥珀酰亚胺钠盐(简称:sulfo-nhs),溶解混匀后室温反应20min。反应结束后,用0.5mol/l碳酸钠溶液将反应液调节ph 7-7.5,再加入1ml实施例1制备的intact g3po,室温反应2h。然后,将含g3po的反应溶液用截留分子量为10000的透析袋在ph 7.5、20mmol/l pbs buffer(2l×3次)中透析24h,即得羧基化右旋糖酐修饰的g3po酶液,并将其命名为dextran-g3po‑ⅱ(酶活回收率为75.9%)。g3po修饰前后分子量大小变化情况如图5所示。对本实施例的修饰效果进行检测,结果显示,改性酶dextran-g3po‑ⅱ的ε-氨基修饰率为40.3%。[0167]参照实施例2的方法评价intact g3po和改性酶dextran-g3po‑ⅱ的热稳定性,结果如表5所示,在酶和右旋糖酐之间增加一个连接臂可以在化学修饰过程中降低酶活的损失,获得较高活性的g3po改性酶,但本实施例获得的dextran-g3po‑ⅱ的酶活保留率也只有42.1%,与实施例2获得的dextran-g3po‑ⅰ相当,说明增加连接臂能明显提高g3po酶活回收率,但对促进热稳定性的提高不明显。[0168]表5改性酶与未修饰酶的热稳定性比较[0169][0170]实施例4右旋糖酐100的活化及g3po的化学修饰[0171]本实施例使用均苯四甲酸酐(pmda)和丁二酸酐(saa)分别对右旋糖酐进行活化,其流程分别如图6、图7所示。[0172]称取5g右旋糖酐100(dextran,平均分子量100000),溶于30ml无水二甲亚砜(dmso)中,再分别加入pmda 2.748g(或saa 1.26g)、4-二甲氨基吡啶(mdap)1g,在60℃下反应24h。反应产物用赛多利斯(sartorius)切向流超滤系统进行超滤除杂,并将右旋糖酐所在的溶液体系置换成ph 7.5、100mmol/l mes buffer,即得pmda活化的右旋糖酐溶液(命名为pmda-dextran 100)或saa活化的右旋糖酐溶液(命名为saa-dextran 100)。[0173]取5ml pmda-dextran 100(或5ml saa-dextran 100),按顺序依次加入1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc·hcl)100.5mg、sulfo-nhs 227.9mg,溶解混合,在室温下反应20min。然后,用0.5mol/l碳酸钠溶液将反应液调节ph 7-7.5,再向其加入1ml实施例1获得的野生型g3po酶液,室温反应2h。最后,将含g3po的反应溶液用截留分子量为10000的透析袋在ph 7.5、20mmol/l pbs buffer(2l×3次)中透析24h,即得pmda-dextran 100修饰的g3po或saa-dextran 100修饰的g3po,分别命名为pmda-dextran-g3po或saa-dextran-g3po,酶活回收率分别为74.1%、83.8%。g3po修饰前后分子量大小变化情况如图8所示。经检测,pmda-dextran-g3po的ε-氨基修饰率为64.7%,saa-dextran-g3po的ε-氨基修饰率为71.6%。[0174]参照实施例2的方法评价pmda-dextran-g3po和saa-dextran-g3po的热稳定性。由表6可知,本实施例的g3po修饰方法,能在保证酶活回收率的同时显著提高g3po的热稳定性,pmda-dextran-g3po在46℃孵育30min后酶活保留率为67.7%,saa-dextran-g3po在46℃孵育30min后酶活保留率为70.8%,而野生型酶intact g3po在46℃孵育30min后酶活保留率仅16.3%。[0175]表6改性酶与未修饰酶的热稳定性比较孵育温度(℃)[0176][0177]实施例5牛血清白蛋白修饰g3po[0178]牛血清白蛋白(bsa)具有较大的分子量(分子量约68kd),用bsa修饰酶的过程如图9所示,具体步骤如下:[0179]称取bsa 213.9mg并溶于1ml 100mmol/l mes buffer(ph 7.5)中,再分别按顺序依次加入edc·hcl 60.3mg、sulfo-nhs 136.7mg,室温反应20min,然后用0.5mol/l碳酸钠溶液将反应液调节ph 7-7.5。取0.5ml反应液于2ml离心管中,加入100μl实施例1制备的intact g3po,混合均匀,室温反应2h,然后将其反应溶液用截留分子量为10000的透析袋在ph 7.5、20mmol/l pbs buffer(2l×3次)中透析24h,即得bsa修饰的g3po酶液,并将其命名为bsa-g3po。经测定,bsa-g3po酶活回收率为90.4%,ε-氨基修饰率为68.5%,分子量大小变化情况如图10所示。[0180]参照实施例2的方法,比较intact g3po与bsa-g3po的热稳定性。如表7所示,g3po通过bsa修饰后热稳定性有了明显的改善,与intact g3po相比,bsa-g3po的酶活保留率提高了33.9%。[0181]表7改性酶与未修饰酶的热稳定性比较[0182][0183]实施例6 mpeg-nhs修饰g3po[0184]活性酯修饰法具有反应条件温和,可避免活泼的双功能交联剂直接与酶接触所产生的酶失活,减少副反应发生等优势。以甲氧基peg活性酯(mpeg-nhs)为例,用活性酯法修饰g3po,其修饰反应如图11所示。[0185]称取mpeg-nhs(平均分子量40000)33.35mg溶于500μl 20mm pbs buffer(ph 7.5)中,加入100μl实施例1制备的intact g3po,混合均匀,用20mm pbs buffer(ph 7.5)补足1ml,然后在室温下反应2h。将反应溶液用截留分子量为10000的透析袋在ph 7.5、20mmol/l pbs buffer(2l×3次)中透析24h,即得mpeg-nhs修饰的g3po酶液,并将其命名为mpeg-nhs-g3po。经检测,mpeg-nhs-g3po的酶活回收率为76.1%,其ε-氨基修饰率为63.6%,修饰前后分子量大小变化情况如图12所示。[0186]参照实施例2的方法,比较intact g3po与mpeg-nhs-g3po的热稳定性,结果如表8所示。本实施例的mpeg-nhs-g3po与野生型g3po相比,酶活保留率提高了46.9%。[0187]表8改性酶与未修饰酶的热稳定性比较[0188][0189]实施例7聚丙烯酸修饰g3po[0190]以聚丙烯酸(pa,分子量约450000)作为修饰剂进行g3po的化学修饰,反应机理与实施例5的bsa修饰类似,即在交联剂的作用下pa的羧基与酶分子上的氨基发生交联反应。[0191]具体步骤为:称取pa 5mg并溶于1ml ph 7.5、100mmol/l mes buffer中,再依次加入edc.hcl 13.3mg、sulfo-nhs 30.2mg,混合均匀,室温反应20min,然后用0.5mol/l碳酸钠溶液将反应溶液调节ph 7-7.5。取0.2ml反应溶液于2ml离心管中,加入100μl实施例1制备的intact g3po,混合后室温反应2h,然后将其反应溶液用截留分子量为10000的透析袋在ph 7.5、20mmol/l pbs buffer(2l×3次)中透析24h,即得pa修饰的g3po酶液,并将其命名为pa-g3po,酶活回收率为82.5%。g3po修饰前后分子量大小变化情况如图13所示,经检测,pa-g3po的ε-氨基修饰率为76.9%。[0192]参照实施例2的方法,比较intact g3po与pa-g3po的热稳定性,pa修饰后的g3po热稳定性如表9所示。与野生型g3po相比,pa-g3po的热稳定性显著提高,酶活保留率可达78.7%。[0193]表9改性酶与未修饰酶的热稳定性比较[0194][0195]实施例8小分子化合物修饰g3po[0196]本发明利用某些含有单个羧基基团且不含氨基的小分子化合物来修饰g3po。本实施方式以均苯四甲酸酐、丁二酸酐和丁二酸钠三种小分子化合物为修饰剂对g3po进行化学修饰,其反应机理与bsa修饰g3po类似,即小分子化合物上的羧基在交联剂的作用下与酶分子上的氨基发生交联反应,反应流程如图14所示。[0197]首先称取均苯四甲酸酐68.6mg(或丁二酸酐32mg,或丁二酸钠51.82mg)并用500μl蒸馏水进行溶解,然后加入500μl浓度为100mmol/l、ph 7.5的mes buffer,依次加入edc.hcl 60.3mg、sulfo-nhs 136.7mg,溶解混合均匀,室温反应20min,然后用0.5mol/l碳酸钠溶液将反应溶液调节ph 7-7.5。取0.5ml反应溶液于2ml离心管中,加入100μl实施例1制备的intact g3po,混合后室温反应2h,然后将其反应溶液用截留分子量为10000的透析袋在ph 7.5、20mmol/l pbs buffer(2l×3次)中透析24h,即得小分子化合物均苯四甲酸酐(或丁二酸酐,或丁二酸钠)修饰的g3po酶液,并将其命名为pmda-g3po(或saa-g3po,或ss-g3po)。经均苯四甲酸酐修饰的pmda-g3po酶活回收率为68.1%,ε-氨基修饰率为63.6%;经丁二酸酐修饰的saa-g3po酶活回收率为80.3%,ε-氨基修饰率为72.4%;经丁二酸钠修饰的ss-g3po酶活回收率为72.8%,ε-氨基修饰率为73.5%。小分子化合物修饰的g3po分子量大小如图15所示,pmda、saa或ss修饰后的g3po的分子量大小没有明显改变。[0198]参照实施例2的方法,比较intact g3po与小分子化合物修饰后的g3po的热稳定性,结果如表10所示。与野生型酶intact g3po相比,pmda-g3po、saa-g3po和ss-g3po的热稳定性都有不同程度的提高,酶活保留率分别为62%、72.6%、68.8%。[0199]表10改性酶与未修饰酶的热稳定性比较[0200][0201]实施例9甘油-3-磷酸氧化酶改性酶在甘油三酯含量检测中的应用[0202]按照上述具体实施方式所述的甘油三酯的含量检测方法,用实施例1制备的intact g3po或不同实施方式下制备获得的g3po改性酶来检测血清中的甘油三酯含量,以市售的甘油-3-磷酸氧化酶(市售g3po)为对照,结果如表11所示。分别将实施例2~8制备的甘油-3-磷酸氧化酶改性酶用于甘油三酯含量的检测,结果显示,与出发酶(实施例1制备的intact g3po)相比,在保证较高酶活回收率的情况下,通过不同实施方式制备获得的g3po改性酶(实施例2~8制备的甘油-3-磷酸氧化酶改性酶)可以用于甘油三酯的含量检测,且检测准确性满足甘油三酯的医学检测要求。[0203]表11甘油三酯的含量检测[0204][0205]虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。 |
【本文地址】