| 【物理定律】热力学第零、一、二、三定律 | 您所在的位置:网站首页 › 热力学第一定律的q的含义 › 【物理定律】热力学第零、一、二、三定律 |
【物理定律】热力学第零、一、二、三定律
|
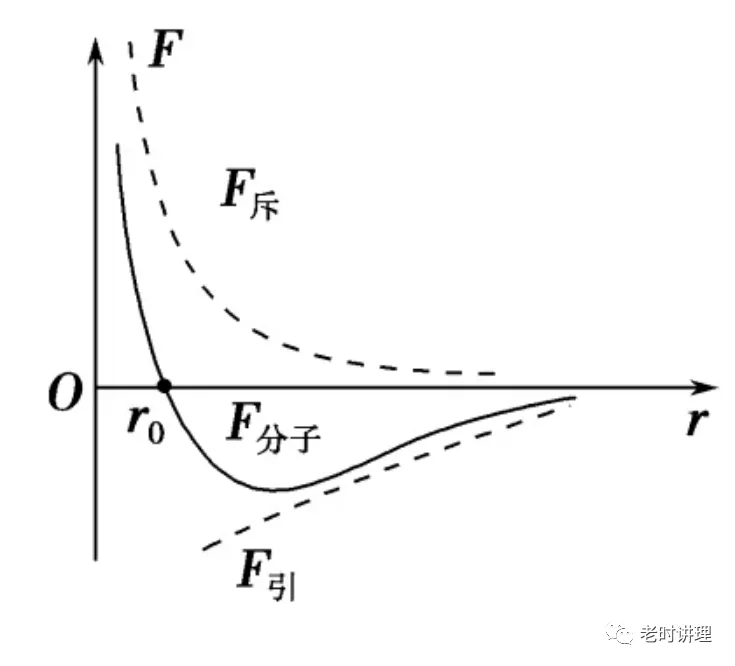
其中,Pi是第 i个系统的压力,Vi是第 i个系统的体积, Ni是第 i个系统的摩尔数或原子数目。 这样,温度相同时PV/N为一常数,故可引入常数R来定义温度T,使得 PV/N=RT。这样,这种系统可作为温度计较准其他系统,此即为理想气体温度计。
热力学第一定律
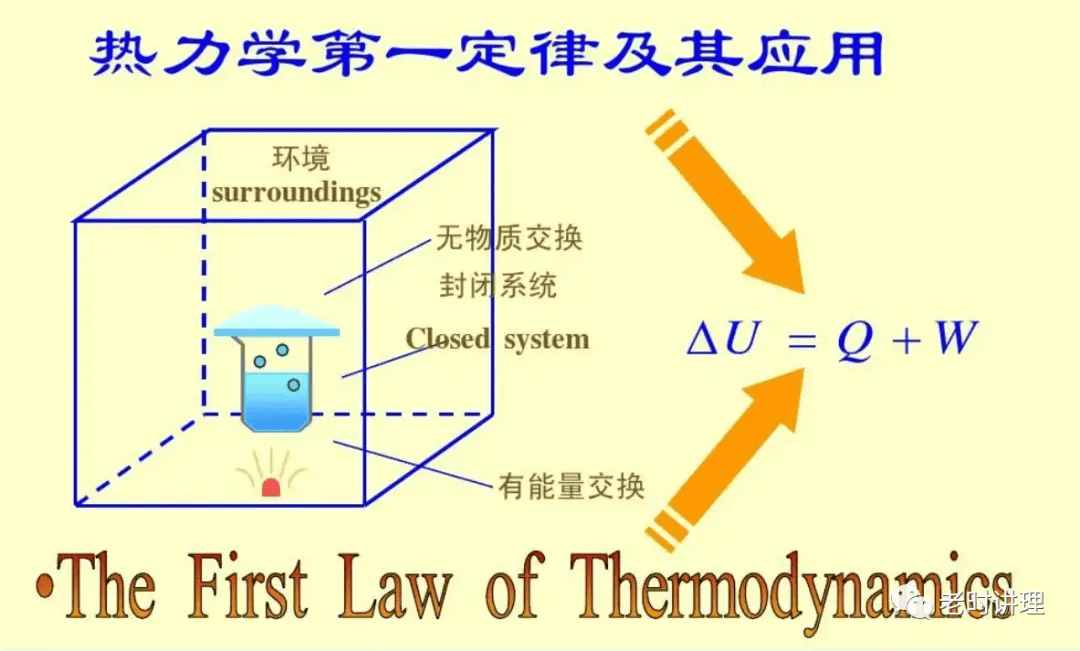
热力学第一定律(英语:First Law of Thermodynamics)是热力学的四条基本定律之一,能量守恒定律对非孤立系统的扩展。此时能量可以以功W或热量Q的形式传入或传出系统。即: ΔU=Q+W式中ΔU为系统内能的变化量,若外界对该系统做功,则 W为正值,反之为负值。 热力学第一定律阐述方式 1、物体内能的增加等于物体吸收的热量和对物体所作的功的总和。 2、系统在绝热状态时,功只取决于系统初始状态和结束状态的能量,和过程无关。 3、孤立系统的能量永远守恒。 4、系统经过绝热循环,其所做的功为零,因此第一类永动机是不可能的(即不消耗能量做功的机械)。 5、两个系统相互作用时,功具有唯一的数值,可以为正、负或零。 热力学第二定律 热力学第二定律(英语:second law of thermodynamics)是热力学的四条基本定律之一,表述热力学过程的不可逆性——孤立系统自发地朝着热力学平衡方向──最大熵状态──演化,同样地,第二类永动机永不可能实现。
这一定律的历史可追溯至尼古拉·卡诺对于热机效率的研究,及其于1824年提出的卡诺定理。定律有许多种表述,其中最具代表性的是克劳修斯表述(1850年)和开尔文表述(1851年),这些表述都可被证明是等价的。定律的数学表述主要借助鲁道夫·克劳修斯所引入的熵的概念,具体表述为克劳修斯定理。 虽然这一定律在热力学范畴内是一条经验定律,无法得到解释,但随着统计力学的发展,这一定律得到解释。 这一定律本身及所引入的熵的概念对于物理学及其他科学领域有深远意义。定律本身可作为过程不可逆性及时间流向的判据。而路德维希·玻尔兹曼对于熵的微观解释——系统微观粒子无序程度的量度,更使这概念被引用到物理学之外诸多领域,如信息论及生态学等。 热力学第二定律的自然语言表述 克劳修斯表述克劳修斯表述是以热量传递的不可逆性(即热量总是自发地从高温热源流向低温热源)作为出发点,虽然可以借助制冷机使热量从低温热源流向高温热源,但这过程是借助外界对制冷机做功实现的,即这过程除了有热量的传递,还有功转化为热的其他影响。 1850年克劳修斯将这一规律总结为: 不可能把热量从低温物体传递到高温物体而不产生其他影响。 开尔文表述开尔文表述是以第二类永动机不可能实现这一规律作为出发点。第二类永动机是指可以将从单一热源吸热全部转化为功,但大量事实证明这个过程是不可能实现的。功能够自发地、无条件地全部转化为热;但热转化为功是有条件的,而且转化效率有所限制。也就是说功自发转化为热这一过程只能单向进行而不可逆。 1851年开尔文勋爵把这一普遍规律总结为: 不可能从单一热源吸收能量,使之完全变为有用功而不产生其他影响。 两种表述的等价性上述两种表述可以论证是等价的: 1、如果开尔文表述不真,那么克劳修斯表述不真:假设存在违反开尔文表述的热机A,可以从低温热源T2吸收热量Q并将其全部转化为有用功 W。假设存在热机B,可以把功 W完全转化为热量Q并传递给高温热源T1(这在现实中可实现)。此时若让A、B联合工作,则可以看到Q从低温热源 T2流向高温热源 T1,而并未产生任何其他影响,即克劳修斯表述不真。 2、如果克劳修斯表述不真,那么开尔文表述不真:假设存在违反克劳修斯表述的制冷机A,可以在不利用外界对其做的功的情况下,使热量Q1由低温热源 T2流向高温热源 T1。假设存在热机B,可以从高温热源T1吸收热量Q2并将其中 Q2—Q1的热量转化为有用功W,同时将热量 Q1传递给低温热源 T2(这在现实中可实现)。此时若让A、B联合工作,则可以看到A与B联合组成的热机从高温热源 T1吸收热量 Q2—Q1并将其完全转化为有用功 W,而并未产生任何其他影响,即开尔文表述不真。 从上述二点,可以看出上述两种表述是等价的。 卡拉西奥多里原理 卡拉西奥多里原理是康斯坦丁·卡拉西奥多里在1909年给出的公理性表述: “ 在一个系统的任意给定平衡态附近,总有这样的态存在:从给定的态出发,不可能经过绝热过程得到。” 值得注意的是,卡拉西奥多里原理如果要和开尔文表述及克劳修斯表述等价,需要辅以普朗克原理(起始处于内部热平衡的封闭系统,等体积功总会增加其内能)。 定律的其他表述除上述几种表述外,热力学第二定律还有其他表述。如针对焦耳热功当量实验的普朗克表述: “ 不可存在一个机器,在循环动作中把以重物升高而同时使一热库冷却。” 以及较为近期的黑首保劳-肯南表述(Hatsopoulos-Keenan statement): “ 对于一个有给定能量,物质组成,参数的系统,存在这样一个稳定的平衡态:其他状态总可以通过可逆过程达到之。” 可以论证,这些表述与克劳修斯表述以及开尔文表述是等价的。 卡诺定理 卡诺定理是尼古拉·卡诺于1824年在《谈谈火的动力和能发动这种动力的机器》中发表的有关热机效率的定理。值得注意的是定理是在热力学第二定律提出20余年前已然提出,从历史角度来说其为热力学第二定律的理论来源。但是卡诺本人给出的证明是在热质说的错误前提下进行的证明,而对于其相对严密(以热动说为前提,而非热质说)的证明需要热力学第二定律。 定理的表述 卡诺定理表述为: 1、在相同的高温热源和低温热源间工作的一切可逆热机的效率都相等。 2、在相同的高温热源和低温热源间工作的一切热机中,不可逆热机的效率不可能大于可逆热机的效率。 与热力学其他定律的联系 与热力学第一定律的联系:热力学第一定律主要从数量上说明功和热量对系统内能改变在数量上的等价性。热力学第二定律揭示了热量与功的转化,及热量传递的不可逆性。两者对于全面的描述一个热力学过程都是不可或缺的。 与热力学第零定律的联系:热力学第零定律是在两物体处于热平衡前提下判定温度,在未达热平衡时不适用。在未达热平衡时可利用热力学第二定律,通过判定热传递方向来判定两物体的温度。 热力学第三定律 热力学第三定律是热力学的四条基本定律之一,其描述的是热力学系统的熵在温度趋近于绝对零度时将趋于定值。而对于完整晶体而言,这个定值为零。由于这个定律是由瓦尔特·能斯特归纳得出后发表,因此又常被称为能斯特定理或能斯特假定。1923年,吉尔伯特·路易斯和梅尔·兰德尔对此一定律重新提出了另一种表述。
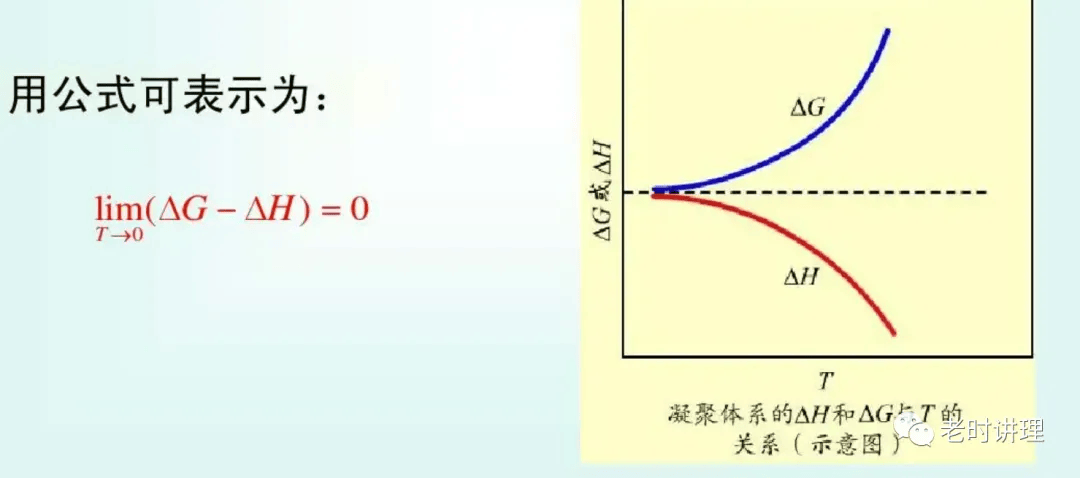
随着统计力学的发展,这个定律正如其他热力学定律一样得到了各种解释,而不再只是由实验结果所归纳而出的经验定律。 这个定律有适用条件的限制,虽然其应用范围不如热力学第一定律、热力学第二定律广泛,但仍对很多学科有重要意义——特别是在物理化学领域。 热力学第三定律的引出和表述这个定律是由瓦尔特·能斯特所归纳得出,并提出其表述,因此又常被称为“能斯特定理”或“能斯特假定”。 热力学第三定律(the third law of thermodynamics)是对熵的论述,一般当封闭系统达到稳定平衡时,熵应该为最大值,在任何自发过程中,熵总是增加,在绝热可逆过程中,熵增等于零。在绝对零度,任何完美晶体的熵为零;称为热力学第三定律。 热力学第三定律的数学表述 观察一个内部处于热力学平衡的封闭系统。由于系统处于平衡,其内部进行的过程均可逆,因此全系统的熵的增加为零。 绝对零度是不可达到 当温度趋近绝对零度时,只有熵不是常值时,才能通过有限的过程达到,否则是不可能的,由热力学第三定律我们可以得出,无论通过多么理想化的过程,都不可能透过有限次数的操作将任意一个热力学系统的温度降到绝对零度。 历史2017年3月14日,伦敦大学学院物理学者强纳森·欧本海姆(Jonathan Oppenheim)与路易斯·马撒纳斯(Lluis Masanes)发表论文首次数学证实绝对零度不可能达到原理(即热力学第三定律),并且设定了冷却热力系统的速度限制。 文章来源于老时讲理,转载旨在分享,如有侵权请联系删除。 免责声明:自媒体综合提供的内容均源自自媒体,版权归原作者所有,转载请联系原作者并获许可。文章观点仅代表作者本人,不代表环球物理立场。 环球物理 ID:huanqiuwuli 环球物理,以物理学习为主题,以传播物理文化为己任。专业于物理,致力于物理!以激发学习者学习物理的兴趣为目标,分享物理的智慧,学会用物理思维去思考问题,为大家展现一个有趣,丰富多彩的,神奇的物理。 投稿请联系 [email protected]返回搜狐,查看更多 |
【本文地址】