| 干货 | 您所在的位置:网站首页 › 溶解性曲线上方的点的含义 › 干货 |
干货
|
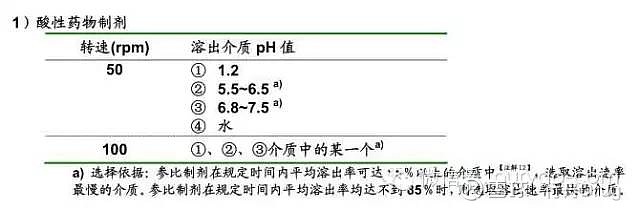
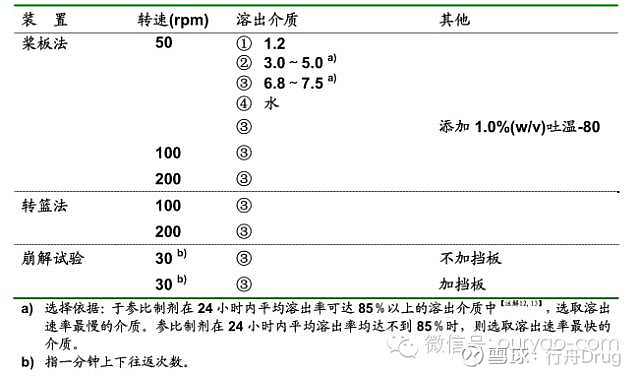
来源:雪球App,作者: 行舟Drug,(https://xueqiu.com/4396147139/145337524) 点击上方的 行舟Drug ▲ 添加关注 溶出度作为口服固体制剂关键质量属性,科学合理地评价口服固体制剂的体外溶出行为,对判断其体内生物利用度和生物等效性具有一定的意义。尽管仿制药与参比制剂溶出行为相似并不意味着临床疗效一致,但是体外溶出行为不一致临床疗效大部分不一致,因此体外溶出度评价作为仿制药一致性评价的一个工具还是有一定的意义。溶出曲线相似性的比较方法包括模型依赖法和非模型依赖法,其中相似因子f2为各国公认的最常见的溶出度评价方法,本文通过对中国、美国、日本三国相关指导原则相似因子f2的应用比较,为仿制药一致性评价工作提供一些借鉴。 中日美三国指导原则相似因子f2的应用比较表 指导原则 项目 普通口服固体制剂溶出度试验技术指导原则(中国) 普通口服固体制剂溶出曲线测定与比较指导原则(草案)2013.12.31 口服固体制剂溶出度试验技术指导原则(美国) 仿制药生物等效性试验指导原则(日本) 溶出实验条件 溶出装置:应选用中国药典收载的方法,如篮法和桨法,必要时可采用往复筒法或流通池法进行体外溶出度试验。 溶出介质体积:一般为500、900或1000 mL 试验温度:37±0.5 ℃ 转速:一般情况下篮法的转速为50~100 转/分钟;桨法的转速为50~75转/分钟。 溶出装置:推荐使用篮法、桨法,必要时可对其进行适当改装; 溶出介质体积:一般为500、900或1000 mL 试验温度:37±0.5 ℃ 转速:一般情况下篮法的转速为50~100 转/分钟;桨法的转速为50~75转/分钟。 溶出装置:最好采用转篮法和桨法,如有需要可考虑采用往复筒法或流通池法进行体外溶出度试验。 溶出介质体积:一般为500、900或1000 mL 试验温度:37±0.5 ℃ 转速:篮法的转速为50~100 转/分钟;桨法的转速为50~75转/分钟。 ⑴口服普通制剂与肠溶制剂: 溶出装置:桨法 溶出介质体积:原则上900ml 试验温度:37±0.5 ℃ 转速:50转或者100转; ⑵口服缓(控)释制剂: 溶出装置:桨板法、转篮法,甚至是崩解试验装置均可,但要详细说明选择理由。 溶出介质体积:原则上900ml 试验温度:37±0.5 ℃ 转速:桨板法50、100或者200转;转篮法100或者200转;崩解法30转 溶出介质的选择 —— 在确定药物主成分稳定的前提下,至少应选择 3 种 pH 值的溶出介质进行溶出曲线考察; 对于溶解度受pH 值影响大的药物, 可能需在更多种 pH 值的溶出介质中进行考察,必要时 pH 值可细分至 0.5。 肠溶制剂推荐选择pH值 1.2、4.5、6.0 和 6.8 的介质 —— 有详细规定 具体见附件[1] 溶出度测试条件 应在完全相同的条件下对受试和参比样品的溶出曲线进行测定 应在完全相同的条件下对仿制制剂和参比制剂的溶出曲线进行测定 应在严格相同的条件下进行受试批次和参照批次溶出度测试 —— 样品数量 分别取受试(变更后)和参比样品(变更前)各12片(粒),测定其溶出曲线。 平均溶出量应为12 片(粒)的均值。 测定受试产品(改变后)和参照产品(改变前)的溶出度曲线(各12个单位) 对于1个溶出度试验条件,各制剂均应采用至少12个单位样品。 取样时间点数 ①最适合于三至四个或更多取样点的溶出曲线比较; ②两条曲线的取样点应相同(如15、30、45、60分钟)。 ③药物溶出量超过85%的取样点不超过一个。 ①取样时间点可为5和/或 10、15 和/或 20、30、45、60、90、120分钟,此后每隔1小时进行测定; ②最适合采用 3~4个或更多取样点; ③两条溶出曲线的取样点应相同。时间点的选取应尽可能以溶出量等分为原则,并兼顾整数时间点,但溶出量在85%以上的时间点仅 能选取1个。 ①当具有三至四个或更多的溶出时间点时更适合; ②两个曲线的溶出时间点应相同(如15、30、45、60分钟)。 ③两个药品均溶出85%时,仅需考虑一次测量 ①参比制剂在15~30分钟内平均溶出率达85%以上时比较15、30和45分钟三个时间点; ②参比制剂在30分钟后、但在规定的时间内平均溶出率达85%以上时(缓控释制剂80%以上)以参比制剂平均溶出率达85%(缓控释制剂为80%)的时间点为Ta ,比较Ta/4、2Ta/4、3Ta/4和Ta四个时间点的两者平均溶出率; ③参比制剂在规定时间内平均溶出率达不到85%时(缓控释制剂达不到80%)以参比制剂在规定结束时间点平均溶出率的 85% 的时间点作为Ta,比较Ta/4、2Ta/4、3Ta/4 和Ta四个时间点。 溶出曲线试验截止时间点的选择 —— ①连续两点溶出量均达85%以上,且差值在5%以内。 ②一般在酸性溶出介质(pH值1.0~3.0)中考察时间不超过2小时。肠溶制剂也可选择pH值4.5的溶出介质替代酸性溶出介质进行考察。 ③在其它各pH 值溶出介质中考察时间不超过6小时。 —— ①口服普通制剂与肠溶制剂:pH1.2溶出介质 2小时;其他各pH值溶出介质6小时。但当参比制剂的平均溶出率达 85%以上时,试验则可结束; ②口服缓(控)释制剂:pH1.2溶出介质2小时;其他各pH 值介质24小时。但是,参比制剂的平均溶出率达到85% 以上时,试验则可结束。 每个取样时间的溶出量相对标准偏差RSD 第一个取样时间点(如15 分钟)的溶出量相对标准偏差不得超过20%,其余取样时间点的溶出量相对标准偏差不得超过10%。 选取的第一个时间点溶出结果的相对标准偏差不得过 20%,自第二个时间点至最后时间点溶出结果的相对标准偏差不得过 10%。 为采用均值,在较早时间点(如15分钟)的变异系数百分率应不高于20%,其他时间点的变异系数百分率应不高于10% —— 一致性判定标准 ①当受试制剂和参比制剂在15分钟内的溶出量≧85%时,可以认为两者溶出行为相似,无需进行f2的比较。 ②f2值越接近100,则认为两条曲线相似。一般情况下,f2值高于50,可认为两条曲线具有相似性,受试(变更后)与参比产品(变更前)具有等效性。 ①对于高溶解性和高渗透性的药物制剂, 当参比制剂在15分钟时,平均溶出量不低于85%,如仿制制剂在15分钟时,平均溶出量也不低于85%;或与参比制剂平均溶出量的差值不大于10%,此时可认为溶出曲线相似。 ②采用相似因子(f2)比较溶出曲线相似性时,除另有规定外,两条溶出曲线相似因子(f2)数值不小于50,可认为具有相似性。 备注:肠溶制剂在pH值1.2(或4.5)的溶出介质中,只需比较截止时间点的溶出量,不用进行溶出曲线相似性比较。 对于认为相似的曲线,f2值应接近100;一般情况下,f2值高于50(50-100),则两条曲线可确认为相同性或等价性因此受试药物(改变后)和参比制剂(改变前)确认为性能等价性。 ⑴口服普通制剂与肠溶制剂: ①参比制剂在15分钟以内平均溶出率达 85% 以上时试验制剂在15分钟以内平均溶出率也达85%以上;或是15分钟时,试验制剂与参比制剂(以下简称“两者”)平均溶出率的差在±15%范围内。 ②在参比制剂在15~30分钟平均溶出率达 85% 以上时对应于参比制剂平均溶出率分别为60%和85%两个时间点,两者平均溶出率的差均在±15%范围内;或f2因子大于42。 ③参比制剂在30分钟内平均溶出率未达85% 时 但只要满足以下任何一个条件, 仍可判定 溶出曲线相似。 a.参比制剂的平均溶出率在规定时间内达 85%以上时, 对应于参比制剂平均溶出率分别为40%和85%两个时间点,两者平均溶出率的差均在±15%范围内;或f2因子大于42。 b.参比制剂平均溶出率在规定时间内达50%以上但未达85%时,对应于最终时间点和参比制剂在最终时间点平均溶出率1/2所对应的时间点,两者平均溶出率的差均在±12%范围内;或f2因子大于46。 c.参比制剂平均溶出率在规定时间内达不到 50%时,对应于最终时间点和参比制剂在最终时间点平均溶出率1/2所对应的时间点,两者平均溶出率的差均在±9%范围内;或f2因子大于53。 ⑵口服缓(控)释制剂: 1)相似性 a.参比制剂在规定时间内平均溶出率达80% 以上时,对应于参比制剂平均溶出率分别为30%、50%和 80%三个时间点,两者平均溶出率的差均在±15%范围内;或f2因子大于42。 b.参比制剂在规定时间内平均溶出率达50% 以上但未达到80%时,对应于最终时间点和参比制剂在最终时间点的平均溶出率为1/2时所对应的时间点,两者平均溶出率的差均在±12%范围内;或是f2因子大于 46。 c.参比制剂在规定时间内平均溶出率达不到 50%时,对应于最终时间点和参比制剂在最终时间点的平均溶出率为1/2时所对应的时间点,两者平均溶出率的差均在±9%范围内;或是f2因子大于53。 2)同等性 a.参比制剂在规定的时间内平均溶出率达 80% 以上时,对应于参比制剂平均溶出率分别为30%、50%和80%三个时间点,两者平均溶出率的差均在±10%范围内;或是f2因子大于50 。 b. 参比制剂在规定时间内平均溶出率达 50% 以上但未达到80%时,对应于最终时间点和参比制剂在最终时间点的平均溶出率为1/2 时所对应的时间点,两者平均溶出率的差均在±8%范围内;或是f2因子大于55。 c.参比制剂在规定时间内平均溶出率达不到 50%时,对应于最终时间点和参比制剂在最终时间点的平均溶出率为1/2时所对应的时间点,两者平均溶出率的差均在±6%范围内;或是f2因子大于 61 附件[1] 仿制药生物等效性试验指导原则(日本)溶出介质的选择 1. 口服普通制剂与肠溶制剂
2. 口服缓(控)释制剂:
从上述比较表可以知道,目前使用体外溶出度一致性评价比较成熟的是日本,其颁发的《仿制药生物等效性试验指导原则》规定更为详细,专门用于仿制药一致性评价,对企业更有指导意义,反观我国颁发的《普通口服固体制剂溶出度试验技术指导原则》和美国颁发《口服固体制剂溶出度试验技术指导原则》由于其适用于企业产品研发溶出度质量标准建立,规定更为简单,而我国专门为仿制药一致性评价起草的《普通口服固体制剂溶出曲线测定与比较指导原则(草案)》则在借鉴日本的指导原则基础上内容较之前的《普通口服固体制剂溶出度试验技术指导原则》更适合用于仿制药溶出度一致性评价,但仅仅是草案而已,尚未正式颁发,有些遗憾。仅从溶出曲线f2相似因子的判定标准和计算时间点的选取原则来看,我国和美国的标准要严于日本。但是从溶出介质的选择和溶出试验条件要求来看,日本发布的指导原则更具指导意义。 溶出度比较已成为仿制药开发和上市后再评价越来越重要的一个关键质量指标,越来越为各国关注。由于我国在仿制药开发中对于溶出度重视不够,更多的是参照国外药典标准,较少关注体外溶出与体内生物利用度的相关性。随着仿制药一致性评价工作开展和国内企业走出国门走向世界的意愿,必将推动企业对制剂工艺的深入研究,从而提高仿制药的真正质量,使我们的仿制药形神兼备并达到与原研药临床疗效一致。 参考文献: 1.普通口服固体制剂溶出度试验技术指导原则(中国) 国家食品药品监督管理局2015年02月05日发布 2.普通口服固体制剂溶出曲线测定与比较指导原则(草案)2013.12.31 中国食品药品检定研究院 3.口服固体制剂溶出度试验技术指导原则(美国) 1997年8月FDA发布,2009年6月CFDA药审中心组织翻译 4.仿制药生物等效性试验指导原则(日本) 上海市药品检验所 谢沐风翻译撰写 文章信息源于公众号蒲公英制药技术论坛,登载该文章目的为更广泛的传递行业信息,不代表赞同其观点或对其真实性负责。文章版权归原作者及原出处所有,文章内容仅供参考。本网拥有对此声明的最终解释权,若无意侵犯版权,请联系小编删除。 学如逆水行舟,不进则退; 心似平原走马,易放难收。 行舟Drug 每日更新 欢迎订阅+ 医药大数据|行业动态|政策解读 |
【本文地址】