| STTT 综述︱中南大学湘雅二医院黎志宏/袁凌青团队评述表观遗传学在代谢内分泌疾病中的作用及研究进展 | 您所在的位置:网站首页 › 湘雅二医院院徽 › STTT 综述︱中南大学湘雅二医院黎志宏/袁凌青团队评述表观遗传学在代谢内分泌疾病中的作用及研究进展 |
STTT 综述︱中南大学湘雅二医院黎志宏/袁凌青团队评述表观遗传学在代谢内分泌疾病中的作用及研究进展
  撰文︱吴彦霖 责编︱方以一,王思珍 代谢内分泌疾病发病率逐年上升而成为严重的全球健康挑战。糖尿病已成为全球第九大死因,据国际糖尿病联合会统计,2021年有5.37亿成年人患有糖尿病,到2045年,这一数字估计将增加到7.83亿[1]。肥胖已成为全球主要的公共卫生问题,2016年,全球分别有超过19亿成年人和超过6.5亿成年人肥胖或超重,约占全球人口的39%[2]。非酒精性脂肪肝(non-alcoholicfatty liver disease,NAFLD)的全球患病率为 25%,已成为全球最常见的慢性肝病[3]。这些数据表明,代谢内分泌疾病由于随之而来的高发病率和死亡率而成为人类社会的严重负担;因此,揭示代谢内分泌疾病的机制和治疗方法至关重要。 表观遗传调控在多种代谢内分泌疾病的发生和发展中起着至关重要的作用[4-9]。表观遗传调控可以发生在各个层面,包括DNA甲基化、组蛋白修饰、染色质重塑和非编码 RNA (noncoding RNA,ncRNA) [10-12]。研究表明,多种表观遗传修饰与代谢疾病相关基因功能和表达显着相关[13-15]。因此,了解代谢内分泌疾病的表观遗传调节对于理解其发生和发展至关重要,并有助于在临床中开发新的预防或治疗策略。 2023年3月2日,中南大学湘雅二医院黎志宏教授团队和袁凌青教授团队合作在Signal Transduction and Targeted Therapy发表题为“Epigenetic regulation in metabolic diseases: mechanisms and advances in clinical study”的综述文章。2017级临床医学八年制学生吴彦霖为该文的第一作者,黎志宏教授和袁凌青教授为该文的共同通讯作者。作者首先总结了表观遗传学的发展历史和研究方法,并介绍了四种主要的表观遗传调控的一般机制,进而讨论了不同的表观遗传机制在代谢性疾病中的作用,随后介绍了表观遗传学与遗传或非遗传因素之间的相互作用以及表观遗传学在代谢性疾病方面的临床试验和应用。  一、表观遗传学简介 表观遗传学的概念于1942年被英国的生物学家Conrad Hal Waddington首次提出[16]。随着科技的进步和人们的不断探索,在过去的八十年里,人们对表观遗传学的了解逐步深入,逐渐认识到了DNA甲基化、组蛋白修饰、染色质重塑和ncRNA等表观遗传调节机制。表观遗传学的研究方法也在不断创新,目前已有多种方法用于表观遗传学的研究,包括:ChIP-seq、ISH-PLA、DNase-seq、ATAC-seq、FAIRE-Seq等等。  图1 表观遗传学发展的里程碑(图源: Yan-Lin Wu et al., Signal Transduct Target Ther, 2023) 图1 表观遗传学发展的里程碑(图源: Yan-Lin Wu et al., Signal Transduct Target Ther, 2023)二、表观遗传学在代谢性疾病中的作用 DNA甲基化、组蛋白修饰、染色质重塑和ncRNA是表观遗传学中四种主要的调节机制。在不改变基因序列的情况下,他们可以改变基因的表达。DNA甲基化是指甲基被添加到DNA分子中,最常发生在CpG岛[17],由DNA甲基转移酶(DNA methyltransferases,DNMT)催化完成。目前,研究已经揭示了多种形式的DNA甲基化,包括5mC,5hmC,5fC和5caC[18-20]。组蛋白修饰有多种类型,包括组蛋白乙酰化、组蛋白甲基化、组蛋白乳酰化、组蛋白磷酸化、组蛋白多巴胺化和组蛋白泛素化等等,目前大多数关于组蛋白修饰的研究都集中在组蛋白乙酰化上。组蛋白乙酰化主要发生在赖氨酸H3和H4的N末端,是一种可逆的翻译后修饰,主要由组蛋白乙酰转移酶(histone acetyltransferase,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)进行调控[21]。染色质重塑复合物可以通过利用三磷酸腺苷(adenosine triphosphate,ATP)水解的能量来调节基因表达,通过移动、滑动、破坏或重组核小体来改变染色质的包装状态,进而调节基因的表达。染色质重塑复合物有四个家族,包括SWI/SNF家族、ISWI家族、CHD家族和INO80家族[22-25]。ncRNA是指不编码蛋白质的RNA,根据不同的长度可分为miRNA[26]、lncRNA[27]和circRNA [28]等。这四种主要的表观遗传学机制在多种代谢性疾病中(糖尿病、肥胖、非酒精性肝病、骨质疏松等)扮演不同的角色。 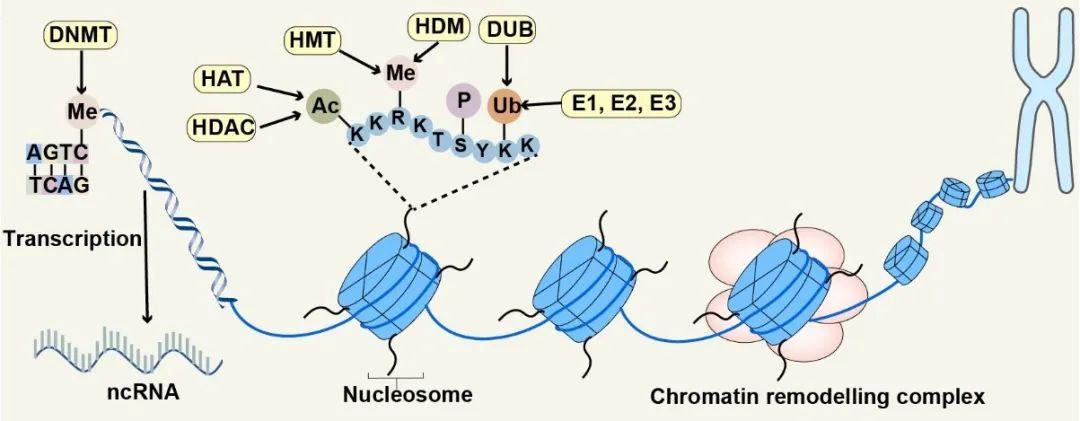 图2 表观遗传学的作用机制(图源:Yan-Lin Wuet al., Signal Transduct Target Ther,2023) 图2 表观遗传学的作用机制(图源:Yan-Lin Wuet al., Signal Transduct Target Ther,2023)三、遗传因素和非遗传因素与表观遗传学相互作用 表型受非遗传因素、遗传因素和表观遗传学的共同影响。非遗传因素和遗传因素都可能影响表观遗传学,导致代谢性疾病的发展。“表观遗传时钟”的概念于2013年首次提出,自那时以来,衰老的表观遗传学引起了越来越多的关注[29]。作为一个复杂的过程,衰老与生理功能的下降有关,会导致骨质疏松症和T2D等慢性代谢性疾病的患病率升高[30,31]。饮食调节表观遗传改变,也是参与代谢性疾病(如T2D,NAFLD和痛风)发病机制的关键因素[32-34]。除此之外,运动和环境污染也可能导致表观遗传改变[35,36] 。  图3 遗传因素和非遗传因素与表观遗传学相互作用(图源:Yan-Lin Wuet al., Signal Transduct Target Ther,2023) 图3 遗传因素和非遗传因素与表观遗传学相互作用(图源:Yan-Lin Wuet al., Signal Transduct Target Ther,2023)四、表观遗传学在代谢性疾病中的临床应用 与DNA甲基化、ncRNA相关的表观遗传生物标志物可用于早期诊断代谢性疾病。目前已有多个临床试验和基础实验研究表观遗传药物在代谢性疾病中的作用,包括:DNA甲基转移酶抑制剂(DNA methyltransferase inhibitors,DNMTi)、HDAC抑制剂(HDAC inhibitors,HDACi),HAT抑制剂(HAT inhibitors,HATi)和sirtuin激活化合物(sirtuin-activatingcompounds,STAC),但尚未有表观遗传药物被FDA批准使用于代谢性疾病中。表观遗传编辑通过重写内源性基因组位点的局部表观遗传景观来重新编程转录。随着CRISPR/Cas9等表观遗传编辑工具的进展,表观遗传编辑取得了显著进展,是极具有潜力的治疗代谢性疾病的手段。 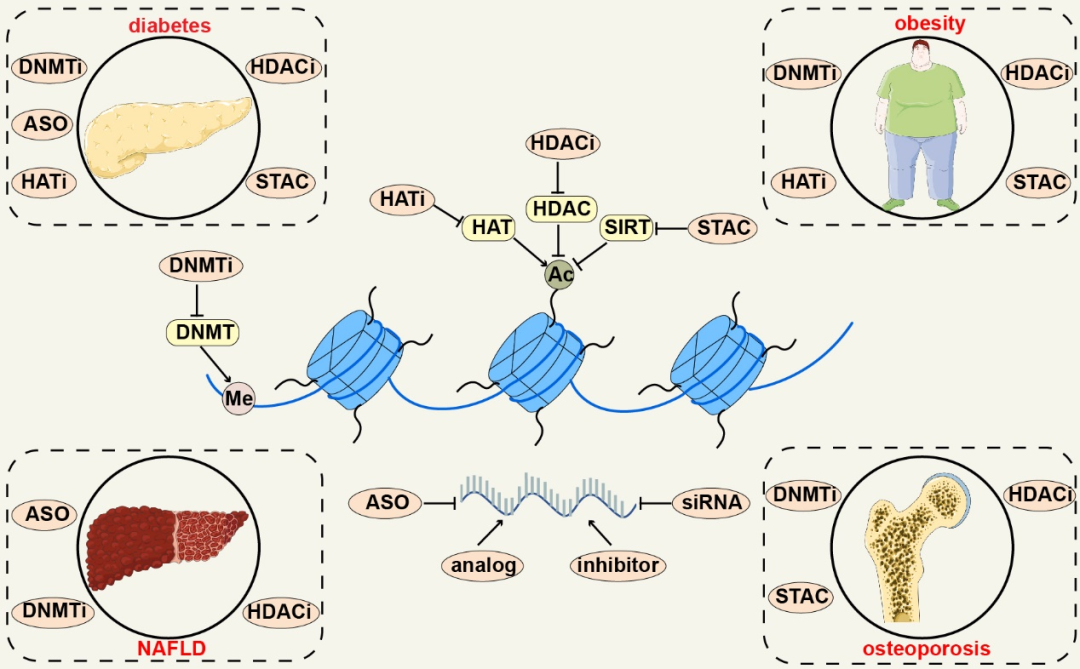 图4 表观遗传药物在代谢性疾病中的作用(图源:Yan-Lin Wuet al., Signal Transduct Target Ther,2023) 图4 表观遗传药物在代谢性疾病中的作用(图源:Yan-Lin Wuet al., Signal Transduct Target Ther,2023)五、总结与展望 在本文中,作者首先回顾了表观遗传学的历史,并简要介绍了表观遗传学研究的一些方法。然后介绍了DNA甲基化、组蛋白修饰、染色质重塑和ncRNA的机制及其在代谢性疾病中的作用。并且还讨论了代谢性疾病中表观遗传学与遗传学或非遗传因素之间的相互作用。最后总结了表观遗传学在代谢性疾病中的临床应用。尽管近年来对代谢性疾病中的表观遗传学进行了许多研究,但仍有许多挑战:(1)染色质重塑是表观遗传调控的主要形式之一,但很少有研究关注其在代谢疾病中的作用;(2)尽管有许多关于ncRNA和其他组蛋白修饰的研究,但其很少应用于临床;(3)还没有表观遗传药物被批准用于代谢疾病;(4)表观遗传学与其他非遗传风险因素或遗传学之间的相互作用值得研究。 原文链接:https://www.nature.com/articles/s41392-023-01333-7 通讯作者简介(上下滑动阅读) 黎志宏教授团队长期致力于骨与软组织肿瘤临床综合治疗、癌基因与细胞因子在骨肿瘤中发病机制、肿瘤耐药分子机制与肿瘤个体化模型研发与转化应用研究,该团队将临床与基础研究紧密结合,旨在阐明肿瘤治疗抵抗的分子机制,改变肿瘤患者现有治疗格局,实现肿瘤综合性治疗的突破。该团队在《Molecular Cancer》、《Advanced Science》、《Journalof Hematology & Oncology》等一系列国际知名杂志发表了研究成果。 袁凌青教授团队长期致力于探究表观遗传学在代谢性疾病中的作用,在血管钙化和骨质疏松的发病机制中做出了积极的贡献。该团队将临床与基础科研紧密结合,做真正对患者有意义,对学术发展有推动的基础科研。该团队在《Journal of Pineal Research》、《Cell Death Dis》、《J Nanobiotechnology》等一系列国际知名杂志发表了研究成果。  往期文章精选 【1】四川大学刘博团队综述双靶点小分子克服肿瘤耐药性的治疗策略 【2】STTT 综述︱陈永恒/危蝴蝶团队评述抑癌基因TP53的新进展 【3】美国弗吉尼亚大学孙杰团队揭示靶向线粒体丙酮酸载体MPC能同时降低高血糖和抑制过度炎症反应,为基础代谢病患者治疗新冠肺炎提供新靶点 【4】NAR︱中山大学黄林团队揭示含两个不同配体结合口袋的NAD+-II核糖开关的晶体结构及作用机制 【5】Nat Genet︱首个牧草(美洲狼尾草)图形泛基因组揭示耐热新机制 【6】Cell Reports | 中国药大周君/刘晓敏课题组合作报道METTL16调控mRNA帽结构识别促进翻译及肺癌发展 【7】Cell Biosci︱北京理工大学董磊团队发现Smurf1介导p62液滴形成来增强自噬和Nrf2活性 【8】Cell Death Discov︱福医大附院谢良地团队揭示肌少症中TNF-α调控骨骼肌细胞发生细胞焦亡的分子机制 【9】STAR Protocols︱方合志/王娅课题组发表线粒体分离及线粒体蛋白亚定位方法 【10】Nat Commun | 山东大学陈子江/赵涵团队发现血糖代谢调控新靶点 优质科研学习课程推荐 【1】多组学联合网络药理学及分子对接与实验验证研讨会(4月8-9日 腾讯会议) 【2】单细胞测序与空间转录组学数据分析研讨会(2023年3月11-12日,腾讯在线会议) 【3】肠道菌群与代谢组学研究策略研讨会(2023年3月11-12日,腾讯在线会议)(延期至2023年4月22-23日,腾讯在线会议) 【4】宏基因组与代谢组/脂质组学R软件数据可视化研讨会(延期至2023年3月25-26日,腾讯在线会议) 欢迎加入“岚翰生命科学” ”岚翰生命科学“ 诚聘副主编/编辑/运营岗位 (在线办公) 参考文献(上下滑动阅读) 1 Boulton, A. Strengthening the InternationalDiabetes Federation (IDF). Diabetes Res Clin Pract. 160, 108029, (2020).2 Koenen, M., Hill, M. A., Cohen, P. &Sowers, J. R. Obesity, Adipose Tissue and Vascular Dysfunction. Circ Res. 128,951-968, (2021).3 Li, J. et al. Prevalence, incidence, andoutcome of non-alcoholic fatty liver disease in Asia, 1999-2019: a systematicreview and meta-analysis. Lancet Gastroenterol Hepatol. 4, 389-398, (2019).4 Ling, C. & Ronn, T. Epigenetics inHuman Obesity and Type 2 Diabetes. Cell Metab. 29, 1028-1044, (2019).5 Chiou, J. et al. Interpreting type 1diabetes risk with genetics and single-cell epigenomics. Nature. 594, 398-402,(2021).6 Hoffman, D. J., Powell, T. L., Barrett, E.S. & Hardy, D. B. Developmental origins of metabolic diseases. Physiol Rev.101, 739-795, (2021).7 Muraca, M. & Cappariello, A. The Roleof Extracellular Vesicles (EVs) in the Epigenetic Regulation of Bone Metabolismand Osteoporosis. Int J Mol Sci. 21, (2020).8 Rohde, K. et al. Genetics and epigeneticsin obesity. Metabolism. 92, 37-50, (2019).9 Eslam, M., Valenti, L. & Romeo, S.Genetics and epigenetics of NAFLD and NASH: Clinical impact. J Hepatol. 68,268-279, (2018).10 Park, J., Lee, K., Kim, K. & Yi, S. J.The role of histone modifications: from neurodevelopment to neurodiseases. SignalTransduct Target Ther. 7, 217, (2022).11 Li, X. et al. Lipid metabolism dysfunctioninduced by age-dependent DNA methylation accelerates aging. Signal TransductTarget Ther. 7, 162, (2022).12 Nacev, B. A. et al. The epigenomics ofsarcoma. Nat Rev Cancer. 20, 608-623, (2020).13 He, X., Kuang, G., Wu, Y. & Ou, C.Emerging roles of exosomal miRNAs in diabetes mellitus. Clin Transl Med. 11,e468, (2021).14 Mengozzi, A. et al. Targeting SIRT1 RescuesAge- and Obesity-Induced Microvascular Dysfunction in Ex Vivo Human Vessels. CircRes, 101161CIRCRESAHA122320888, (2022).15 Ling, C., Bacos, K. & Ronn, T.Epigenetics of type 2 diabetes mellitus and weight change - a tool forprecision medicine? Nat Rev Endocrinol. 18, 433-448, (2022).16 Waddington, C. H. The epigenotype. 1942. IntJ Epidemiol. 41, 10-13.17 Ma, X. & Kang, S. Functional Implicationsof DNA Methylation in Adipose Biology. Diabetes. 68, 871-878, (2019).18 Kriaucionis, S. & Heintz, N. The nuclearDNA base 5-hydroxymethylcytosine is present in Purkinje neurons and the brain. Science.324, 929-930, (2009).19 Tahiliani, M. et al. Conversion of5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL partnerTET1. Science. 324, 930-935, (2009).20 Maiti, A. & Drohat, A. C. Thymine DNAglycosylase can rapidly excise 5-formylcytosine and 5-carboxylcytosine:potential implications for active demethylation of CpG sites. J Biol Chem. 286,35334-35338, (2011).21 Shvedunova, M. & Akhtar, A. Modulation ofcellular processes by histone and non-histone protein acetylation. Nat Rev MolCell Biol. 23, 329-349, (2022).22 Cenik, B. K. & Shilatifard, A. COMPASSand SWI/SNF complexes in development and disease. Nat Rev Genet. 22, 38-58,(2021).23 Li, Y. et al. The emerging role of ISWIchromatin remodeling complexes in cancer. J Exp Clin Cancer Res. 40, 346,(2021).24 Liu, C., Kang, N., Guo, Y. & Gong, P.Advances in Chromodomain Helicase DNA-Binding (CHD) Proteins Regulating StemCell Differentiation and Human Diseases. Front Cell Dev Biol. 9, 710203,(2021).25 Willhoft, O. & Wigley, D. B. INO80 andSWR1 complexes: the non-identical twins of chromatin remodelling. Curr OpinStruct Biol. 61, 50-58, (2020).26 Ling, H., Fabbri, M. & Calin, G. A.MicroRNAs and other non-coding RNAs as targets for anticancer drug development.Nat Rev Drug Discov. 12, 847-865, (2013).27 St Laurent, G., Wahlestedt, C. &Kapranov, P. The Landscape of long noncoding RNA classification. Trends Genet. 31,239-251, (2015).28 Sharp, P. A. The centrality of RNA. Cell. 136,577-580, (2009).29 Horvath, S. DNA methylation age of humantissues and cell types. Genome Biol. 14, R115, (2013).30 Ling, C. et al. Genetic and epigeneticfactors are associated with expression of respiratory chain component NDUFB6 inhuman skeletal muscle. J Clin Invest. 117, 3427-3435, (2007).31 Wang, R. et al. Epigenetic Regulation inMesenchymal Stem Cell Aging and Differentiation and Osteoporosis. Stem CellsInt. 2020, 8836258, (2020).32 Kowluru, R. A. Retinopathy in a Diet-InducedType 2 Diabetic Rat Model and Role of Epigenetic Modifications. Diabetes. 69,689-698, (2020).33 Chen, H. C., Chen, Y. Z., Wang, C. H. &Lin, F. J. The nonalcoholic fatty liver disease-like phenotype and loweredserum VLDL are associated with decreased expression and DNA hypermethylation ofhepatic ApoB in male offspring of ApoE deficient mothers fed a with Westerndiet. J Nutr Biochem. 77, 108319, (2020).34 Georgel, P. T. & Georgel, P. WhereEpigenetics Meets Food Intake: Their Interaction in the Development/Severity ofGout and Therapeutic Perspectives. Front Immunol. 12, 752359, (2021).35 Nitert, M. D. et al. Impact of an exerciseintervention on DNA methylation in skeletal muscle from first-degree relativesof patients with type 2 diabetes. Diabetes. 61, 3322-3332, (2012).36 Poursafa, P. et al. DNA methylation: apotential mediator between air pollution and metabolic syndrome. ClinEpigenetics. 14, 82, (2022).编辑︱杨彬薇 本文完 |
【本文地址】