| 一种维生素D3含量的检测方法与流程 | 您所在的位置:网站首页 › 测缺钙和维生素D的方法 › 一种维生素D3含量的检测方法与流程 |
一种维生素D3含量的检测方法与流程
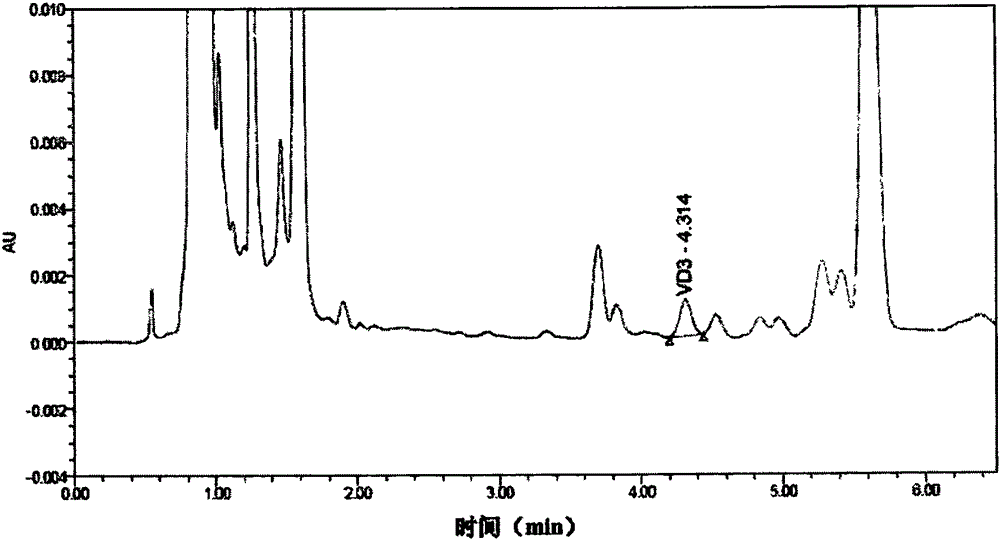 本发明涉及一种物质含量的检测方法,尤其是涉及一种维生素D3含量的检测方法。 背景技术: 维生素D3为固醇类衍生物,又称胆钙化醇,主要来源于膳食摄入或紫外线照射下体内合成,能促进体内钙元素、磷元素的吸收,对儿童佝偻病及成人缺钙导致的疾病能够起到很好的预防作用。因此,维生素D3常被应用于补钙类的保健食品中。我国对于保健食品中维生素D3含量的检测还未给出标准方法,随着保健食品的检测需求量与日俱增,市面上对维生素D3的检测方法主要有酶联免疫法、高效液相色谱法和高效液相色谱串联质谱法,下面分别对这三种方法进行说明。 (1)酶联免疫法主要针对血浆样品,其操作和设备都较为简单,但是其适用范围较小,无法对基质复杂的保健食品进行检测。 (2)高效液相色谱法主要依据GB5413.9-2010的方法,该方法主要针对婴幼儿食品和乳品,采用正相-反相双系统检测,步骤繁琐且操作时间长、易损失,对操作人员的技术要求和实验室仪器条件要求非常高,操作人员在得到预处理样液后需要立刻进入正相系统分离且收集需要的保留时间段内的液体,并立刻予以氮吹,总处理时间过长则极易破坏维生素的含量。同时,这种方法对于实验室要求很高,需要同时拥有两台液相仪器或一套在线切换装置,费用成本很高。 (3)高效液相色谱串联质谱法主要是采用同位素内标检测,该方法灵敏度较高,但是同位素标准价格昂贵,不适用于日常工作大量样品的检测,购买同位素内标的价格超过一般实验室的检测费用很多倍,且国内没有生产厂家,需从国外购买,等待周期很长。 为此,需要建立一种既经济简便,且适用范围广、易普及的方法,用于检测样品尤其是保健品中维生素D3的含量,为维生素D3检测的日常工作提供参考方法。 技术实现要素: 本发明就是针对现有维生素D3含量检测方法适用范围小、检测效率低和成本较高的技术问题,提供一种适用范围广、检测效率高和成本较低的维生素D3含量的检测方法。 本发明提供一种维生素D3含量的检测方法,其步骤如下: (1)标准溶液的配制 在避光条件下准确称取维生素D3标准品,用乙醇配制成理论浓度为1mg/mL的标准储备液;吸取上述标准储备液适量,使用甲醇稀释配制成浓度为0.1~5.0μg/mL的标准溶液; (2)样品处理 ①皂化:称取混合均匀的待检测的样品,依次加入抗坏血酸、焦性没食子酸、2,6-二叔丁基对甲酚、无水乙醇和氢氧化钾水溶液,在加热磁力搅拌器的作用下进行皂化; ②萃取:将皂化液转移至分液漏斗中,加入萃取剂进行萃取,合并萃取所得的萃取剂,去除痕量水后收集于圆底烧瓶内;将圆底烧瓶蒸至近干,然后用氮吹仪吹干; ③定容:将吹干的圆底烧瓶用正己烷分多次少量的洗涤并转移至定容瓶中待用; ④净化:依次用二氯甲烷和正己烷淋洗活化硅胶柱,吸取定容后的样液转移到硅胶柱中,经除杂、洗脱后用氮吹仪吹干,加入甲醇溶解,通过滤膜过滤后得到滤液; (3)高效液相色谱仪分析 将步骤④得到的滤液注入高效液相色谱仪进行分析。 优选地,步骤(3)中色谱条件如下: 色谱柱:HPLC SB C18柱(0.45μm,5mm×150mm); 流动相:95%的甲醇和5%的水; 流速0.3mL/min; 柱温:40℃; 紫外检测器(DAD)检测波长:264nm; 进样量为5μL。 优选地,步骤(1)中配制标准储备液时使用乙醇逐级稀释,按稀释倍数计算标准储备液的实际浓度,计算浓度时在264nm波长下使用分光光度计进行校正并计算校正液实际浓度。 优选地,步骤①中抗坏血酸、焦性没食子酸、2,6-二叔丁基对甲酚与样品的质量比为1.5∶1∶0.1∶10。 优选地,步骤①中氢氧化钾水溶液中氢氧化钾的质量百分比为35%,皂化温度为75℃,皂化时间为40分钟。 优选地,步骤②中萃取剂为石油醚,萃取次数为3次以上。 优选地,步骤④除杂时先使用正己烷淋洗,然后用环己烷、正己烷和异丙醇的混合溶液淋洗,环己烷和正己烷的体积比为1∶1,异丙醇的体积分数为0.8%。 优选地,步骤④洗脱时所用洗脱液的含量及比例为40份的乙酸乙酯:60份的正己烷,所用滤膜的孔径为0.22μm。 本发明采用固相萃取-高效液相色谱HPLC法检测保健食品中维生素D3含量,改变传统高效液相色谱HPLC法需要正相-反相双系统操作的方法,改善了前处理时间长、有效成分易破坏、对操作人员技术要求高、对实验室仪器数量要求多等问题,使得维生素D3在经皂化、萃取、定容后直接过固相萃取柱净化,进反相HPLC-DAD液相系统上样,5分钟内出峰,极大的缩短了实验的时间,提高了实验的效率。另外,通过改变皂化温度和皂化时间,使得样品能够皂化充分,减少杂质干扰、提高实验的回收率。因此,用本发明测定能够满足实际工作需要,填补了保健食品中维生素D3含量标准方法的空白,是测定保健食品中维生素D3含量的高效、有效的定量方法。 附图说明 图1是本发明不同体积比例的洗脱液的洗脱效果比较图; 图2是本发明标准溶液的色谱图; 图3是本发明待测样品的色谱图; 图4是本发明待测样品的加标色谱图。 具体实施方式 一、仪器来源说明: Agilent Technologies HPLC高效液相色谱仪(美国Agilent公司); 紫外检测器(DAD)(美国Agilent公司); 电子天平(瑞士梅特勒公司) 加热磁力搅拌器(IKA公司); 固相萃取仪(北京卓信伟业科技有限公司); 旋转蒸发仪(上海亚荣生化有限公司); 氮吹仪(天津奥特赛恩斯仪器有限公司); 超声波清洗器(昆山市超声仪器有限公司)。 二、试剂来源说明: 维生素D3标准品(USP,批号:POJ194); 甲醇(高效液相色谱纯,美国Fisher Scientific,批号:114517); 正己烷(高效液相色谱纯,天津市科密欧化学试剂有限公司,批号:20151013); 乙酸乙酯(高效液相色谱纯,天津市科密欧化学试剂有限公司,批号:20130331); 异丙醇(高效液相色谱纯,天津市科密欧化学试剂有限公司,批号:20150309); 二氯甲烷(高效液相色谱纯,天津市科密欧化学试剂有限公司,批号:20150226); 石油醚(分析纯,天津市致远化学试剂有限公司,批号:2015122011); 氢氧化钾(分析纯,天津市恒兴化学试剂制造有限公司,批号:20160102); 抗坏血酸(分析纯,西陇化工股份有限公司,批号:160102); 焦性没食子酸(分析纯,天津市北辰大正试剂厂,批号:20130615); 无水乙醇(分析纯,国药集团化学试剂有限公司,20160107); 氯化钠(分析纯,天津市致远化学试剂有限公司,批号:20150201); 2,6-二叔丁基对甲酚(国药集团化学试剂有限公司,批号:F20080509); 无水硫酸钠(分析纯,天津市科密欧化学试剂有限公司,批号:20160110,经过400℃烘烤4h); 超纯水由Milli-Q超纯水机制得(美国Millipore公司); 硅胶柱(杭州福裕科技服务有限公司,500mg/6mL)。 三、检测步骤: (1)标准溶液的配制 ①避光条件下,使用电子天平准确称取维生素D3标准品,用乙醇配制成理论浓度为1mg/mL的标准储备液。配制时使用乙醇逐级稀释,按稀释倍数计算标准储备液的实际浓度,计算浓度时在264nm波长下使用分光光度计进行校正并计算校正液实际浓度。 ②吸取上述标准储备液适量,使用甲醇稀释,配制浓度为0.10μg/mL、0.20μg/mL、0.50μg/mL、1.0μg/mL、2.0μg/mL和5.0μg/mL的标准溶液,并于冰箱-20℃保存。以标准系列工作溶液浓度为横坐标,峰面积为纵坐标绘制标准曲线。 (2)样品处理 ①皂化:称取混合均匀的待检测的样品10.0g,并依次加入1.5g抗坏血酸、1.0g焦性没食子酸、0.1g 2,6-二叔丁基对甲酚、100mL无水乙醇、35%氢氧化钾水溶液100mL,在温度为75℃的加热磁力搅拌器上冷凝回流40分钟,取出后迅速冷却至室温得到皂化液。 经试验,10%、20%、30%、40%、50%的氢氧化钾水溶液皂化效果,发现在对保健食品维生素D3检测中,35%氢氧化钾水溶液即可皂化完全。在皂化温度方面试验50℃、60℃、70℃、80℃、90℃的皂化效果,发现当皂化温度为75℃,皂化40分钟即可皂化完全,且被测物质不会被破坏,低于此温度时需要延长皂化时间,高于此温度容易使待测物质氧化。 ②萃取:将皂化液转移至500mL的分液漏斗中,加入100mL石油醚进行萃取,边摇动边排气,摇动10分钟后静置待明显分层,上层为溶有样品的石油醚,将下层皂化液转移至另一分液漏斗后重复上述萃取步骤2次,合并3次(3次以上也可以)萃取所得的石油醚,过无水硫酸钠脱去除痕量水后收集于圆底烧瓶内;将圆底烧瓶放于旋转蒸发仪内在45℃下蒸至近干,取出后用氮吹仪吹干。 ③定容:将吹干的圆底烧瓶用正己烷分多次少量的洗涤并转移定容至10mL容量瓶中待用。 ④净化:依次用5mL的二氯甲烷和5mL的正己烷淋洗活化硅胶柱,吸取定容后的样液1.0mL转移到硅胶柱中,再依次用5mL正己烷,5mL环己烷∶正己烷(1∶1)(按体积加入0.8%异丙醇)混合溶液淋洗除杂(使用这两种不同的收集液除杂的原因在于待测物质不会溶于这两种不同的收集液中),然后加5mL乙酸乙酯∶正己烷(40∶60)的混合溶液将维生素D3从硅胶柱上洗脱并收集,然后用氮吹仪吹干,加入1.0mL甲醇溶解,通过0.22μm滤膜过滤,待HPLC测定。 吸取定容后的样液上柱,分别试验乙酸乙酯与正己烷混合溶液百分比例10∶90、20∶80、30∶70、40∶60、50∶50、60∶40作为洗脱液收集,分别测定并绘制洗脱曲线见图1。由图1可知,当乙酸乙酯与正己烷体积比例为40∶60时,洗脱率最高,故选择乙酸乙酯∶正己烷(40∶60)作为洗脱液。 (3)高效液相色谱仪分析 将步骤(2)得到的滤液注入高效液相色谱仪进行分析,色谱条件如下: 色谱柱:HPLC SB C18柱(0.45μm,5mm×150mm); 流动相:甲醇+水(95+5); 流速:0.3mL/min; 柱温:40℃; 紫外检测器(DAD)检测波长:264nm; 进样量为5μL。 四、线性范围及检出限: 避光条件下,配制标准曲线为0.10μg/mL、0.20μg/mL、0.50μg/mL、1.0μg/mL、2.0μg/mL、5.0μg/mL。进样5μL,记录色谱图和峰面积,线性回归方程为y=46152x-1735.1,相关系数为0.9996。按取样10.0g最后定容至10mL计算,方法检出限为1.0μg/100g。标准图谱见图2。 五、加标回收率和精密度试验: 采用样品添加标准品方式,在三个浓度水平进行添加,按上述样品处理操作步骤在不同时间进行9次试验,测定结果如下表所示: 当添加水平为0.20~1.0mg/kg时,本方法的加标回收率为87.8~105.8%,相对标准偏差为1.28~3.58,样品图谱见图3,样品加标图谱见图4。 当实验过程中由于处理不当出现乳化现象时,可以使用饱和氯化钠溶液来消除乳化;实验过程中所用的水为超纯水,均由Milli-Q超纯水机制得;实验完成后的仪器使用超声波清洗器进行清洗。 |
【本文地址】