| Nat. Chem.:新的“生命起源”化学反应 | 您所在的位置:网站首页 › 氨基和酸反应 › Nat. Chem.:新的“生命起源”化学反应 |
Nat. Chem.:新的“生命起源”化学反应
|
Nat. Chem.:新的“生命起源”化学反应——从α-酮酸到α-氨基酸和乳清酸的前生物合成
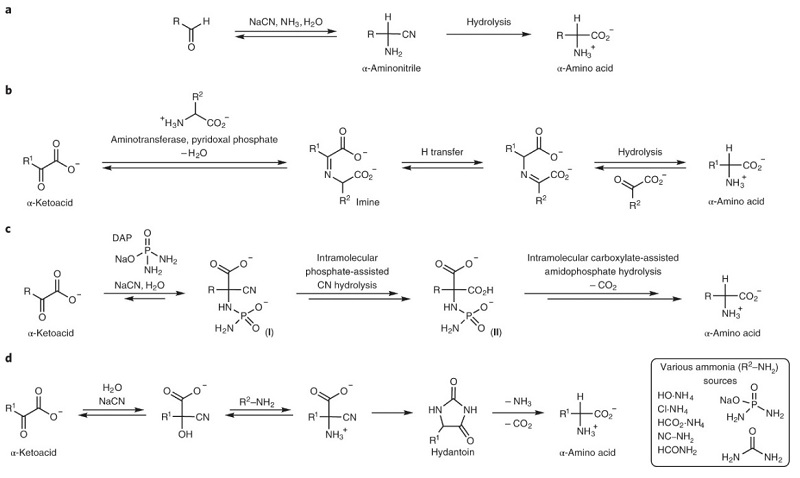
氨基酸和核碱基是地球上生命体的基本组成单元,也是前生物化学(prebiotic chemistry)中的核心分子。如图1a所示,科学家认为在早期地球上,醛与氰化物和氨的Strecker反应可合成氨基酸,而核碱基则是通过氰化物聚合物的水解构建而成,此途径与如今地球上的生化合成途径有很大的不同。虽然异养模型表明氰化物和甲醛是前生物化学中的起源分子,但是如今的生化途径则是利用α-酮酸为结构单元,并且主要依靠氨基转移来合成α-氨基酸(图1b),再转化为核碱基。这也意味着前生物化学和如今的生化途径之间必然存在某种进化上的转换,尽管这种转换机制尚不清楚。 近日,美国斯克利普斯研究所(The Scripps Research Institute)的Ramanarayanan Krishnamurthy教授(点击查看介绍)课题组发现α-酮酸与氰化物和氨源反应可通过Bucherer-Bergs途径形成相应的α-氨基酸。通过N-氨基甲酰基天冬氨酸中间体由草酰乙酸至天冬氨酸的高效前生物转化能够同时形成二氢乳清酸(DHO),这与嘧啶核碱基前体乳清酸的生化合成相似。乙醛酸可形成甘氨酸和乳清酸,并与丙二酸和尿素反应形成天冬氨酸和DHO。这些结果连同先前证明的Krebs循环的原代谢类似物表明,从α-酮酸到α-氨基酸和乳清酸的转化可能是前生物化学向现代代谢途径过渡的重要一环。相关成果发表在Nature Chemistry 上。
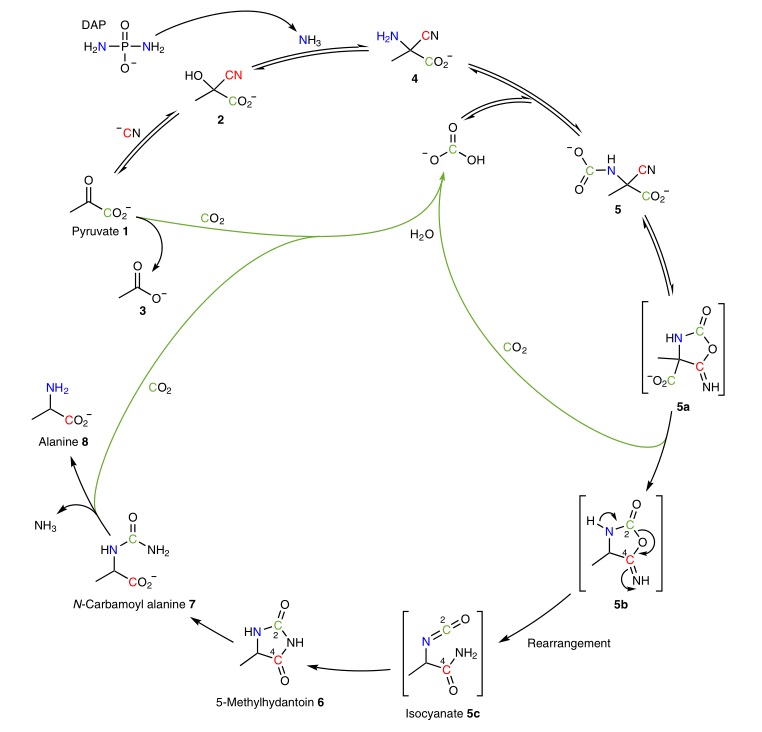
图1. α-氨基酸的生物合成路线比较。图片来源:Nat. Chem. 近期的研究表明在无金属条件下,乙醛酸和丙酮酸反应可产生柠檬酸还原途径(rTCA)的α-酮类似物。目前,α-酮酸生物合成氨基酸的途径主要有两种(即还原胺化和转氨化),并且非生物途径的还原胺化和转氨化反应已被化学家所研究。为了提高近中性pH值下的转氨化反应效率,作者利用氨基乙腈(pKa = 5.3)代替甘氨酸,但其反应效率较低。为此,作者提出了一种替代方法:即α-酮酸与氨源(如磷二酰胺(DAP))和氰化物反应产生羧基氨基腈中间体I,后者易脱羧生成α-氨基酸(图1c)。需要指出的是,作者选择DAP(pKa ≈ 5)为氨源主要有以下两方面原因:1)DAP会释放NH3 并在醛的Strecker反应中充当氨供体;2)由α-酮酸形成的中间体I有助于氰化物的分子内水解,并生成α,α-二羧酸中间体II,后者经脱羧还原胺化便可形成相应的α-氨基酸。 基于上述设想,作者对丙酮酸1、DAP和氰化物的反应条件(如浓度、pH值、温度、缓冲液)进行优化(图2),并通过1H和13C NMR谱进行监测,结果表明:1)室温下可观察到氰醇加合物2和α-氨基腈4,通过延长反应时间或者加热可将其转化为5-甲基乙内酰脲6和主要产物丙氨酸8;2)NMR监测发现该过程并不是经典的Strecker反应(图1c),而是通过Bucherer-Bergs途径生成乙内酰脲,进而水解为相应的α-氨基酸(图1d),其中乙内酰脲的生成使得原位捕获CO2成为可能;3)对照实验表明无碳酸氢盐时,乙内酰脲6的C2-羰基源于α-酮酸的CO2H基团,而氰化物则是6的C4-羰基,最终成为α-氨基酸8的羧基;4)在脱气的磷酸盐缓冲液中,加热才可生成6和乙酸盐,这说明初始的CO2源于丙酮酸的氧化脱羧并产生乙酸,进一步研究表明CO2对反应的引发至关重要;5)CO2还能与4反应生成N-羧基氨基腈5,后者经分子内环化生成中间体5a和5b,随后经异氰酸酯中间体5c重排为6,同时伴随着α-酮酸的羧基脱羧,并且释放出的CO2(与水反应形成碳酸氢盐)被另一分子4捕获形成6的催化循环。另外,在较低浓度下(0.05 M丙酮酸,室温下21天)进行反应时能以62-65%的转化率获得6。
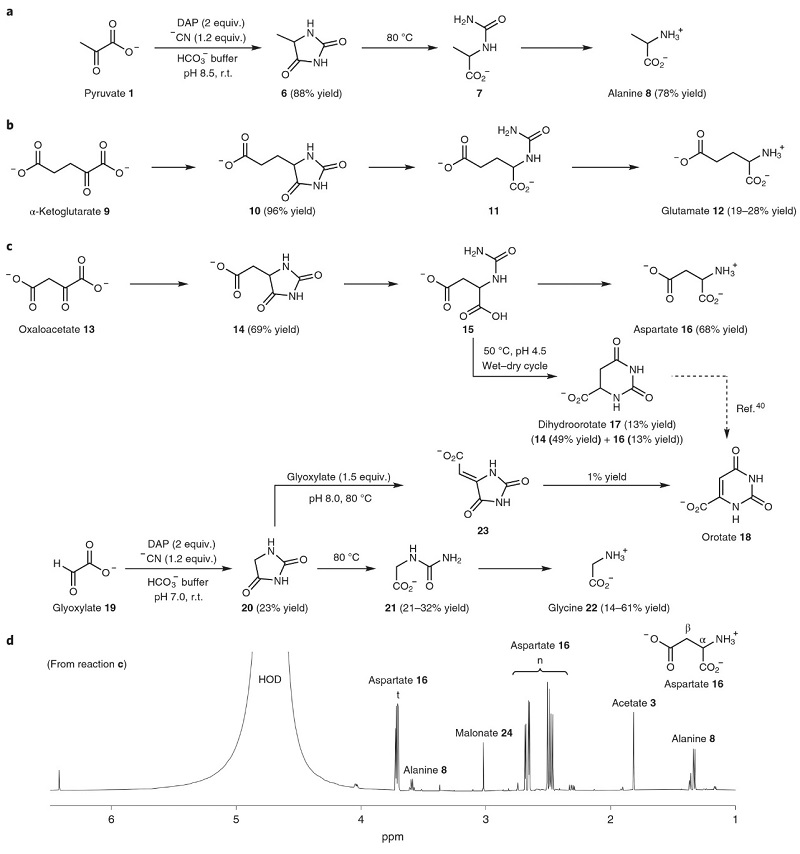
图2. 通过Bucherer-Bergs反应将α-酮酸转化为α-氨基酸的机制。图片来源:Nat. Chem. 随后,作者发现乙内酰脲中间体具有稳定性,通常需要特殊的条件才能水解为氨基酸,因此可将其作为一种“储存氨基酸”的前体,但仍需乙内酰脲具备前生物催化剂和条件,才可真正作为前生物肽的一种新形式。鉴于DAP被水解仅作为NH3源而磷酸盐不起作用,因此丙酮酸1在最优条件下(2.0 equiv DAP、1.2 equiv NaCN、pH = 8.5)能产生88%的6,后者在80 ℃下水解为8(产率:78%,图3a)。进一步研究发现,将丙酮酸替换为α-酮戊二酸9可以96%的产率生成相应的乙内酰脲10(图3b),后者可以19%的产率水解为谷氨酸12,而将pH调节到9后产率可提高至28%。 当上述α-酮酸的还原胺化产生α-氨基酸时,后者是否会进一步与α-酮酸发生反应呢?为此,作者将甘氨酸/甘氨酸酰胺和丙酮酸置于优化条件下进行反应,仅观察到氨基酸-腈加合物4a,而没有观察到相应的取代乙内酰脲衍生物5f和羧甲基取代的丙氨酸衍生物5g,这说明氢原子在中间体5a/5b的环内氮上具有关键作用,并且对异氰酸酯中间体5c的形成非常重要。进一步研究表明任何条件下形成的α-氨基酸均不会对Bucherer-Bergs还原胺化过程产生不利影响。另外,尽管α-酮酸的Bucherer-Bergs反应与醛的Strecker反应均通过α-氨基腈中间体进行,但是却经过不同的途径获得α-氨基酸(图1a、1d)。进一步研究发现无CO2时进行的典型Strecker反应不能准确描述早期地球(普遍存在CO2)上α-氨基酸是如何形成的,并且在CO2存在下α-氨基酸的形成是通过相应的乙内酰脲中间体而非传统的Strecker途径,这些结果表明醛类和α-酮酸均可通过Bucherer-Bergs反应产生乙内酰脲中间体,后者可转化为α-氨基酸。需要指出的是,科学家已在陨石中发现了乙内酰脲,这与本文和先前研究描述的Bucherer-Bergs反应化学共同解释了早期α-氨基酸的合成途径。 与丙酮酸和α-酮戊二酸不同,草酰乙酸13在溶液中易脱羧,因此将其转氨化为天冬氨酸16较为困难。如图3c、3d所示,13在最优条件下能以69%的收率转化为相应的乙内酰脲14,后者在80℃下经N-氨基甲酰基天冬氨酸中间体15便可生成天冬氨酸16(收率:68%),这种前生物转化途径与先前的非酶促转氨化或其它还原胺化反应形成了鲜明的对比。另外,15在溶液中简单加热/干湿循环便可生成乙内酰脲(14,49%)、天冬氨酸(16,13%)和DHO(17,13%),后者是乳清酸18的前体。类似地,乙醛酸19在pH=7的优化条件下也能转化为乙内酰脲20,后者在80 ℃下产生甘氨酸22(14-61%)以及N-氨甲酰基甘氨酸21(21-32%),同时在反应混合物中还观察到痕量的乳清酸(1%)。综上,α-酮酸的Bucherer-Bergs化学表明嘧啶是这组原代谢反应的自然产物。
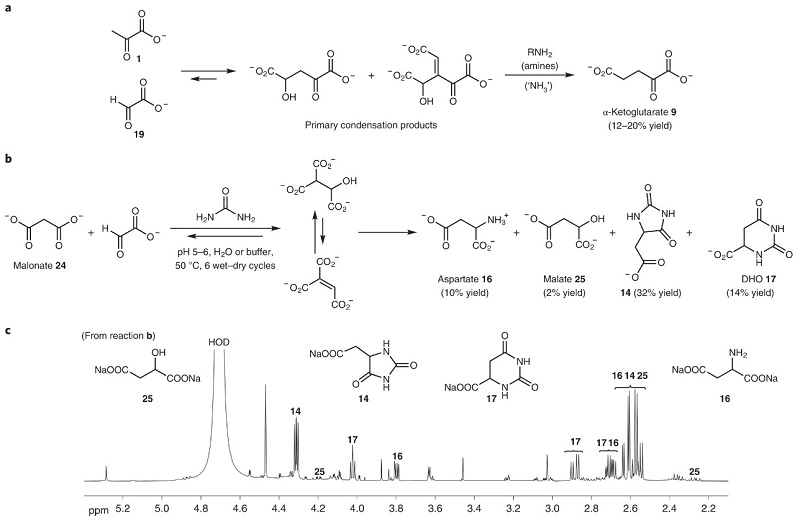
图3. α-酮酸合成α-氨基酸和乳清酸。图片来源:Nat. Chem. 上述反应途径是先前工作的延伸,其中丙酮酸和乙醛酸的醛醇缩合生成α-酮戊二酸和相应的α-酮酸类似物,即Krebs循环。结合最近的工作,作者研究发现在胺或氨的存在下,丙酮酸-乙醛酸缩合产物可通过逆-Claisen反应/Cannizzaro反应转化为稳定的α-酮戊二酸(图4a)。如图4b、4c所示,将丙二酸和乙醛酸的混合物置于含尿素的磷酸盐缓冲液中进行加热/干湿循环,生成了乙内酰脲(14, 32%)、天冬氨酸(16, 10%)、DHO(17, 14%)以及苹果酸(25,~2%)。由于草酰乙酸的前生物来源尚未得到解决,天冬氨酸和DHO的形成可能与草酰乙酸作为原料无关。
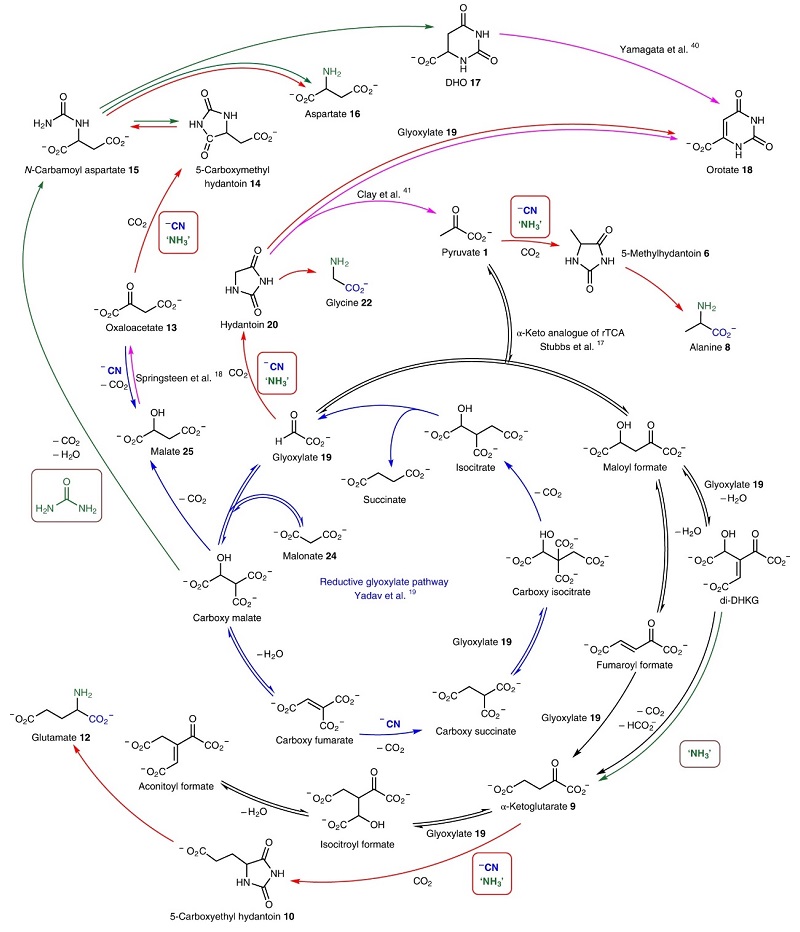
图4. Krebs cycle及其次级代谢物中发现的化合物。图片来源:Nat. Chem. 从醛开始的Strecker反应和从α-酮酸开始的Bucherer-Bergs反应形成α-氨基酸的过程,完善了相关的前生物化学,即利用相同的起始分子和反应物可通过不同途径来生成分子,但是仅有一些起始分子和反应具有向现代代谢途径转变的潜力,例如N-氨基甲酰基天冬氨酸的形成及其转化为DHO(图3c)。如果可以证实早期地球上酮酸在前生物化学途径中的作用,就可实现从原始氰化物/氨基化学到假定进化途径的下一步无缝过渡,进一步说明在“系统化学”复杂度的不同阶段,α-酮酸的反应具有潜力产生多种不同产物(图5)。虽然氨或氰化物可单独与α-酮酸/其缩合产物反应产生与Krebs途径相关的不同化学物质,但是这三者结合后产生了下一代产物:氨基酸和嘧啶核碱基前体(DHO和乳清酸),而其中一些产物可能会与原始反应途径发生相互作用,以促成反馈机制的出现,并导致反应的化学进化网络可过渡到原始生物系统。另外,上述情况中反应途径的各个阶段均会释放CO2,CO2也有重新参与反应循环的可能性,作者证实了通过加热促进丙酮酸释放的CO2对启动反应至关重要,这进一步强调了CO2存在的必要性。
图5. 多途径的出现增加系统化学的复杂性。图片来源:Nat. Chem. 总结 本文作者的发现支持了从α-酮酸到α-氨基酸和乳清酸的前生物合成,表明早期地球上常见的氰化物(CN-)、氨(NH3)和二氧化碳(CO2)就可能生成生命起源所必须的氨基酸和核碱基,并提出了一种新的范式来解释这种从前生物化学到如今生化途径的转变。 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):
Prebiotic synthesis of α-amino acids and orotate from α-ketoacids potentiates transition to extant metabolic pathways Sunil Pulletikurti, Mahipal Yadav, Greg Springsteen, Ramanarayanan Krishnamurthy Nat. Chem., 2022, DOI: 10.1038/s41557-022-00999-w 导师介绍 Ramanarayanan Krishnamurthy https://www.x-mol.com/university/faculty/678 (本文由吡哆醛供稿) 如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载! 点击分享 收藏 取消收藏 评论: 0 |
【本文地址】
| 今日新闻 |
| 推荐新闻 |
| 专题文章 |