| 磁共振对预测缺血性心肌病患者并发心源性猝死的原理和应用价值@MedSci | 您所在的位置:网站首页 › 投标报价明细表范本 › 磁共振对预测缺血性心肌病患者并发心源性猝死的原理和应用价值@MedSci |
磁共振对预测缺血性心肌病患者并发心源性猝死的原理和应用价值@MedSci
|
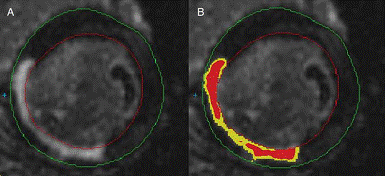
摘要:心肌瘢痕及瘢痕边缘区是缺血性心肌病患者产生心肌电不稳定并发心源性猝死的病理基质。通过心血管磁共振测定缺血性心肌病患者的心肌瘢痕及瘢痕边缘区的大小和比例,有助于此类患者并发心源性猝死的危险分层和预测。 冠心病是心源性猝死(sudden cardiac death, SCD)最常见的病因,所占比率可达80% [1] 。由冠心病导致心肌瘢痕形成的缺血性心肌病患者,SCD发生率明显升高 [2,3] 。射血分数降低是此类患者发生SCD的重要预测因子,但仍缺乏特异度和灵敏度 [4] 。目前SCD的预测主要是围绕心肌电不稳定机制展开,包括T波电交替、心率振荡和心率变异性等 [5] 。但是,对缺血性心肌病患者产生心肌电不稳定的病理基质,如心肌瘢痕、瘢痕边缘区的检测,同样能提供有效的预测价值。近些年来迅速发展的心血管磁共振(cardiac magnetic resonance,CMR)技术,由于其很高的组织分辨率和无创性等优点,能用于缺血性心肌病患者的心肌瘢痕及瘢痕边缘区的检测,帮助SCD的危险分层及预测。 心血管磁共振 (CMR) CMR应用早期,因为条件的限制,主要用于大体形态的检查。随着MR硬件和软件的不断改进,20世纪90年代初中期,MR已与超声心动图、CT、X线数字成像和放射性核素显像并列,成为现代心血管影像学的重要组成部分。MR具有大视野、多体位直接成像、无射线、高对比,以及高组织分辨力的优势。近年来,随着MR对时间和空间分辨力的不断提高,其对心血管疾病的诊疗发挥出越来越重要的作用。对比增强CMR已经被成功的用于慢性心肌梗死后无活性瘢痕区域的检测[6-8]。临床上曾使用过多种对比物质直到Gd-DTPA(二乙烯五胺乙酸钆)的出现。Gd-DTPA能迅速扩散出毛细血管外,但不能穿过完整的细胞膜。在正常心肌组织Gd-DTPA的分布很低;而在病理心肌,Gd-DTPA单位容积含量将增加[9]。结果病理心肌在CMR影像上表现为增强组织。因此,利用此特点,可对病理心肌组织如心肌瘢痕等进行检测。 CMR对预测缺血性心肌病患者并发心源性猝死的原理和应用 1 心肌瘢痕的检测 1.1 心肌瘢痕检测原理:缺血性心肌病的病理基础是心肌纤维化。应用高分辨离体心脏成像技术,陈旧性心肌梗死的强化区与组织学上所见的梗死区相一致[8]。心肌瘢痕为致密的胶原纤维组织,在细胞学水平上,胶原纤维间的间隙明显大于正常密集排列的存活心肌细胞的细胞外间隙。由于对比剂(如Gd-DTPA)在细胞外的分布容积增大,心肌瘢痕内的对比剂浓度可明显高于正常心肌。对比剂聚集使心肌瘢痕在CMR上表现为强化。 1.2 相关临床试验结果:经电生理检查能诱发室性心动过速的射血分数降低的患者存在发生SCD的高风险。Bello 等[10]的研究表明,对比增强CMR测定的梗死区域质量及其表面积,相比射血分数,能更好的鉴别经电生理检查可诱发出单形性室性心动过速的患者。在此研究中,48例平均射血分数为35%的冠心病患者,通过电生理检查进行猝死危险评估。18例患者在电生理检查中出现了持续的单形性室速。经增强CMR检测得出的梗死区域质量及其表面积,在诱发出单形性室速的患者明显大于没有诱发出室性心律失常的患者(质量:49g±5g 对 28g±5g,P<0.01;表面积:172cm2±15cm2 对 93cm2±14cm2,P<0.01)。射血分数值在诱发出单形性室速的患者低于没有诱发出单形性室速者,但两者差异没有达到统计学意义。进一步的Logistic回归分析表明梗死区域质量及其表面积,是患者经电生理检查能诱发室速的重要预测因子。Yokota 等[11]的研究中入选了86例平均射血分数为26%±12%的缺血性心肌病患者。在平均20个月的随访过程中,有33例患者发生了心血管事件。发生心血管事件的患者与没有发生心血管事件的患者相比,有更大的心肌瘢痕容积(16.8cm3±12.4cm3 对 11.7cm3±12.6cm3,P=0.023),而两者的左室射血分数值并没有显著差异(25%±10% 对 27%±13%)。作者认为心肌瘢痕容积相比左室射血分数能更好的预测缺血性心肌病患者的未来心血管事件。Kwon 等[12]的研究中入选了349例平均射血分数为24%的缺血性心肌病患者。平均随访2.6年,有51例患者死亡,5例患者进行了心脏移植术。心肌瘢痕和心肌组织的比值定义为瘢痕的心肌百分比,发生心血管事件的患者和没有发生事件的患者相比,他们平均的瘢痕心肌百分比值更高(39%±22% 对 30%±20%,P=0.003)。作者认为在射血分数严重低下的缺血性心肌病患者,通过增强CMR测定的心肌瘢痕有助于危险分层。 2 瘢痕边缘区的检测 2.1 瘢痕边缘区检测原理:瘢痕组织由边缘区及核心区构成。缺血性心肌病患者纤维化的瘢痕组织边缘区中,通常有存活的条束状心肌组织,后者与正常心肌组织相对电绝缘。这些条束状心肌组织提供了折返所需的缓慢传导通路,最终导致心律失常的发生。瘢痕边缘区在室性心律失常的发生中起着重要作用。通过增强CMR能对其进行测量。因为瘢痕边缘区中存在无活性的纤维组织及有活性的心肌细胞,在CMR影像上增强密度介于正常心肌组织和瘢痕核心区域之间。瘢痕边缘区的混合特性可以采用一定的算法将它分割出来并进行测量(图1)[13]。不同研究者在其研究中所采用的方法不同。Yan等[14]将信号密度大于正常心肌信号密度2个标准差以上的部位定义为瘢痕区,其中2至3个标准差之间的部位定义为边缘区,3个标准差以上的部位定义为核心区;Schmidt 等[15]和Heidary 等[16]则首先计算出瘢痕区最大信号密度及正常心肌最大信号密度,将大于正常心肌最大信号密度小于50%瘢痕区最大信号密度的部位定义为边缘区,将信号密度大于50%瘢痕区最大信号密度的部位定义为核心区;Roes 等[17]定义大于35%瘢痕区最大信号密度小于50%瘢痕区最大信号密度的部位为边缘区,大于等于50%瘢痕区最大信号密度的部位为核心区。 2.2 相关临床试验结果:Yan 等[14] 研究了144例平均射血分数为44%的心肌梗死后患者。该研究将瘢痕边缘区质量除以总瘢痕质量定义为边缘区百分比。经过2.4年的随访,有29例患者死亡。边缘区百分比大于百分比中位数的患者比边缘区百分比低于百分比中位数的患者,病死率显著增高(28% 对 13%,P<0.01),而两者的左室射血分数值没有显著差异(46%±17% 对 42%±16%)。作者认为边缘区百分比,是心肌梗死后患者死亡的独立预测因子,比左室射血分数能为心肌梗死后患者提供更好的危险预测价值。Schmidt 等[15]的研究中入选了47例心肌梗死后且平均射血分数低于35%的患者,评估了瘢痕边缘区对单形性室速诱发的预测价值。诱发出单形性室速与没有诱发出单形性室速的患者进行了瘢痕边缘区质量及射血分数等的比较。结果显示在诱发出单形性室速的患者有更大的瘢痕边缘区质量(19g±8g 对 13g±9g,P=0.015),而二者的左室射血分数值没有显著差异(30%±10% 对 29%±7%,P=0.79)。Logistic逐步回归分析表明瘢痕边缘区质量是单形性室速可诱发的唯一重要预测因子。Heidary 等[16]研究了70例平均射血分数为25%±11%的缺血性心肌病患者,随访结果发现有29例患者发生了心血管事件,发生心血管事件的患者有更大的瘢痕边缘区(中位数13.3g 对 8.0g,P=0.02),瘢痕边缘区的大小与未来心血管事件的发生密切相关。Roes 等[17] 的研究入选了91例植入ICD的缺血性心肌病患者,通过CMR检查评估左室射血分数、梗死组织异质性(存在瘢痕边缘区)等。平均随访8.5个月,18例患者发生了合理的ICD放电治疗。分析结果表明患者梗死边缘区是室性心律失常的强烈预测因子,能够指导ICD在缺血性心肌病患者的合理植入。左室射血分数值等指标的预测作用均不如梗死组织异质性好。 CMR具有大视野、多体位直接成像、无射线、高对比,以及高组织分辨力的优势,能够作为一种无创的方法来检测导致心律失常发生的瘢痕组织及瘢痕边缘区。通过相关研究表明增强CMR对缺血性心肌病患者SCD的预测具有一定的帮助,可以作为射血分数等预测指标的补充。它可能是目前最有前途的检测病理心肌组织及瘢痕的非侵入方法。随着研究的深入,这项新技术将可能对我们的临床提供更大的帮助。但是,迄今为止,我们得到的都是小样本临床研究结果,仍需要大规模多中心、随机的、前瞻性的研究验证CMR对缺血性心肌病患者并发SCD的预测价值。 参考文献 1 Huikuri HV, Castellanos A, Myerburg RJ. Sudden death due to cardiac arrhythmias[J]. N Engl J Med, 2001, 345(20):1472-1482. 2 Moss AJ, Zareba W, Hall WJ, et al. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med, 2002, 346(12): 877–883. 3 Bardy GH, Lee KL, Mark DB, et al. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med, 2005, 352(3):225–237. 4 Buxton AE. Identifying the high risk patient with coronary artery disease—is ejection fraction all you need? J Cardiovasc Electrophysiol,2005,16(1suppl):S25–S27. 5 S. Luke Kusmirek, Michael R. Gold. Sudden cardiac death: The role of risk stratification. Am Heart J, 2007, 153(4 Suppl): 25-33. 6 Wu E, Judd RM, Vargas JD, et al. Visualisation of presence, location, and transmural extent of healed Q-wave and non-Q-wave myocardial infarction. Lancet, 2001, 357(9249):21–28. 7 Fieno DS, Kim RJ, Chen EL, et al. Contrast-enhanced magnetic resonance imaging of myocardium at risk: distinction between reversible and irreversible injury throughout infarct healing. J Am Coll Cardiol, 2000, 36(6):1985-1991. 8 Kim RJ, Fieno DS, Parrish TB, et al. Relationship of MRI delayed contrast enhancement to irreversible injury, infarct age, and contractile function. Circulation, 1999, 100(19):1992-2002. 9 Flacke SJ, Fischer SE, Lorenz CH. Measurement of the gadopentetate dimeglumine partition coefficient in human myocardium in vivo: normal distribution and elevation in acute and chronic infarction. Radiology, 2001, 218(3):703-710. 10 Bello D, Fieno DS, Kim RJ, et al. Infarct morphology identifies patients with substrate for sustained ventricular tachycardia. J Am Coll Cardiol, 2005, 45(7):1104-1108. 11 Yokota H, Heidary S, Katikireddy CK, et al. Quantitative characterization of myocardial infarction by cardiovascular magnetic resonance predicts future cardiovascular events in patients with ischemic cardiomyopathy. J Cardiovasc Magn Reson, 2008, 10(1):17. 12 Kwon DH, Halley C, Carrigan TP, et al. Extent of left ventricular scar predicts outcomes in ischemic cardiomyopathy patients with significantly reduced systolic function: a delayed hyper-enhancement cardiac magnetic resonance study. J Am Coll Cardiol, 2009, 2(1):34–44. 13 Stefan de Haan, Paul Knaapen, Aernout M. Beek, et al. Risk stratification for ventricular arrhythmias in ischaemic cardiomyopathy:the value of non-invasive imaging. Europace, 2010, 12(4):468-474 14 Yan AT, Shayne AJ, Brown KA, et al. Characterization of the peri-infarct zone by contrast-enhanced cardiac magnetic resonance imaging is a powerful predictor of post-myocardial infarction mortality. Circulation, 2006,114(1):32-39. 15 Schmidt A, Azevedo CF, Cheng A, et al. Infarct tissue heterogeneity by magnetic resonance imaging identifies enhanced cardiac arrhythmia susceptibility in patients with left ventricular dysfunction. Circulation, 2007, 115(15):2006-2014. 16 Shahriar Heidary, Harendra Patel, Jaehoon Chung, et al. Quantitative Tissue Characterization of Infarct Core and Border Zone in Patients With Ischemic Cardiomyopathy by Magnetic Resonance Is Associated With Future Cardiovascular Events. J Am Coll Cardiol, 2010, 55(24):2762–2768. 17 Stijntje D. Roes, C. Jan Willem Borleffs, Rob J. van der Geest, et al. Infarct Tissue heterogeneity Assessed With Contrast-Enhanced MRI Predicts Spontaneous Ventricular Arrhythmia in Patients With Ischemic Cardiomyopathy and Implantable Cardioverter-Defibrillator. Circ Cardiovasc Imaging, 2009, 2(3):183-190.
图1(A)CMR在左室短轴上显示瘢痕组织 (B) CMR在左室短轴上显示瘢痕核心区域(红色)及瘢痕边缘区域(黄色) (引自Stefan de Haan et al. Risk stratification for ventricular arrhythmias in ischaemic cardiomyopathy:the value of non-invasive imaging. Europace, 2010, 12:468-474) 来源:上海瑞金医院 版权声明: 本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。同时转载内容不代表本站立场。 在此留言 |
【本文地址】