| 分享 | 您所在的位置:网站首页 › 应答方式有哪些 › 分享 |
分享
|
多糖疫苗到多糖结合疫苗 脑膜炎球菌和b型流感嗜血杆菌多糖疫苗开发期间进行的临床试验表明,针对两岁以下儿童的疗效非常低。类似的研究在肺炎球菌多糖疫苗中也进行了观察,尽管不同的血清型有所不同。因此由Landsteiner,Avery和Goebel提出的载体/半抗原观念再次被重视。多糖结合疫苗第一个临床前和临床报告是由NIH的John Robbins小组研制的Hib 多糖-蛋白质结合物。正是这样一个开创性的工作,第一批针对Hib的多糖蛋白结合疫苗在1987年至1990年期间获得上市许可。与此同时,针对肺炎球菌和脑膜炎球菌的大多数流行病学相关血清型的结合疫苗也开始了广泛研究,为其它多糖结合疫苗的上市许可奠定了有力的基础。
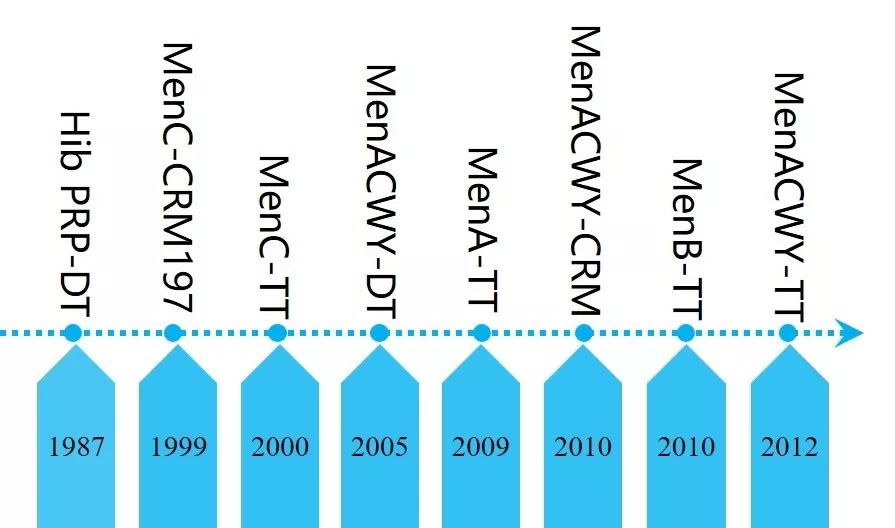
图1 脑膜炎球菌联合疫苗发展历史 表2 肺炎球菌结合疫苗发展历史
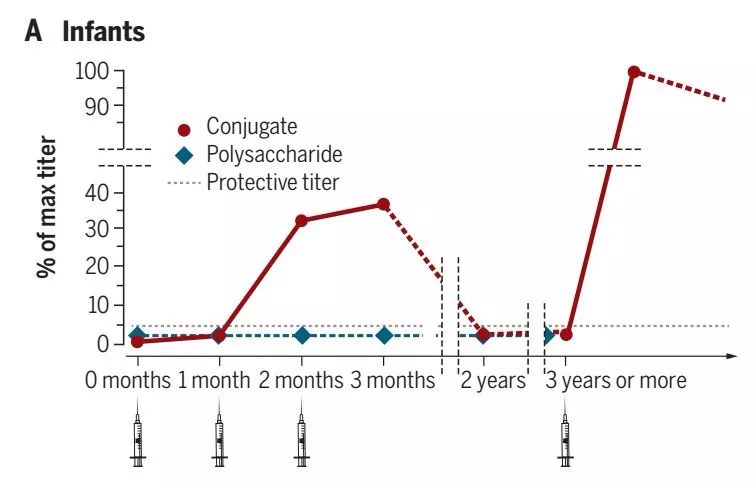
多糖蛋白结合疫苗的作用机制 多糖抗原是是T细胞非依赖性抗原,其能够通过交联B细胞受体(BCR)直接刺激B细胞分化成浆细胞(其产生抗体),然而这种机制在婴儿中并不成熟。在多糖蛋白结合疫苗中,蛋白质载体为T辅助细胞提呈提供T细胞表位,而多糖特异性B细胞识别的B细胞表位由糖部分提供。后者与BCR结合,然后在内化后,B细胞指导多糖蛋白结合物中的蛋白质部分多肽的合成,生成的多肽与主要组织相容性复合物(MHC)II类分子一起呈递给载体特异性T细胞。当B细胞接受T辅助细胞刺激后,开始增殖并分化成产生抗体的浆细胞,特别是IgG以及换成记忆B细胞。后者在以后遇到特异性抗原时,可快速增殖并分化成浆细胞,产生高抗体滴度。最近,基于对GBSIII-蛋白质结合物的研究,已经提出了新的机制,根据该机制,糖结合物在多糖特异性B细胞内被加工成聚糖-肽。聚糖-肽通过肽部分结合与MHC II类分子,暴露的聚糖部分被碳水化合物特异性T细胞克隆的T细胞受体识别,然后为B细胞提供同源帮助。根据这些机制,结合疫苗可以诱导T细胞依赖性反应并且从早期婴儿期开始具有免疫原性。 直观表现 糖蛋白结合疫苗的年龄依赖性免疫应答 对结合疫苗的免疫应答总结在图A中。在婴儿中,在第一次给药后几乎不能检测到抗体,并且在第二次给药后它们获得显着的保护性滴度。初次免疫系列的第三剂通常仅略微增加免疫应答。然后抗体水平随时间降低,但通常仍高于非免疫儿童。如果在3至5年后给予加强免疫,则抗体水平达到通常是初次免疫达到的最大滴度的3至10倍的滴度,表明初次免疫诱导记忆B细胞。与此形成鲜明对比的是,未结合的多糖疫苗在该年龄组中不能诱导任何反应。
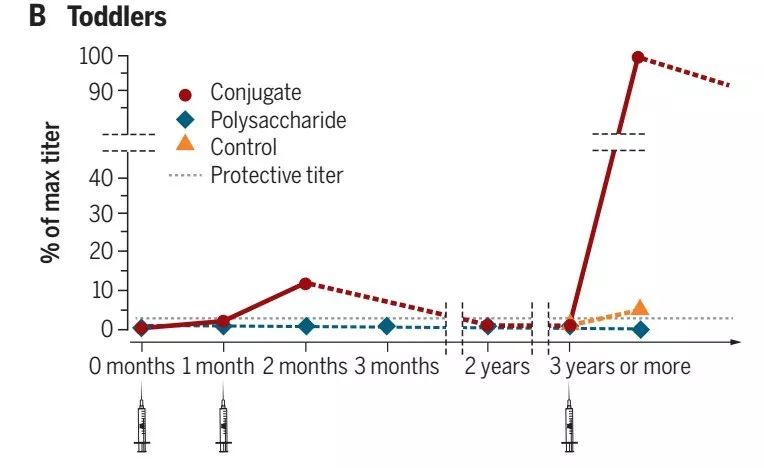
注:这里也有些例外,第一个是脑膜炎球菌A-未结合的多糖似乎具有免疫原性并在婴儿中诱导一些记忆;第二种是高效Hib疫苗,其中多糖与脑膜炎球菌B的外膜囊泡结合,在第一次给药后诱导高滴度的抗体,通过随后的免疫接种后无法增强。目前,我们不理解为什么这些疫苗表现不同。 在幼儿中,对结合疫苗的免疫反应与婴儿相似(图B)。接种第一剂之后几乎检测不到响应,在两次剂量后达到保护性滴度,然后随着时间的推移而降低但仍然高于非免疫幼儿的剂量。如果在三年或更长时间后给予加强剂量(对于先前用结合物和对照物进行免疫的那些)没有接种疫苗的组,然后是引发的队列中的抗体水平达到初次免疫诱导水平的3至10倍,而初始群组(对照组)的滴度非常低。因为当用异源载体给予加强时也观察到这一点,该结果证明初次免疫产生记忆B细胞,其现在能够通过分化成浆细胞以分泌抗体而快速响应。
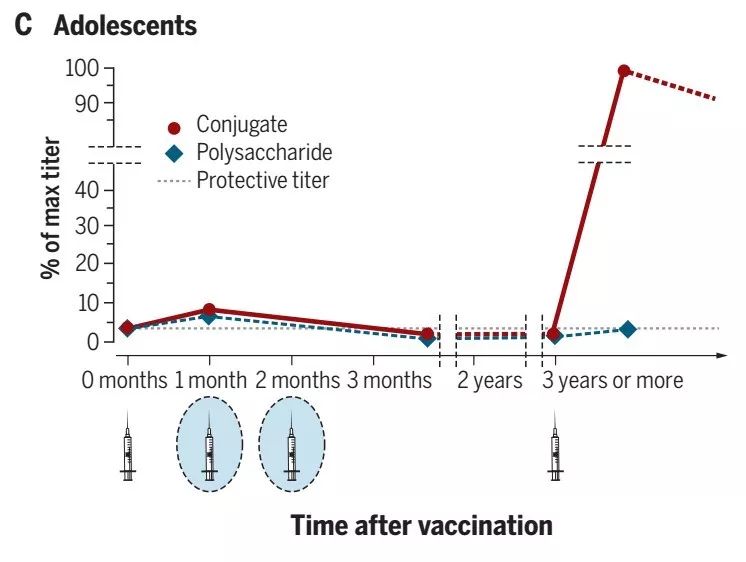
在青少年中,免疫反应是完全不同的(图C)。保护性抗体滴度不仅在第一次免疫后达到峰值并随时间降低,但也保持高于未接种疫苗的青少年。如果在第一次给药后三年或更长时间给予加强剂量,则抗体滴度增加至比第一次免疫诱导的剂量高5至10倍的水平。这个证实青少年中的一剂疫苗能够刺激记忆B细胞,后来能够迅速对加强免疫作出反应。在该年龄组中,多糖疫苗也能够诱导抗体应答。对多糖的反应与第一剂量后的结合物和峰的相似或略低。然而,如果给予加强剂量,则没有加强反应,并且抗体反应通常低于初次免疫的反应。这表明,在青少年中,多糖不是能够诱导记忆B细胞。有证据表明,用多糖免疫诱导记忆B细胞凋亡并减少对后续免疫的反应,这种现象称为低反应性。
小结 多糖蛋白结合疫苗在婴幼儿中能够产生良好的安全性和免疫原性,并且可以提供长期的保护作用。目前我国能够自产的多价多糖结合疫苗主要有A群C群脑膜炎球菌多糖结合疫苗(玉溪沃森、罗益无锡以及智飞绿竹)和AC-Hib(结合)联合疫苗(智飞绿竹),而肺炎疫苗国内只有多糖疫苗(玉溪沃森和成都生物公司的23价肺炎球菌多糖疫苗)。肺炎球菌结合疫苗研发进度最快的玉溪沃森的13价结合疫苗已经上市申请。相信随着疫苗研究的深入开展,更多质高价廉的多糖结合疫苗将为造福我国乃至世界范围的儿童做出重大贡献。 参考文献: [1] Dagan R, Poolman J, Siegrist C A. Glycoconjugate vaccines and immune interference: A review[J]. Vaccine, 2010, 28(34):5513-5523. [2] Micoli F, Adamo R, Costantino P. Protein Carriers for Glycoconjugate Vaccines: History, Selection Criteria, Characterization and New Trends[J]. Molecules, 2018, 23(6):1451. [3] Zahlanie Y C, Hammadi M M, Ghanem S T, et al. Review of meningococcal vaccines with updates on immunization in adults[J]. Human Vaccines, 2014, 10(4):995-1007. [4] Mccarthy P C, Sharyan A, Sheikhi L M. Meningococcal Vaccines: Current Status and Emerging Strategies.[J]. Vaccines, 20181, 6(1):12. [5] Rappuoli, R., Glycoconjugate vaccines: Principles and mechanisms. 2018,10(456). 版 权 声 明 版权为生物制品圈所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制品圈”。返回搜狐,查看更多 |
【本文地址】