| 布立西坦及中间体化合物的制备方法与流程 | 您所在的位置:网站首页 › 布瓦西坦中间体 › 布立西坦及中间体化合物的制备方法与流程 |
布立西坦及中间体化合物的制备方法与流程
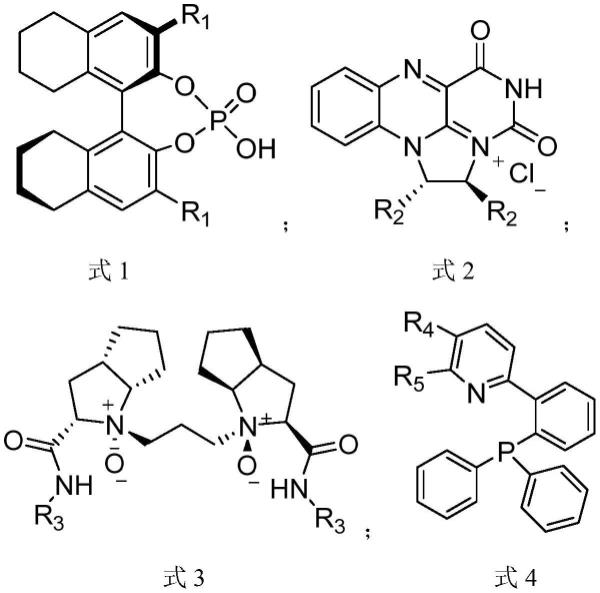 1.本发明属于化合物合成技术领域,具体涉及一种布立西坦及中间体化合物的制备方法。 背景技术: 2.布立西坦(brivaracetam)是一种第三代抗癫痫药物,属于新型的突触囊泡蛋白2a(sv2a)高亲和性配体,同时对电压依赖性钠离子通道有一定的抑制作用。2016年,布立西坦获得fda批准用于治疗癫痫发作,其对于全身性癫痫发作具有较好的疗效。3.布立西坦的结构式如下:[0004][0005]现有技术公开了多种布立西坦的合成方法,其流程总结如下:[0006]1、技术路线一:专利cn1882535a公布了一种布立西坦的合成制备方法,合成路线如下:[0007][0008]此路线在合成得到布立西坦消旋体后,利用色谱柱对其进行光学异构体纯化分离,从而获得光学纯的布立西坦。此路线存在的缺点有:需要丢弃至少一半的非对映异构体,原子经济性差,并且由于色谱柱价格昂贵且进样量有限,各光学异构体物理性质相近,因此采用色谱柱分离纯化效果较差,批量处理能力小、工业放大成本高,难以实现低成本大规模生产。[0009]2、技术路线二:benoit m.(j.med.chem.2004,47,530-549)报道了布立西坦的另一种合成方法,其技术路线如下:[0010][0011]此路线同样需要利用手性色谱柱对其进行光学异构体拆分。此路线存在的缺点有:需要丢弃至少一半的非对映异构体,原子经济性差,并且合成所得到的布立西坦消旋体纯度较低,需经过硅胶粗分离后才可进行重结晶,以得到纯度较高的布立西坦消旋体,之后,才能通过色谱柱层析对布立西坦消旋体进行分离。和技术路线一类似,由于色谱柱价格昂贵且分离效果有限,技术路线二的批量处理能力小、工业放大成本高,难以实现低成本大规模生产。[0012]3、技术路线三:中国医药工业研究总院周超的硕士论文《抗癫痫药布瓦西坦的合成研究》公开了一种布立西坦的合成制备方法,其合成路线如下:[0013][0014]但本路线存在如下缺点:1)步骤繁琐;使用噁唑烷酮作为手性诱导基团,其价格较高,且要经历装配和脱除步骤,经济成本较高;2)第二步需要-70℃的反应条件,反应条件较为苛刻,难以实现大规模生产;3)第三步使用双氧水,作为过氧化物有爆炸风险;4)第四步使用二甲硫醚硼烷,有爆炸风险,且具有刺鼻气味,有安全环保风险。[0015]如上,现有技术合成制备布立西坦的方法普遍存在如下缺点:[0016]1)合成消旋体后需进行柱层析分离:此路线需要丢弃至少一半的非对映异构体,原子经济性差;柱层析分离难度大,工业放大生产成本高。[0017]2)以噁唑烷酮作为手性诱导基团:步骤繁琐,反应条件苛刻;噁唑烷酮价格较高,且要经历装配和脱除步骤,成本较高。[0018]3)采用酶催化方法:所制得的终产物手性纯度过低,难以满足药用要求。[0019]4)反应条件苛刻,安全性低。[0020]因此,开发一种路线简洁、操作简便、成本低廉、安全且制得产物纯度高的布立西坦的制备方法具有重要意义。 技术实现要素: [0021]本发明的目的在于针对现有技术中存在的问题,提供一种新的布立西坦的制备方法,该方法路线简洁、步骤简短、成本低廉、安全且制得产物纯度高。[0022]为此,本发明第一方面提供了一种用于合成布立西坦的中间体化合物的制备方法,所述中间体化合物为(r)-4-丙基-二氢呋喃-2-酮,所述制备方法包括:[0023]使3-丙基环丁酮在催化剂和任选的氧化剂存在下进行不对称baeyer–villiger氧化反应,得到(r)-4-丙基-二氢呋喃-2-酮,反应式如下所示:[0024][0025]根据本发明的优选实施方式,所述催化剂选自如下式1和式2所示化合物中的至少一种;或所述催化剂为如下式3或式4所示化合物与金属的配合物,所述金属选自ib、iib、iiib、ivb、va、via和第viii族金属元素中的至少一种,优选选自sc,pd,ag,sb,rh,ru,mo,au,zn,cu,fe中至少一种;[0026][0027]其中,式1中r1为具有1-4个苯环的芳香基,例如苯基、萘基、蒽基、菲基,优选为苯基或菲基;[0028]式2中r2为苯基或c1-c6的烷基取代的苯基,优选3,5-二烷基苯基,例如3,5-二异丙基苯基;[0029]式3中r3为苯基或c1-c6的烷基取代的苯基;优选2,4,6-三烷基苯基,例如2,4,6-三异丙基苯基;[0030]式4中r4和r5各自独立地选自c1-c6的烷基且r4和r5可任选地形成五元环或六元环。[0031]根据本发明的一些实施方式,所述金属选自ib、iiib、va和第viii族金属元素中的至少一种,优选选自sc,pd,ag,sb中至少一种。[0032]根据本发明的一些优选的实施方式,式4中所述五元环或六元环为c1-c3烷基取代的五元环或六元环。[0033]根据本发明的一些优选的实施方式,式4中所述五元环或六元环上的任意碳原子之间通过至少一个碳桥连,桥连碳原子可任选地被c1-c3的烷基取代。在一些优选的实施例中,式4中所述五元环或六元环上的邻位碳原子之间通过至少一个碳桥连,例如2,3位碳原子之间通过一个碳桥连。在另一些优选的实施例中,式4中所述五元环或六元环上的间位碳原子之间通过至少一个碳桥连,例如3,5位碳原子之间通过一个碳桥连。[0034]根据本发明的一些优选的实施方式,式4所示化合物具有如下式5所示的结构:[0035][0036]其中,r6为c1-c3的烷基,优选为异丙基。[0037]根据本发明的一些优选的实施方式,式4所示化合物具有如下式6所示的结构:[0038][0039]其中,r7为h或c1-c3的烷基,例如(r)-c1-c3的烷基,如(r)-甲基或(r)-异丙基。[0040]根据本发明的一些实施方式,式1所示化合物选自如下化合物c1和化合物c2中的至少一种:[0041][0042]根据本发明的一些实施方式,式2所示的化合物选自如下化合物c3和化合物c4中的至少一种:[0043][0044]根据本发明的一些实施方式,式3所示的化合物选自如下化合物l1和化合物l2中的至少一种:[0045][0046]根据本发明的一些实施方式,式4所示的化合物选自如下化合物l3、化合物l4、化合物l5、化合物l6和化合物l7中的至少一种:[0047][0048]根据本发明的一些实施方式,所述式3或式4所示化合物与金属的配合物通过包含如下步骤的方法制得:[0049]将式3或式4所示化合物和所述金属的盐在溶剂中进行接触反应,得到所述配合物,可以理解的是,其中式3或式4所示化合物为配体化合物。[0050]根据本发明的一些实施方式,所述金属的盐选自所述金属的氯化盐、氟化盐或三氟甲烷磺酸盐中的至少一种。需要指出的是,本发明中所述金属的盐并不限于单一金属的盐,其也包括由至少两种金属离子构成的盐,例如复盐,具体的例子如agsbf6等。[0051]根据本发明的一些优选的实施方式,所述金属的盐选自sc(otf)3,pdcl2,(phcn)2pdcl2和agsbf6中的至少一种。[0052]优选地,所述式3或式4所示化合物与所述金属的盐的用量比以重量比计为(1~1.2):1。[0053]优选地,所述接触反应的温度为-10~40℃。[0054]优选地,所述接触反应的时间为1h~12h。[0055]根据本发明的一些实施方式,式3或式4所示化合物和所述金属的盐在有机溶剂中进行接触反应得到所述配合物,所述有机溶剂选自能使反应物溶解从而有效分散接触进行反应的溶剂例如乙酸乙酯、四氢呋喃等。所述有机溶剂的量没有特别限定,以能使充分溶解反应物为准。[0056]根据本发明的一些实施方式,所述不对称baeyer–villiger氧化反应中催化剂的用量为3-丙基环丁酮用量的1~10mol%。[0057]根据本发明的一些实施方式,所述氧化剂为间氯过氧苯甲酸、双氧水或过氧化脲。[0058]根据本发明的一些实施方式,所述氧化剂的用量为3-丙基环丁酮用量的100~150mol%。[0059]根据本发明的一些实施方式,所述不对称baeyer–villiger氧化反应在有机溶剂中进行,所述有机溶剂以能溶解反应物使进行充分接触反应为准,优选所述有机溶剂选自乙酸乙酯、四氢呋喃、异丙醚、甲苯、二氯乙烷、二氯甲烷、三氯甲烷和n,n-二甲基甲酰胺中的至少一种。所述有机溶剂的量没有特别限定,以能充分溶解反应产物为准。[0060]根据本发明的一些优选的实施方式,所述制备方法包括将3-丙基环丁酮与催化剂混合得到混合物,并将所得混合物与氧化剂混合进行反应。[0061]根据本发明的一些优选的实施方式,所述不对称baeyer–villiger氧化反应的温度为-40℃~-30℃,和/或,所述不对称baeyer–villiger氧化反应的时间为8h~24h。[0062]可以理解,所述制备方法还包括在所述反应后任选地进行淬灭,萃取和/或柱层析分离纯化的操作。具体可根据反应物和产物情况,采用本领域常规或已知的淬灭方法、萃取溶剂和柱层析分离方法,在此不做赘述。[0063]根据本发明的一些优选的实施方式,所述3-丙基环丁酮通过包含以下步骤的方法制得:[0064]s1、使1-戊烯与三氯乙酰氯在三氯氧磷和锌铜试剂的存在下混合进行第一反应,分离得到如下化合物5;[0065][0066]s2、使化合物5与酸和锌粉混合进行第二反应,分离得到3-丙基环丁酮,优选所述酸为醋酸、三氟甲磺酸或稀盐酸与醋酸的混合物。[0067]可以理解,步骤s1、步骤s2中在反应完全后还可以包括将形成产物分离出的步骤,包括但不限于过滤、沉淀、洗涤等及他们的任意组合。[0068]根据本发明的一些实施方式,步骤s1中,所述第一反应在第一有机溶剂中进行,所述第一有机溶剂以能溶解反应物使进行充分反应为准,优选所述第一有机溶剂选自乙醚、异丙醚,甲叔醚和四氢呋喃中的至少一种。[0069]根据本发明的一些实施方式,步骤s1中,所述三氯乙酰氯与1-戊烯的用量以摩尔比计为(0.8~1.2):1。[0070]根据本发明的一些实施方式,步骤s1中,所加入的三氯氧磷的量与1-戊烯的摩尔比为(1~1.2):1。[0071]根据本发明的一些实施方式,所述第一反应中,所加入的锌铜试剂的量以与1-戊烯的摩尔比计为(2~4):1。[0072]根据本发明的一些实施方式,步骤s1中,所述第一反应的温度为20℃~50℃。[0073]根据本发明的一些实施方式,步骤s1中,所述第一反应的时间为2h~12h。[0074]根据本发明的一些实施方式,步骤s2中,所述锌粉的用量与化合物5的质量比为(1~2):1。[0075]根据本发明的一些实施方式,步骤s2中,所述第二反应的温度为90℃~180℃。[0076]根据本发明的一些实施方式,步骤s2中,所述第二反应的时间为3h~9h。[0077]根据本发明,采用上述制备方法制备中间体化合物,方法简便、产物收率高,手性纯度高。[0078]本发明第二方面提供了一种布立西坦的制备方法,其包括以下步骤:[0079](1)采用本发明第一方面所述的制备方法制得中间体化合物(r)-4-丙基-二氢呋喃-2-酮;[0080](2)将中间体化合物(r)-4-丙基-二氢呋喃-2-酮与l-2-氨基丁酰胺进行混合反应得到布立西坦;[0081][0082]根据本发明的一些实施方式,步骤(2)中,所述混合反应在第二有机溶剂中进行,所述第二有机溶剂选自甲苯,dmso,n-甲基吡咯烷酮和dmf中的至少一种。[0083]根据本发明的一些优选的实施方式,所述第二有机溶剂为甲苯与dmf的混合物,优选所述混合物中甲苯与dmf的体积比为1:(0.5~3)。[0084]根据本发明的一些实施方式,所述混合反应的温度为100℃~180℃。[0085]根据本发明的一些实施方式,所述混合反应的时间为12h~48h。[0086]根据本发明的一些优选的实施方式,步骤(2)中还包括在混合反应后除去溶剂,洗涤,干燥和重结晶的步骤。[0087]根据本发明的一些优选的实施方式,所述重结晶所用溶剂为正庚烷和乙酸异丙酯的混合物,所述正庚烷和乙酸异丙酯的混合物中正庚烷和乙酸异丙酯的体积比为1:(3~8)。[0088]本发明另一方面还提供了如本发明第一方面所述的制备方法制得的中间体化合物和本发明第二方面所述的制备方法制得的布立西坦。[0089]本发明中,c1-c6的烷基包括甲基、乙基、丙基、异丙基、正丁基、异丁基、正戊基、异戊基、新戊基、正己基、异己基等。[0090]本发明中,c1-c3的烷基包括甲基、乙基、丙基、异丙基。[0091]根据本发明,本发明的制备方法路线简洁、步骤简短、成本低廉、安全且制得的布立西坦原料药杂质少,手性纯度高。本发明方法经金属催化的不对称baeyer–villiger氧化,低成本、经济高效、绿色环保地合成(r)-4-丙基-二氢呋喃-2-酮,在此基础上可制备高光学纯度的布立西坦原料药,仅经4步,即可制备得到满足药用要求的布立西坦原料药,避免了传统工艺中所用到的手性拆分和繁琐的分离提纯,适用于工业生产,具备显著的成本优势。[0092]本发明方法还具有以下优点:[0093](1)首次提供了金属催化的不对称baeyer–villiger氧化反应在制备(r)-4-丙基-二氢呋喃-2-酮中的应用。[0094](2)提供了一种制备(r)-4-丙基-二氢呋喃-2-酮的方法,该方法使用金属催化剂进行催化,反应条件温和,获得的日标产物ee值可达99%。[0095](3)本发明公布一种布立西坦制备的简便方法。(r)-4-丙基-二氢呋喃-2-酮在合适条件下和l-2-氨基丁酰胺反应,仅需一步即可制得布立西坦。附图说明[0096]图1为实施例1中制得的化合物1的1h nmr图。[0097]图2为实施例1中制得的化合物1的13c nmr图。[0098]图3为实施例2中制得的(r)-4-丙基-二氢呋喃-2-酮的1h nmr图。[0099]图4为实施例2中制得的(r)-4-丙基-二氢呋喃-2-酮的13c nmr图。[0100]图5为实施例2中制得的(r)-4-丙基-二氢呋喃-2-酮的光学纯度测定图,(r)-4-丙基-二氢呋喃-2-酮的保留时间为21.807min,其光学异构体的保留时间为22.810min。[0101]图6为实施例6图中制得的布立西坦的1h nmr图。[0102]图7为实施例6图中制得的布立西坦的13c nmr图。具体实施方式[0103]根据本发明,“任选的”可以指含有或不含有,亦可指加入或不加入。[0104]为使本发明更加容易理解,下面将结合实施例和附图来详细说明本发明,这些实施例仅用于说明本发明,而不应被视作对本发明的范围的限定。实施例中未注明具体条件者,按照常规条件或者制造商建议的条件进行。实施例中所用材料如无特殊说明,均为市售产品或可通过已知方法合成的常规产品。[0105]在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。[0106]本发明实施例的数据通过如下方法获得:[0107]1、1h-nmr和13c-nmr图谱通过将样品溶解于氘代氯仿后于varian inova-400仪器上测定;[0108]2、(r)-4-丙基-二氢呋喃-2-酮的手性纯度通过hplc(正相)测定,所用色谱柱为(lipodex e 25m×0.25mm)。[0109]实施例1[0110]化合物1的制备[0111][0112]将三氯乙酰氯(2.24ml,20mmol)与三氯氧磷(1.02ml,11.0mmol)溶于乙醚(10ml)中,之后将此溶液缓慢滴入装有1-戊烯(1.09ml,10mmol)、乙醚(20ml)和锌铜试剂(zinc-copper couple,cas#:53801-63-1,1.96g,30.0mmol)的烧瓶中。加热到40℃搅拌反应2小时,之后自然冷却到室温搅拌反应8小时。之后将此溶液用硅藻土过滤,滤液中加入正己烷80ml以沉淀出氯化锌盐。过滤得到澄清溶液,再用水,饱和碳酸氢钠溶液和饱和食盐水依次洗涤,无水硫酸钠干燥,减压浓缩,蒸除溶剂,得淡黄色油状物(化合物5)(1.69g),收率94%,直接进行下一步反应。[0113]将化合物5(1.69g)溶于醋酸10ml中,加入锌粉2.4g,室温搅拌反应2小时,之后升温至100℃反应6小时。冷却至室温后加入水20ml稀释,之后使用乙醚(20ml)萃取。有机相用饱和碳酸氢钠溶液和饱和食盐水洗涤,无水硫酸钠干燥,溶液过硅胶闪柱之后得无色油状物(化合物1)(0.97g),收率92%,直接进行下一步反应。[0114]化合物1的结构数据结果:[0115]nmr氢谱(图1):1h nmr(400mhz,chloroform-d)δ4.42–4.34(m,1h),3.93–3.83(m,1h),2.66–2.45(m,2h),2.22–2.07(m,1h),1.50–1.39(m,2h),1.31(dddd,j=14.4,7.1,5.9,3.0hz,2h),0.90(t,j=7.2hz,3h)。[0116]nmr碳谱(图2):13c nmr(151mhz,chloroform-d)δ177.31,73.40,35.44,35.17,34.47,20.53,13.91。[0117]实施例2[0118]化合物2的制备[0119][0120]将配体化合物l2 0.39g和三氟甲烷磺酸钪0.24g溶解于100ml的乙酸乙酯中,于35℃条件下搅拌1小时,得浓度为0.005m的催化剂1sc(otf)3-rapr3的乙酸乙酯溶液。[0121]向氮气保护的干燥反应瓶中加入化合物1 112mg(1.0mmol),以及如上述制备的催化剂1溶液10ml(0.05mmol)。加入乙酸乙酯10ml后,降温至-20℃加入间氯过氧苯甲酸207mg(1.2mmol),反应在-20℃继续搅拌20小时。之后加入饱和碳酸钾溶液淬灭反应,反应液用二氯甲烷萃取3次。经硅胶正相柱层析分离得纯品化合物2,收率83%,手性纯度99.8%。[0122]化合物2的结构数据结果:[0123]nmr氢谱(图3):1h nmr(400mhz,chloroform-d)δ=4.42–4.34(m,1h),3.93–3.83(m,1h),2.66–2.45(m,2h),2.22–2.07(m,1h),1.50–1.39(m,2h),1.31(dddd,j=14.4,7.1,5.9,3.0hz,2h),0.90(t,j=7.2hz,3h)。[0124]nmr碳谱(图4):13c nmr(151mhz,chloroform-d)δ=208.9,52.7,38.6,23.8,21.5,14.0。[0125]实施例3[0126]化合物2的制备[0127][0128]向装有(phcn)2pdcl2(10mg,0.025mmol,5.0mol%)和配体化合物l7(13mg,0.0275mmol,5.5mol%)的瓶中加入2ml干燥四氢呋喃,并于室温下搅拌1小时。再加入agsbf6(17mg,0.05mmol,10mol%),继续搅拌1小时,过滤,得到催化剂2的溶液。向滤液中加入化合物1(56mg,0.5mmol),搅拌下将反应液冷却至-40℃之后,加入过氧化脲(61mg,0.65mmol),保温-40℃搅拌8小时。加压浓缩,经柱分离得纯品化合物2,收率72%,手性纯度98.6%。[0129]实施例4[0130]化合物2的制备[0131][0132]氮气保护下,将化合物c2(7.6mg,10mol%,0.01mmol)和化合物1(11.2mg,0.1mmol)溶于1ml chcl3。搅拌条件下,将溶液降温至-40℃,加入17mg双氧水(30%,0.15mmol)。保持低温-40℃,继续搅拌24小时。反应完成后,使用亚硫酸钠淬灭反应。二氯甲烷萃取,无水硫酸镁干燥,减压浓缩。经柱层析得化合物2。收率86%,手性纯度97.8%。[0133]实施例5[0134][0135]将化合物1 1.12g(0.01mol)和化合物c4(0.56g,0.001mol)溶于10ml氯仿后,将溶剂冷却至-40℃。将氢化奎尼定1,4-(2,3-二氮杂萘)二醚(1.56g,0.002mol)和双氧水(30%,1.7g,0.015mol)先后加入。搅拌反应24小时后,使用硫代硫酸钠淬灭反应。二氯甲烷萃取,无水硫酸镁干燥,减压浓缩。经柱层析得化合物2。收率93%,手性纯度99.1%。[0136]实施例6[0137]化合物6的制备[0138][0139]通过实例2所述方法制得化合物2后,称量10g化合物2溶于甲苯和dmf的混合溶剂(甲苯:dmf为20ml:40ml)中,室温下加入l-2-氨基丁酰胺10.37g。升温至100℃搅拌6小时。经hplc监测,化合物2反应完全。减压浓缩蒸除溶剂,得粘稠油状粗品。将粗品溶于二氯甲烷60ml中,有机相用饱和碳酸氢钠溶液和饱和食盐水洗涤,无水硫酸钠干燥。经正庚烷:乙酸异丙酯(体积比1:1)重结晶,即可得高纯度布立西坦(化合物6)12.4g,产物液相纯度高达99.2%。[0140]化合物6的结构数据结果:[0141]nmr氢谱(图6):1h nmr(400mhz,chloroform-d)δ6.20(s,1h),5.36(s,1h),4.44(dd,j=8.8,6.9hz,1h),3.49(dd,j=9.8,7.8hz,1h),3.01(dd,j=9.8,7.0hz,1h),2.59(dd,j=16.8,8.6hz,1h),2.34(p,j=7.7hz,1h),2.08(dd,j=16.8,8.0hz,1h),1.95(dp,j=14.5,7.4hz,1h),1.77–1.61(m,2h),1.47–1.38(m,2h),1.36(dd,j=6.9,4.8hz,1h),1.34–1.23(m,2h),0.91(td,j=7.3,2.7hz,6h)。[0142]nmr碳谱(图7):13c nmr(151mhz,chloroform-d)δ175.70,171.89,55.97,49.53,37.86,36.59,31.85,20.75,20.52,13.99,10.43。[0143]应当注意的是,以上所述的实施例仅用于解释本发明,并不构成对本发明的任何限制。通过参照典型实施例对本发明进行了描述,但应当理解为其中所用的词语为描述性和解释性词汇,而不是限定性词汇。可以按规定在本发明权利要求的范围内对本发明作出修改,以及在不背离本发明的范围和精神内对本发明进行修订。尽管其中描述的本发明涉及特定的方法、材料和实施例,但是并不意味着本发明限于其中公开的特定例,相反,本发明可扩展至其他所有具有相同功能的方法和应用。 |
【本文地址】