| 预灌封注射器生物相容性试验新方法的建立与可行性分析 点击上方的 行舟Drug ▲ 添加关注 预灌封注射器是一种既可以储存药物又具备给药功能的新型药品包装容器,主要用于抗血栓... | 您所在的位置:网站首页 › 塑料组件相容性实验 › 预灌封注射器生物相容性试验新方法的建立与可行性分析 点击上方的 行舟Drug ▲ 添加关注 预灌封注射器是一种既可以储存药物又具备给药功能的新型药品包装容器,主要用于抗血栓... |
预灌封注射器生物相容性试验新方法的建立与可行性分析 点击上方的 行舟Drug ▲ 添加关注 预灌封注射器是一种既可以储存药物又具备给药功能的新型药品包装容器,主要用于抗血栓...
|
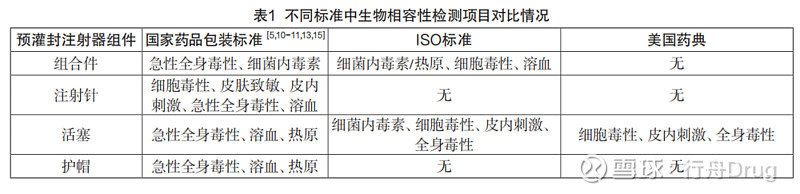
来源:雪球App,作者: 行舟Drug,(https://xueqiu.com/4396147139/247011522) 点击上方的 行舟Drug ▲ 添加关注 预灌封注射器是一种既可以储存药物又具备给药功能的新型药品包装容器,主要用于抗血栓药、疫苗及生物工程药物的包装。其优点体现在:与药物具有良好的相容性;减少了药物在存储和转移过程中因吸附造成的浪费;使用机器灌装技术,药物定量更精确;避免因加入稀释液反复抽吸造成的二次污染;操作简便,适用于急诊患者等[1]。由于预灌封注射器的临床应用存在与血液、体液直接接触的风险,因此需要重视其生物学安全性[2]。本文从制作工艺、材料、与人体接触风险以及国内外生物学评价标准的差异等方面对预灌封注射器进行了系统分析,探讨将预灌封注射器作为一个系统进行生物相容性试验的可行性。 一、预灌封注射器背景 1.1 预灌封注射器发展历程 预灌封注射器起源于20世纪80年代[3]。我国的第一支预灌封注射器于2005年生产。随着人们对生命健康越来越重视,以及预灌封注射器具有安全可靠、操作方便等多方面优点,因此预灌装注射器的应用前景越来越广阔。 1.2 预灌封注射器的分类和组成 预灌装注射器按照针筒的材质分为塑料和玻璃两类,按照是否带注射针又分为带注射针和不带注射针两类。不带针的预灌封注射器还可细分为锥头式和螺旋头式。锥头式由玻璃针管、橡胶活塞、锥头护帽和推杆组成;螺旋头式由玻璃针管、橡胶活塞、螺旋头护帽、螺旋头和推杆组成[4]。 二、预灌封注射器风险点 2.1 不锈钢注射针 预灌封注射器上的不锈钢注射针主要用于人体皮内、皮下、肌肉、静脉等注射用[5]。UV胶多用作预灌封注射器针头黏合剂,通常由甲基丙烯酸类化合物组成。甲基丙烯酸对眼睛、皮肤、呼吸道等有较强的刺激性[6-7],UV胶会长时间接触到药液,直接影响药液的质量安全[8]。注射针的潜在危害主要包括生物污染(热原、细菌)和微粒污染。根据GB/T 16886.1-2022《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》中的规定,注射针需要进行生物学评价[9]。 2.2 橡胶活塞 橡胶活塞分为氯化丁基橡胶活塞和溴化丁基橡胶活塞,分为扣合式(PSL)或螺纹式(PT)两种。胶塞的质量要求包括:不能含有铅、汞、砷、钡等有毒的可溶性化合物;不与所装药物起作用,破坏药剂的效果和影响药剂的澄清度;胶塞表面不能有析出物,如游离硫、蜡等其他一切有机物质;胶塞表面应光滑,不得有裂缝、气泡和其他杂质异物存在,表面要有一定的润滑性,能在自动分装机上运行;胶塞应具有一定的弹性,按规定的针刺数穿刺后不掉屑,并仍能保持原有的密封性[10-11]。由于橡胶活塞与药液(或生理盐水)直接接触,因此在生产和贮存过程中不能迁出小分子或有机物等,以免污染药品对人体产生危害,需对橡胶活塞的安全性进行生物学评价。 2.3 注射器针管 预灌封注射器所用针管分为玻璃针管(硼硅玻璃)和塑料针管(COP),玻璃针管和塑料针管各有优势。玻璃针管使用历史较久,针管内部涂有用于润滑作用的硅油,在给药时帮助活塞活动。而残余的硅油长期与药物接触可能会产生相容性问题[12-13]。塑料针管的优点主要是轻便、不易碎,但塑料针管均为高分子材料,理化性质不如玻璃稳定,且部分高分子材料具有潜在的生物学风险[14]。 2.4 针头护帽 针头护帽是一种套在针头外部用于防止使用者被刺伤以及针头受到污染的保护性装置。我国相关的标准规定预灌封注射器组合件中必须包含针头护帽[15-16]。预灌封注射器使用的护帽为橡胶针头护帽,以聚异戊二烯为主要原料,加入填充剂、硫化剂、增塑剂、抗碱剂等辅料,对药物及人体组织应无潜在毒性。 三、预灌封注射器生物相容性检测现状 3.1 国内外标准 自1992年以来,国内外陆续颁布了关于预灌封注射器的检验标准,国家药包材标准(2015版)中规定了组合件中的玻璃针管、橡胶活塞、不锈钢注射针和针头护帽以及组合件的相关检测要求。ISO11040系列国际标准对各种预灌封注射器作了比较详细的要求,但没有对预灌封注射器中的注射针及护帽进行规定。美国药典中只是对预灌封注射器相应的组件进行了通用的要求[17]。 3.2 国内外生物相容性检测项目对比 目前国内外关于预灌封注射器不同部件所要进行的生物相容性检测项目有所不同。表1列举出了国家药品包装标准、国际标准、美国药典中生物相容性检测项目的对比情况。 四、国内预灌封注射器生物相容性试验存在的问题
从表1中可以看出,从试验项目设置来看,不锈钢注射针、橡胶活塞及针头护帽都需要进行溶血试验。根据相应的国家药品包装标准,各部件在进行溶血试验时应采用直接法进行试验[18]。但不锈钢注射针、针头护帽、橡胶活塞和血液一般不存在直接接触的情况,因此采用间接法更符合临床应用。在不锈钢注射针进行的皮肤致敏、细胞毒性和皮内刺激试验中,供试液的制备方式为取25支加250mL氯化钠注射液。该样品制备方式未考虑活塞和针管直接与药液接触可能引起的风险,且与临床应用不相符,不能真实体现预灌封注射器的临床使用风险。 从试验部件来看,目前只有不锈钢注射针进行了皮肤致敏、细胞毒性和皮内刺激试验,但却未规定热原试验或细菌内毒素试验。橡胶活塞临床应用风险较高且有资料表明有一定的细胞毒性风险,但未规定皮肤致敏、细胞毒性和皮内刺激试验,而针头护帽仅仅与注射针接触,不存在与人体和药液接触的风险,却规定了急性全身毒性、溶血和热原试验。因此,目前预灌封注射器进行生物相容性试验的试验部件并不能体现真实的临床使用风险。 五、预灌封注射器生物相容性试验新方法的建立 通过对比国内外相关法规和标准,可见目前制定的标准中大多要求将预灌封注射器各部件单独进行试验,且不同的法规和标准要求进行试验的部件不同,如国家药品包装标准规定不锈钢注射针应进行细胞毒性、皮肤致敏、皮内刺激、急性全身毒性和溶血试验,但ISO 11040系列标准和美国药典对不锈钢注射针并无特殊要求,而ISO 11040系列标准和美国药典对活塞均要求进行皮内刺激和细胞毒性试验,但国家药品包装标准则不要求对活塞进行皮内刺激和细胞毒性试验。目前有资料表明橡胶活塞作为预灌封注射器的高性能配件,在生产和贮存过程中会和所包装的药品直接接触,因此应当对预灌封注射器活塞的皮内刺激和细胞毒性进行检测[19-21]。 目前国内的药品包装标准对整个预灌封注射器的生物相容性试验只局限于对其产品部件的检测,只考虑了由材料引起的危害,从而忽视了预灌封注射器组合件的生物学风险。因此,应依据预灌封注射器的临床用途,将预灌封注射器作为一个整体来评估其潜在的生物学危害,可以参考GB/T16886.1-2022中对于一次性使用无菌注射器推荐的生物相容性试验。由于预灌封注射器在生产过程中大多将药液充满公称容量后贮存,因此在进行样品制备时也可选择将浸提介质充满预灌封注射器的内腔后制备样品的试验液,这样更能模拟预灌封注射器的临床应用情况。 六、预灌封注射器生物相容性试验新方法的可行性分析 从试验项目来看,在包括溶血试验在内的各项生物相容性试验的供试液制备中,新方法参照GB/T16886.12-2017将浸提介质充满预灌封注射器内腔进行整体浸提,取浸提液作为各项试验的供试液。例如在溶血试验中可以取浸提液10mL加入兔血进行后续的试验[22]。这种供试液制备方式充分考虑预灌封注射器各部件与药液接触和与人体接触的风险,更符合预灌封注射器的临床预期应用,试验过程更为合理。 预灌封注射器的所有部件中,只有不锈钢注射针与人体直接接触,而护帽、针管和橡胶活塞均只与药液直接接触,因此生产过程中使用的添加剂、化学助剂等有可能向药液迁移,影响药液的安全性和稳定性,因此也需要进行生物相容性试验[23-27]。我们随机选取A和B两个厂家检验合格的预灌封注射器组合件,将浸提介质充满预灌封注射器内腔进行样品制备和生物相容性试验。结果表明两批次不同厂家的预灌封注射器组合件均符合相应的标准要求,因此以新方法代替现行的测试方法具有可行性。 七、讨论 现行的预灌封注射器的国家药品包装标准要求对预灌封注射器的各部件分开进行试验,对于组合件的生物相容性试验项目仅要求进行急性全身毒性试验和细菌内毒素试验,且各部件进行的试验项目并不统一,这样既会造成不必要的浪费,也不能真实反映预灌封注射器的临床应用风险。预灌封注射器和一次性使用无菌注射器在临床应用和加工贮存等方面具有很多的相同点,而GB 15810-2019《一次性使用无菌注射器》规定了注射器要进行细胞毒性、皮肤致敏、皮内刺激、急性全身毒性、溶血、热原(细菌内毒素)试验,同时该标准在引言中明确提出,如果注射器自身配套注射针,测试化学性能和生物性能时应连同注射针制备萃取液[28]。此外YY/T 0243-2016《一次性使用注射器用活塞》中同样规定了细胞毒性、皮肤致敏、皮内刺激、急性全身毒性、溶血、热原(细菌内毒素)等检测项目[29]。可以看出国内关于一次性使用无菌注射器的标准中,与药液存在直接接触的部件规定了一致的检测项目。同时本实验室的对比试验结果也表明,将预灌封注射器各部件分别进行试验与整体进行试验得出的试验结果均为合格,无明显差异。 综合以上分析可知,所建立的生物相容性试验方法可以充分考虑预灌封注射器各部件与人体接触的风险,同时可以提高检测效率,降低成本,符合动物福利的3R原则要求,因此,该方法具有实际可行性。
学如逆水行舟,不进则退; 心似平原走马,易放难收。
行舟Drug 每日更新 欢迎订阅+ 医药大数据|行业动态|政策解读 |
【本文地址】