| 生物分析专栏 | 您所在的位置:网站首页 › 基因相关的概念 › 生物分析专栏 |
生物分析专栏
|
来源:雪球App,作者: 医药魔方,(https://xueqiu.com/8965749698/222878931) 基因治疗的概念始于20世纪60年代和70年代初,是使用正常有功能的基因替代或修正缺陷基因,即将外源性的、有特定功能的遗传物质转移到机体内,达到治疗疾病的目的。近年来基因治疗领域发展迅速,在基础研究和产业转化方面均取得了重大突破,而AAV是基因治疗中一种重要的递送载体。 腺相关病毒(Adeno-associated virus,AAV)属于细小病毒科的低致病性病毒。腺相关病毒载体是以AAV基因组为骨架改造而来的基因递送工具。与慢病毒载体、腺病毒载体、逆转录病毒载体等其他常用病毒载体相比,AAV载体具有高安全性、低免疫原性、宿主细胞范围广(感染分裂和非分裂细胞)、易生产、高穿透性、长时表达、定点整合等优点,被认为是“最有前景的基因治疗载体”。
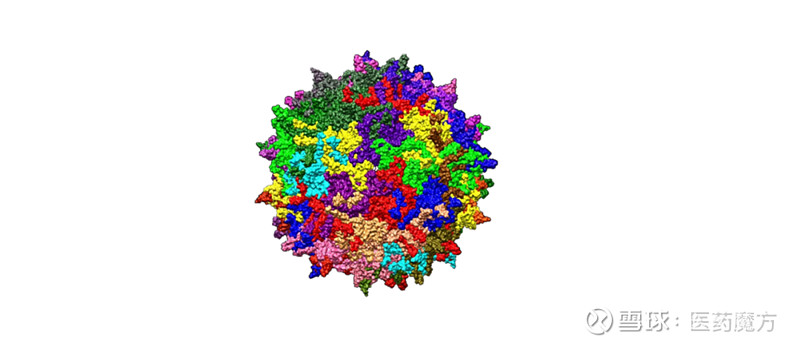
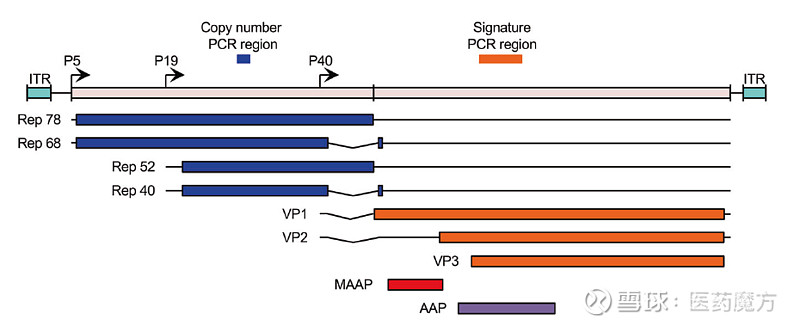
图1 AAV结构示意图,来源Wikipedia AAV简介 AAV的基因组为线性单链DNA,大小约4.7kb。在基因组两端分别有一条反向末端重复序列(Inverted terminal repeat,ITR),其中的D序列与病毒基因组高效释放、选择性复制和包装密切相关。基因组编码区有4个开放阅读框,分别编码Rep蛋白、Cap蛋白、MAAP蛋白和AAP蛋白,它们分别在基因组复制、病毒装配以及包装中发挥着作用。在设计AAV载体基因组时,需要将编码区基因序列替换为目的基因和相关功能片段,仅保留两端反向末端重复序列。在其生产时采用三质粒共转染法。
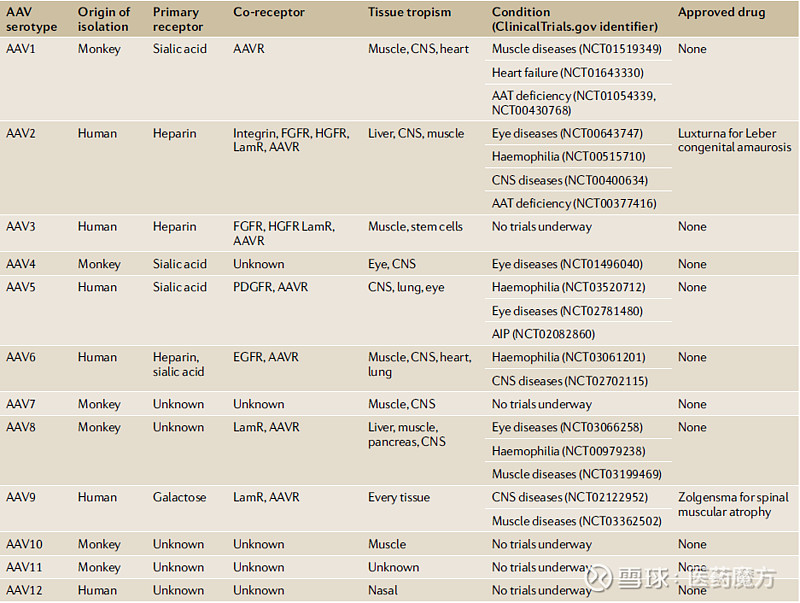
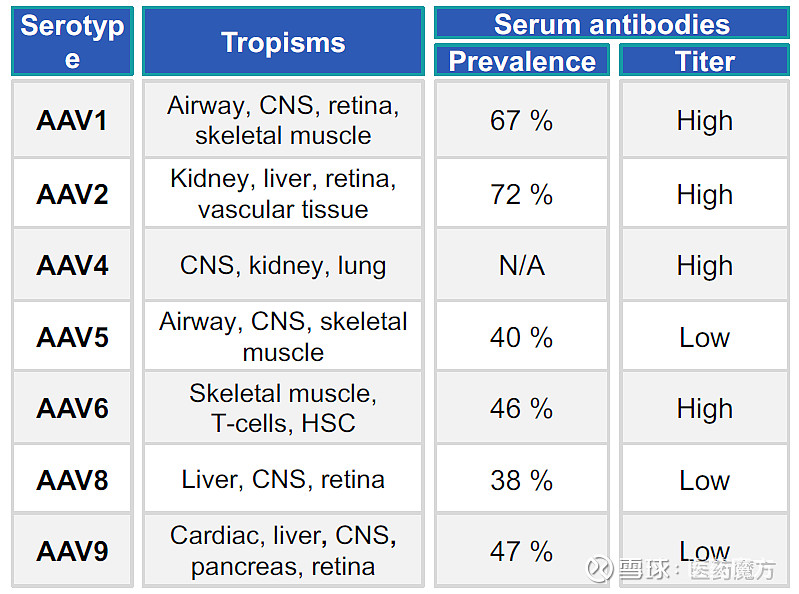
图2 AAV基因组示意图和用于PCR筛选的位点[1] AAV病毒为无包膜结构,其病毒表面由衣壳蛋白VP1,VP2,VP3按1:1:10比例组成。衣壳蛋白的不同突变型产生了不同的AAV亚型,按血清试验结果可以分为不同血清型,目前已有13种AAV血清型(AAV1~AAV13)。而不同的AAV血清型靶向不同的受体,具有不同的组织嗜性。 表1 不同血清型AAV受体组织嗜性及临床应用[2]
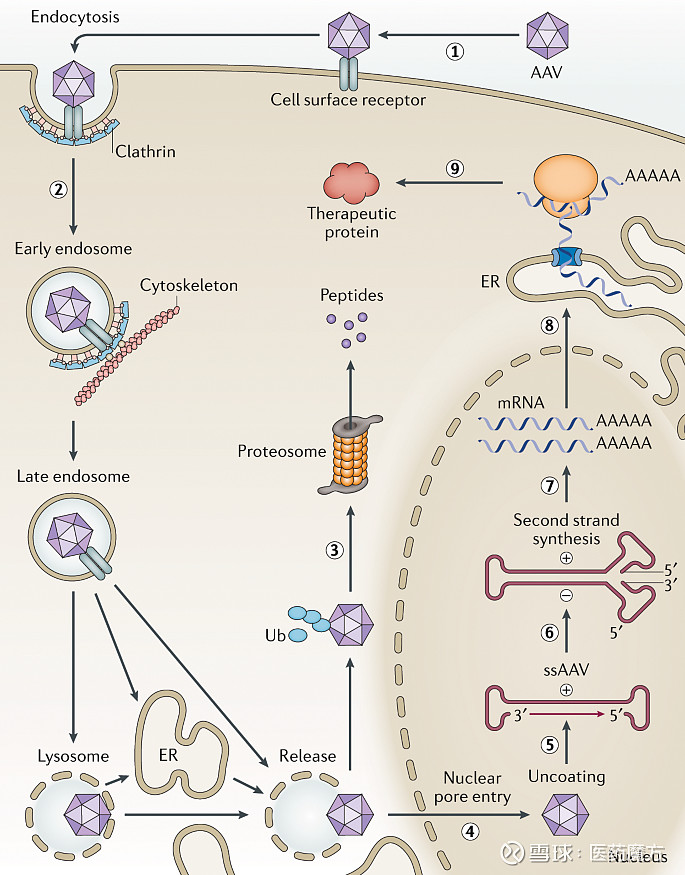
补充:2012年EMA批准的Glybera为AAV1载体 AAV在体内发挥作用的示意图如下所示,AAV被宿主细胞表面的受体识别,通过网格蛋白(Clathrin)介导的内吞作用进入细胞。
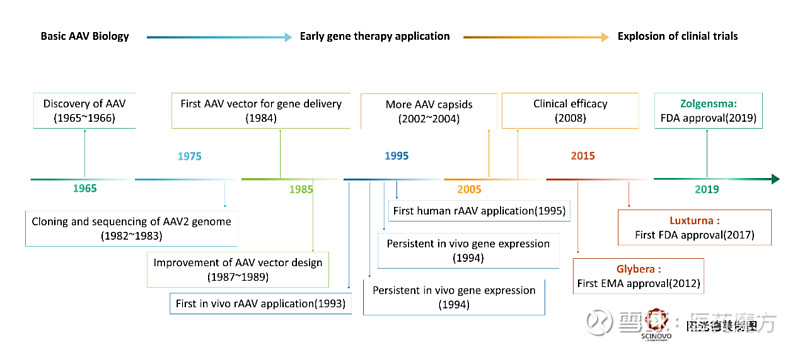
图3 AAV载体转导途径[2] AAV的研究进展 治疗性蛋白是生物制药的重要部分,也取得了较高的市场回报。但由于治疗性蛋白需要长期频繁给药,容易造成患者依从性差,经济负担高,产生药物耐受等问题。单次给药实现长期药效收益是治疗性蛋白研发的一个重要方向,AAV作为一种对人体低毒无害的载体,很早就被用作治疗性蛋白的载体。AAV介导的治疗性蛋白疗法能够提供持久的药效作用,单次注射就能够实现长期治疗目的。
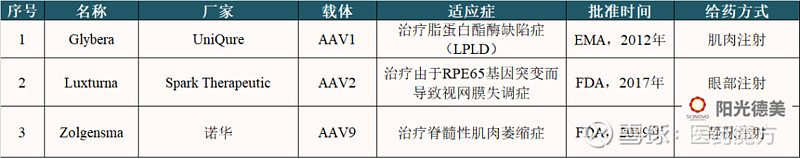
图4 AAV研究进展 AAV从早期发现到开展临床试验也经历了漫长的历程,目前全球范围内仅批准了3个AAV载体基因治疗产品上市,但在Clinicaltrials网站上备案的采用AAV病毒作为基因递送载体的临床试验已经超过了200个。 表2 已批准的AAV载体基因治疗产品
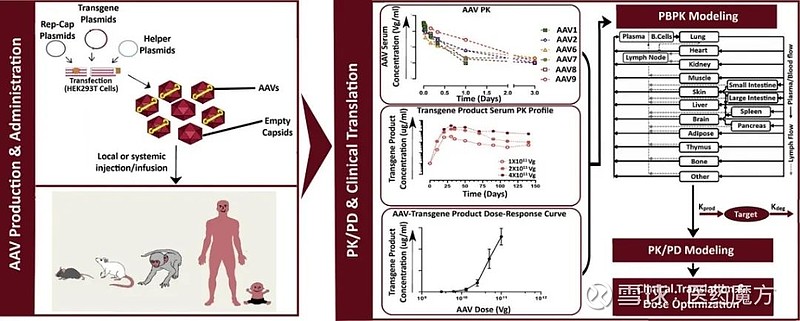
AAV的生物分析 AAV的生物分析涉及PK、免疫原性和PD研究。AAV基因治疗的PK/PD研究非常复杂。从载体给药和清除开始,在转基因产物生物合成、分泌、分布、代谢和消除之前经历了多个细胞内处理过程[3]。免疫原性研究也是AAV药物研发中关注的重点。
图5 AAV PK/PD模型示意图[4] (一)AAV的PK研究 AAV的PK研究不仅涉及AAV载体的PK及剂量关系,还涉及AAV表达蛋白的PK研究及剂量与蛋白表达量效关系研究。在临床实验中,AAV血清型、给药方式和剂量等的选择需要综合考虑AAV及转基因蛋白的体内水平。 目前尚没有完全适用于AAV基因治疗的PK模型,但已有一些模型可以定量描述和表征基于病毒或非病毒载体的基因进入细胞后的过程,可以假设六室模型,包括细胞外环境DNA、核内体、细胞内DNA、细胞内RNA、细胞内蛋白和细胞外蛋白。DNA -载体复合物在细胞间隔内的运动是由速率常数定义的,该速率常数是根据所涉及的生物过程估计或假设的[4]。也可以将其简化为在血浆中检测转基因产物的PK,并以连续静脉输注的方式建模,其中转基因产物的产生以伪稳态下运行的速率表示[3]。 1、生物分布 生物分布反映了药物进入人体后向各组织器官转运、代谢及蓄积的情况。一般将不同组织样本经过适当处理后提取样本基因组DNA,测定其药物基因或载体DNA的拷贝数,以进行AAV给药和效价分析。根据载体类型、给药途径、治疗疾病类型等因素选择检测样本,通常用于生物分布研究的组织器官样本包括:血液、给药部位、肝脏、脾脏、心脏、肾脏、胰腺、肺、皮肤、生殖腺、大脑、胸腺、肠、胃、淋巴结、骨髓、脊髓等。取样时间点体现基因治疗产品在体内过程的特点,至少包括在靶组织和非靶组织的峰值和稳态阶段。 生物分布一般采用实时荧光定量PCR、ddPCR、染料法、UV/Vis等方法。实时荧光定量PCR(qPCR)是广泛应用于AAV载体的定量分析方法之一。该方法具有高特异性、高灵敏度、可重复性、高通量、易于执行和标准化分析的特点。该检测在目标特异性引物进行扩增的基础上,由DNA结合染料或荧光标记的目标特异性引物或探针发出的荧光信号,可以在同一反应中进行扩增和检测DNA序列。 qPCR方法的关键在于合成特异性强且灵敏度高的引物和探针。但qPCR对PCR抑制剂敏感,样本在DNA提取过程中也可能引入PCR抑制剂,如有机溶剂、盐离子、多糖、血色素等。另外qPCR同时存在引物扩增效率偏好,提取效率差异导致收获产物量的差异,产生不一致的结果。DNA的二级结构、样品的制备等,均会显著影响DNA的扩增效率。而且qPCR方法不能区分完整病毒和非感染性或降解病毒。
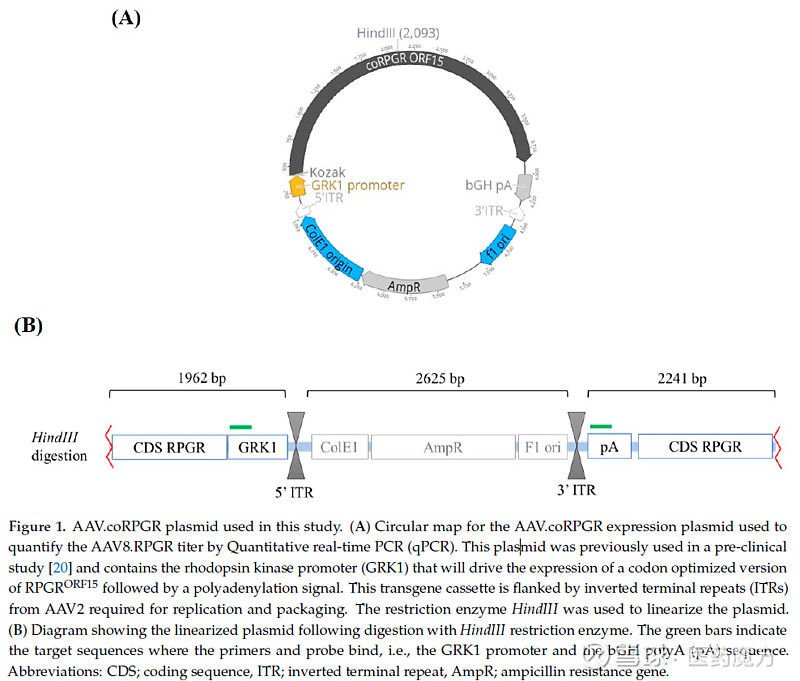
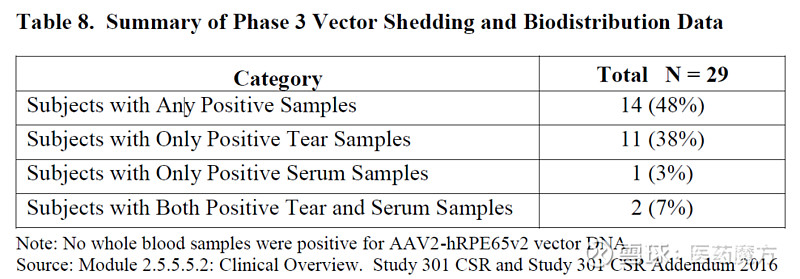
图6 AAV和本研究需要使用的coRPGR质粒[5] Zokgensma的临床前研究[6]中通过向新生FVB小鼠静脉注射1.5 × 1014 vg/kg的Zokgensma,评估其生物分布和SMN(脊髓性肌肉萎缩)转基因表达谱。 结果显示心脏中检测到的载体DNA浓度最高,其次是肺、肝脏、脊髓、四头肌、大脑、卵巢、脾脏和睾丸。 人类的SMN mRNA转录本具有类似的双相节结构,在心脏中水平最高,其次是四头肌,肝脏,肺,大脑和腰椎脊髓。 脾脏和性腺组织中均检测到低水平的SMN mRNA。 随着时间的推移,SMN mRNA转录水平普遍下降。 临床试验生物分布研究中载体DNA在女性受试者的肝脏中含量最高,其次是脾脏、腹股沟淋巴结和心脏。 骨骼肌、周围神经、肾脏、胰腺、肺、脊髓、大脑和胸腺中检测到较低水平。 不同性别的受试者生物分布略有差别,均在肝脏中含量最高。 2、载体脱落 载体脱落是指基因治疗产品通过排泄物(粪便)、分泌物(尿液、泪液、唾液、汗液等)或皮肤(脓疮、伤口等)排出体外。AAV临床研究的要求之一是了解患者单剂量给予AAV后病毒颗粒的脱落动力学和潜在传染性。EMA、FDA和PMDA(Pharmaceuticals and Medical Devices Agency)均要求进行脱落试验,对各种基质类型中的脱落病毒载体进行定量,包括全血、血浆、唾液、尿液、精液、粪便以及泪液(取决于递送途径)。FDA和EMA要求在尿液、粪便和唾液中进行[7-8]。载体脱落可采用qPCR或ddPCR测定载体DNA的拷贝数,其排出体外成分的感染性分析一般采用基于细胞的体外试验进行检测。该方法只检测完整的和有可能被传播的病毒和载体。但由于检测依赖于细胞感染,操作较为复杂,方法周期长,通量较低,检测灵敏度差。 每种基质类型在qPCR和/或ddPCR,以及基于细胞的检测开发方面都有其独特的挑战,应在整个检测开发和验证中加以考虑。例如在尿液[9]中进行感染性分析,可以在基于细胞的检测中使用替代标记对晚期病毒复制蛋白进行染色。 表3 Luxturna临床研究生物分布和载体脱落数据[10]
EMA[7]和PMDA[11]还推荐开发二次感染试验,以确保不会发生罕见的重组事件,从而避免导致这些载体基因组复制不成功的AAV感染。 3、转基因蛋白产物的定量 AAV药物的设计初衷就是为了替代或补充功能性基因,表达相关功能性蛋白,使其体内水平恢复至正常水平。不同的AAV给药剂量下稳态转基因蛋白的水平会有所差别,检测转基因蛋白水平能够为临床剂量选择提供最直接的证据支持。 转基因目标蛋白水平过低将无法达到药效剂量水平,转基因目标蛋白水平过高将可能带来额外的安全风险。转基因目标蛋白表达水平的长期监测将为临床有效性和安全性提供支持。目前监管机构对基因治疗的长期安全性都有明确要求。 转基因目标蛋白水平的监测不仅仅限于浓度水平,更需要在功能水平进行监测。转基因蛋白和天然蛋白是否存在差异,功能活性是否相似,能否达到药效水平的活性浓度。同时,目标蛋白的表达是否会存在非预期的翻译后修饰或蛋白折叠,是否具有免疫原性诱发抗体反应,诱发的抗体是否会中和天然蛋白等这些问题也需要关注。这些都是AAV产品在临床转基因蛋白的表达中需要关注的问题。另外部分AAV转基因蛋白的水平比较低,也需要借助高敏的检测方法。
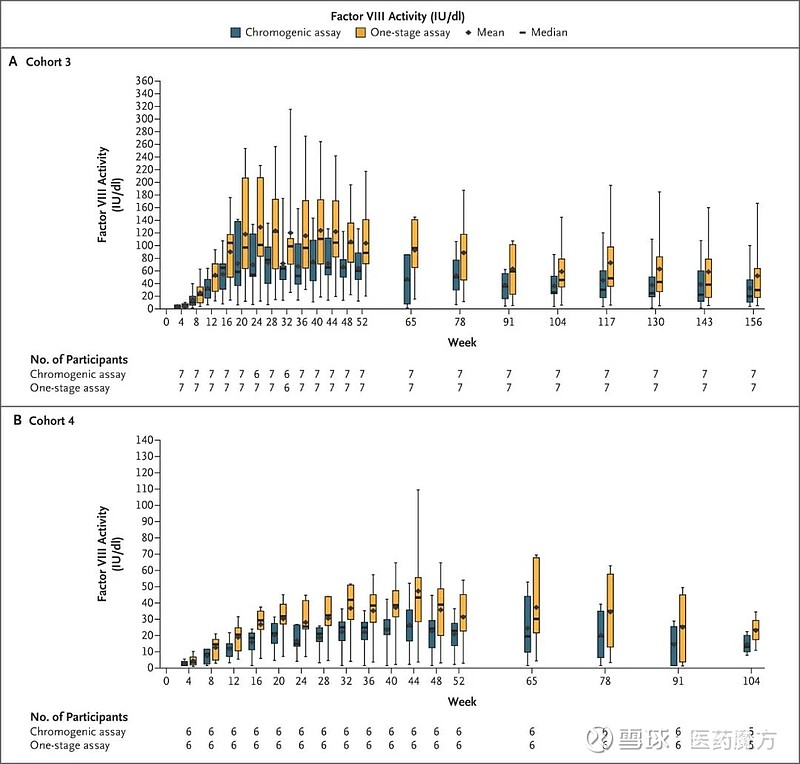
图7 AAV5-hFVIII-SQ注射后VIII因子的长期表达水平 [12] (二) AAV的免疫原性研究 虽然AAV相对于其它病毒载体有较好的安全性,但非预期的免疫反应依然是AAV药物开发需要关注的重点。针对AAV的免疫反应即可能是体内预先存在的中和抗体,又可能是AAV激活固有免疫产生急性毒性,又或者是产生针对AAV或其蛋白产物的适应性细胞免疫或体液免疫。
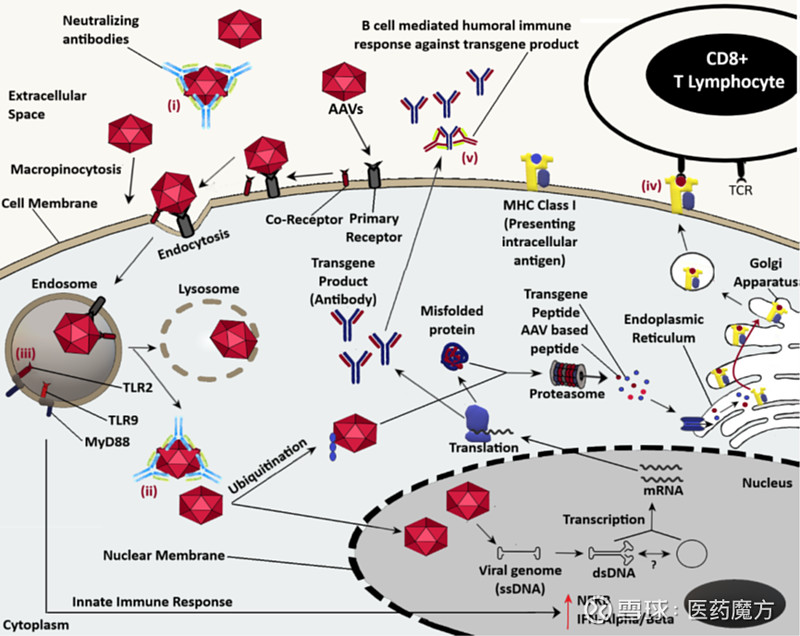
图8 AAV载体在靶细胞中转导的不同步骤和可能阻止转导过程的潜在免疫反应 [12]。注:潜在的免疫反应如下:(i)、(ii)预先存在的中和抗体可以与AAV衣壳结合,分别阻止AAV进入细胞甚至进入细胞核,(iii)基于TLR2、TLR9的对病毒衣壳或任何释放的基因组物质的固有免疫反应,(iv) MHC I类肽识别后CD8+ T细胞的细胞毒性反应,(v) 针对转基因产物的体液免疫反应。
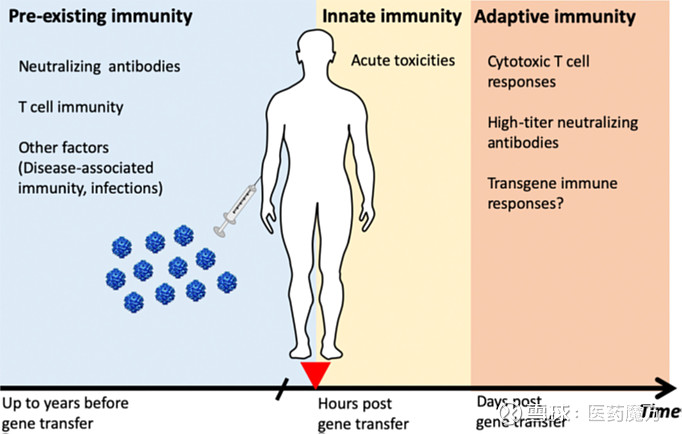
图9 AAV诱导产生的免疫反应[13] 1、预存抗体 众多的研究已经表明,人体存在一定比例的AAV预存抗体。这些预先存在的中和抗体(NAb)可能会影响AAV基因治疗的疗效。不同的AAV血清型的预存抗体比例和抗体滴度水平有所差别,且中和抗体水平与抗体滴度呈正相关。 表4 人体中不同血清型AAV的预存抗体比例
对于预存抗体,可以采用ELISA方法或基于细胞的体外转导抑制试验(TI)检测抗衣壳蛋白中和抗体。由于AAV诱导的NAb限制了相同血清型衣壳的再给药,可用于临床排除阳性受试者,避免影响药效。也可以用于判断给药后中和抗体的变化趋势。
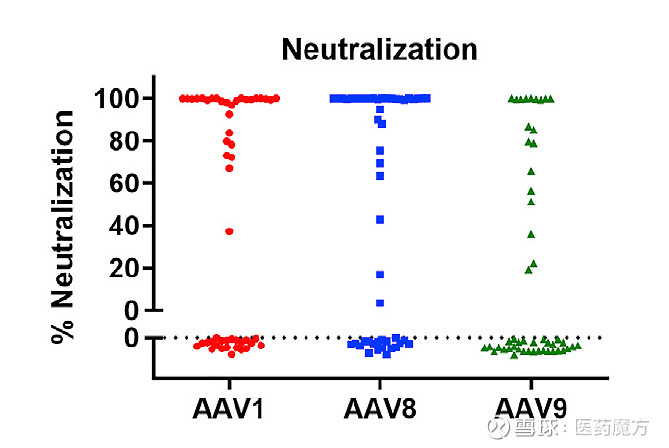
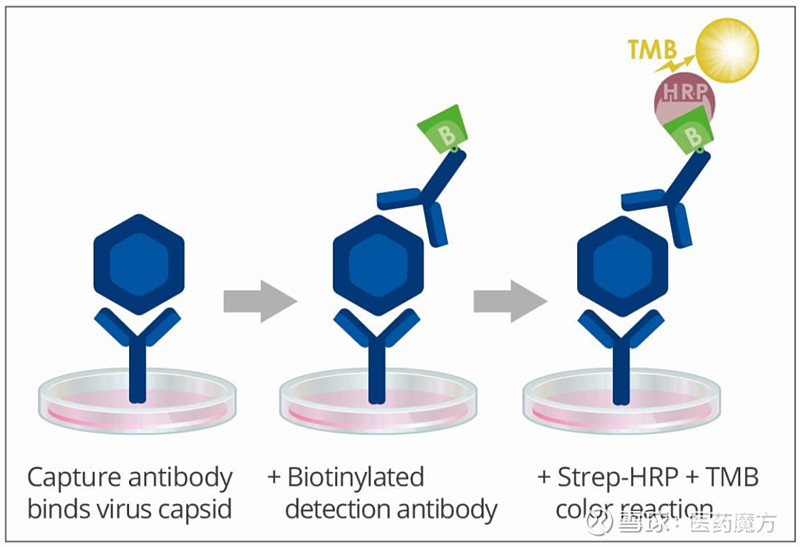
图10 恒河猴样本的中和试验[14]。注:将血清样本按1:5稀释,分别与等量的载体(AAV1、AAV8、AAV9)混合使其样本稀释比例达到1:10。37°C孵育1h,然后加入HEK293T细胞,37°C孵育24 h。对荧光信号进行分析。 2、固有免疫 AAV病毒颗粒的衣壳可在免疫细胞的核内体中降解,导致AAV基因组或衣壳暴露于Toll样受体9 (TLR9)或Toll样受体2 (TLR2),通过MyD88通路触发固有免疫反应[15]。这些反应可干扰转基因表达,对基因治疗的结果产生负面影响。在多种应对病毒的机制中,TLR9对载体基因组更为敏感。通过MyD88,TLR9诱导产生促炎细胞因子和趋化因子(通过NF-κB)和I型IFN。这些会招募额外的促炎细胞,干扰转导,并导致适应性免疫反应。因此通过TLR9阻止信号传导会阻断先天反应,降低适应性免疫反应。 3、适应性免疫 适应性免疫影响着AAV药物的药效作用及持续时间。影响AAV适应性免疫反应的因素很多,包括给药方式,载体设计,AAV血清型,载体剂量,组织炎症等。产生的免疫反应可能是针对AAV本身,也可能是针对AAV表达的转基因蛋白。 (1)体液免疫 目前在很多研究中都报道了对AAV的体液免疫反应。体液免疫反应主要有两种类型,中和的或结合的。中和抗体与AAV结合并通过多种机制抑制AAV转导靶细胞。非中和抗体与AAV结合并在不阻断AAV转导的情况下“标记”病毒。由于AAV中和抗体对AAV介导的基因治疗的疗效有显著不利影响,因此一直是许多研究的重点。对于适应性体液免疫应答,检测的内容包括抗AAV抗体、抗AAV中和抗体和抗表达产物抗体。LBA法可用于检测抗AAV总抗体,细胞法用于检测抗AAV中和抗体。还有一种桥联ELISA可以检测非中和性抗体和中和性抗体,并像其他ADA检测一样使用Cut point,比基于细胞的检测具有更好的分析敏感性和特异性[16]。 抗AAV抗体 抗AAV抗体可用商品化试剂盒进行检测。一般可用衣壳蛋白或病毒颗粒作为捕获试剂,结合待测样品中的抗AAV抗体,再利用通用二抗进行显色反应。由于间接法的背景较高,特异性稍差,一般用滴度评价抗AAV抗体的水平,通过比较AAV给药前后抗体滴度水平的变化来评价抗AAV抗体的产生情况及相对浓度水平。典型的抗AAV抗体检测方法原理如下图。
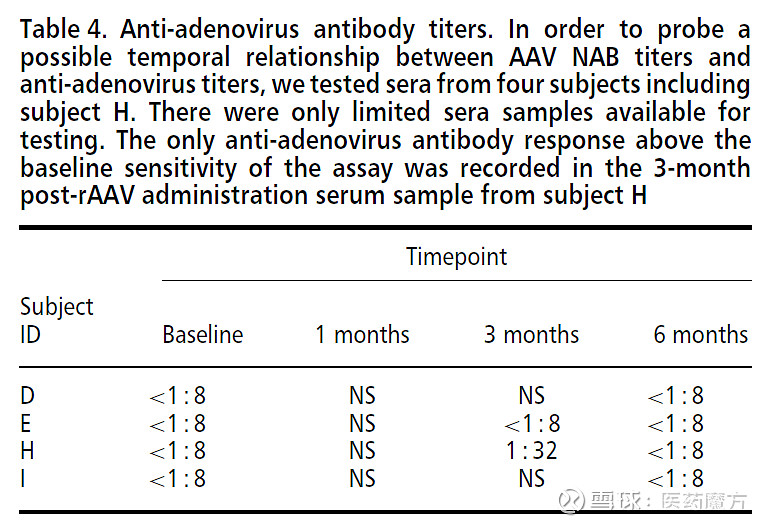
图11 抗AAV抗体检测方法原理 表5 抗AAV抗体的滴度变化[19]
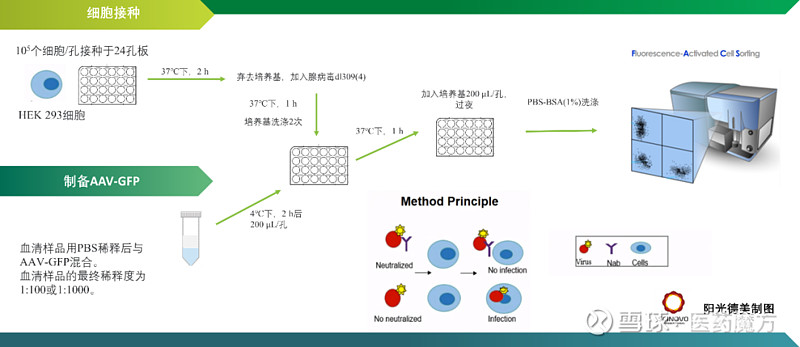
抗AAV中和抗体 利用AAV载体开发基因治疗需要许多独特的生物分析和免疫原性评价方法。其中最重要的是检测抗体可能抑制病毒衣壳转染靶细胞的能力,即对抗AAV中和抗体的检测。 以细胞为基础的NAb检测方法,使用报告基因产物改造的AAV衣壳,与血清样本进行预先孵育后感染细胞,测定培养细胞中AAV衣壳的转导效率。NAb降低AAV衣壳的转导效率,降低检测信号。因此可以通过检测荧光信号的强弱来判断感染的效果。血液中存在除NAb外的血清成分和化合物,可抑制AAV衣壳对细胞的转导。通常用50%的抑制阈值来定义样品的阳性/阴性评分和报告的效价。作为NAb阳性阈值的滴度是根据经验确定的,不同的产品或试验可能不同。需要优化的参数包括:细胞系(HEK 293、HeLa、CHO、Huh-7)、细胞数量、血清(阴性对照,热灭活)、每个细胞感染的多重性(MOI)(102 ~ 105)、辅助腺病毒或增强AAV转导和表达的化学物质、报告基因(荧光素酶,GFP, LacZ)、孵育时间、和Cut point值(50%的抑制或统计推导的)[16, 19]。
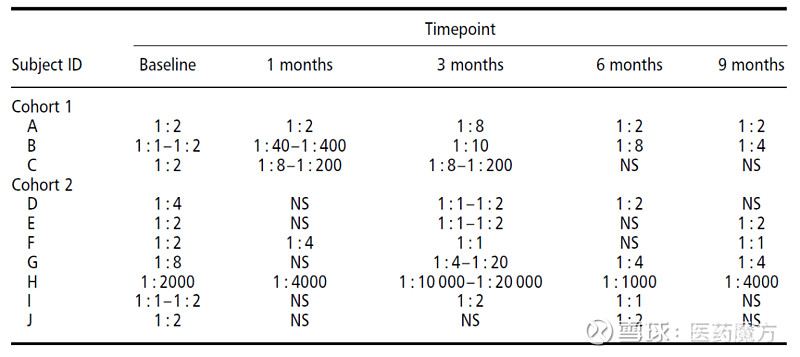
图12 基于细胞的体外方法检测中和抗AAV抗体[18] 表6 中和抗体时间谱[19]
注:10名受试者中有3名受试者有中和抗体反应,其中一名受试者中和抗体的基线滴度也较高,存在预存抗体。 (2) 细胞免疫 对于适应性细胞免疫应答,检测的内容包括针对衣壳蛋白T细胞应答和针对表达产物抗体T细胞应答。一般通过酶联免疫斑点检测(ELISpot)。ELISpot是通过将AAV衣壳抗原与PBMCs共同孵育后,对AAV衣壳抗原刺激的干扰素γ(IFN-γ)分泌细胞进行检测和定量[17]。有两个标准被广泛用于评价ELISpot试验的结果,即每百万个细胞在抗原刺激下的斑点形成单位(SFU)数量和与单纯培养基相比SFU数量的增加。一般来说,当用抗原刺激T细胞时,样本中每百万细胞形成斑点>50 SFU,且该数字至少比培养基对照高3倍时,该样品T细胞呈阳性。这些标准也被用于评估T细胞抗AAV1能力[17]。 (三)AAV的PD研究 AAV的药效作用一般是通过表达目的蛋白发挥的,关于目的蛋白的检测,参见前文。除了药效,另一个需要关注的就是细胞因子,细胞因子一方面是安全性biomarker,对于某些AAV产品也是药效biomarker。许多AAV的临床试验中都测定了血清中的细胞因子谱或与炎症相关的生物标志物,包括IL-2、IL-4、IL-5、IL-8、IL-10、IL-12、IL-13、IFN-γ、TNF-α等细胞因子,以及CD3、CD4、CD8等细胞表型。
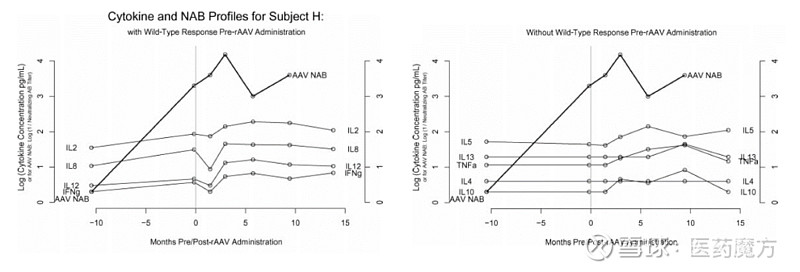
图13 受试者H细胞因子时间谱[19]。注:左图表显示了细胞因子IL-2、IL-8、IL-12和IFN-γ的图谱。这些细胞因子水平的升高与rAAV给药前AAV中和抗体水平的升高有关,可能与野生型AAV和/或腺病毒感染有关。右图表显示了细胞因子IL-4、IL-5、IL-10、IL-13和TNF-α的分布。这些细胞因子水平与AAV 中和抗体水平的初始基线升高无关。 结语 AAV是近年来研究的新热点,相关技术研究还并不十分完善,关键技术还有待突破。比如AAV载体药物的免疫原性问题,研究人员不仅要解决AAV本身的免疫原性问题,还要解决AAV转基因蛋白的免疫原性问题。虽然通过联合使用免疫抑制剂,优化制剂降低AAV表位暴露,使用空壳病毒等方式能够一定程度的降低免疫反应的发生,但这些都不是根本解决方案。开发新的低免疫原性工程AAV载体将是AAV载体改造的研究热点。其它研究难点,诸如:AAV转导及细胞内转运研究不明确,体内体外相关性,动物到人的转移,缺少文献数据,无可用的PK模型,AAV制造工艺的批间变异控制,寻找更多的靶向基因等都将是研究人员在未来需要一一解决的问题。相信随着更多制药企业加入该领域的研究,更多的资本倾斜,AAV在不久的将来会迎来突破,成为制药研究人员开发新药的重要载体。 参考文献: [1] Qin W, Xu G, Tai P W L, et al. Large-scale molecular epidemiological analysis of AAV in a cancer patient population[J]. Oncogene, 2021, 40(17): 3060-3071. [2] Li C, Samulski R J. Engineering adeno-associated virus vectors for gene therapy[J]. Nature Reviews Genetics, 2020, 21(4): 255-272. [3] Lundgren T S, Denning G, Stowell S R, et al. Pharmacokinetic analysis identifies a factor VIII immunogenicity threshold after AAV gene therapy in hemophilia A mice[J]. Blood advances, 2022, 6(8): 2628-2645. [4] Chowdhury E A, Meno-Tetang G, Chang H Y, et al. Current progress and limitations of AAV mediated delivery of protein therapeutic genes and the importance of developing quantitative pharmacokinetic/pharmacodynamic (PK/PD) models[J]. Advanced Drug Delivery Reviews, 2021, 170: 214-237. [5] Martinez-Fernandez de la Camara C, McClements M E, MacLaren R E. Accurate Quantification of AAV Vector Genomes by Quantitative PCR[J]. Genes, 2021, 12(4): 601. [6] BLA Clinical Review Memorandum (Zolgensma). FDA. 2019. [7] European Medicines Agency. EMA General Principles to Address Virus and Vector Shedding (EMEA/CHMP/ICH/449035/2009). [8] US FDA, Center for biologics evaluation and research. Guidance for industry: Design and Analysis of Shedding Studies for Virus or Bacteria-Based Gene Therapy and Oncolytic Products. 2015 [9] Zen Z, Espinoza Y, Bleu T, Sommer JM, Wright JF. Infectious titer assay for adeno-associated virus vectors with sensitivity sufficient to detect single infectious events. Hum. Gene Ther. 2004. 15(7), 709–715. [10] BLA Clinical Review Memorandum (Luxturna). FDA. 2017. [11] Pharmaceuticals and Medical Devices Agency. PMDA Japan Guidance on ensuring the quality and safety of products for gene therapy. 2019. [12] Verdera H C, Kuranda K, Mingozzi F. AAV vector immunogenicity in humans: a long journey to successful gene transfer[J]. Molecular Therapy, 2020, 28(3): 723-746. [13] Sandza, K., Clark, A., Koziol, E. et al. Ultra-sensitive AAV capsid detection by immunocapture-based qPCR following factor VIII gene transfer[J]. Gene Ther. 2021. [14] Gardner M R, Mendes D E, Muniz C P, et al. High concordance of ELISA and neutralization assays allows for the detection of antibodies to individual AAV serotypes[J]. Molecular Therapy-Methods & Clinical Development, 2022, 24: 199-206. [15] Rogers G L, Martino A T, Aslanidi G V, et al. Innate immune responses to AAV vectors[J]. Frontiers in microbiology, 2011, 2: 194. [16] Corsaro B, Yang TY, Murphy R, et al. 2020 White Paper on Recent Issues in Bioanalysis: Vaccine Assay Validation, qPCR Assay Validation, QC for CAR-T Flow Cytometry, NAb Assay Harmonization and ELISpot Validation (Part 3 - Recommendations on Immunogenicity Assay Strategies, NAb Assays, Biosimilars and FDA/EMA Immunogenicity Guidance/Guideline, Gene & Cell Therapy and Vaccine Assays). Bioanalysis. 2021 Mar;13(6):415-463. [17] Ferreira V, Petry H, Salmon F. Immune responses to AAV-vectors, the Glybera example from bench to bedside[J]. Frontiers in immunology, 2014, 5: 82. [18] Moskalenko, M., Chen, L., van Roey, M., Donahue, B. A., Snyder, R. O., McArthur, J. G., & Patel, S. D. Epitope Mapping of Human Anti-Adeno-Associated Virus Type 2 Neutralizing Antibodies: Implications for Gene Therapy and Virus Structure. Journal of Virology,2000. 74(4), 1761–1766. [19] McPhee, S. W. J., Janson, C. G., Li, C., Samulski, R. J., Camp, A. S., Francis, J., … Leone, P. (2006). Immune responses to AAV in a phase I study for Canavan disease. The Journal of Gene Medicine, 8(5), 577–588. $恒瑞医药(SH600276)$ $辉瑞(PFE)$ $百济神州(06160)$ #腺相关病毒载体# #基因治疗# #医学科普# @今日话题 |
【本文地址】