| FiercePharma:全球最关注的中国10大biotech公司,大多曾license out产品给跨国药企 | 您所在的位置:网站首页 › 国外知名化学试剂公司 › FiercePharma:全球最关注的中国10大biotech公司,大多曾license out产品给跨国药企 |
FiercePharma:全球最关注的中国10大biotech公司,大多曾license out产品给跨国药企
|
本文中,重点介绍我们认为每个对中国生物技术行业感兴趣的人都应该知道的10家公司,因为它们有一天可能会在全球舞台上展开竞争。 这10家公司与众不同的原因在于,他们都吸引了跨国大型制药企业购买其研发产品,例如百济神州已经与安进公司签约、和黄医药正在与礼来和阿斯利康进行合作、基石药业最近将其PD-L1抑制剂的中国市场使用权授权给辉瑞。 2020年中国十大创新药企(排名不分先后)
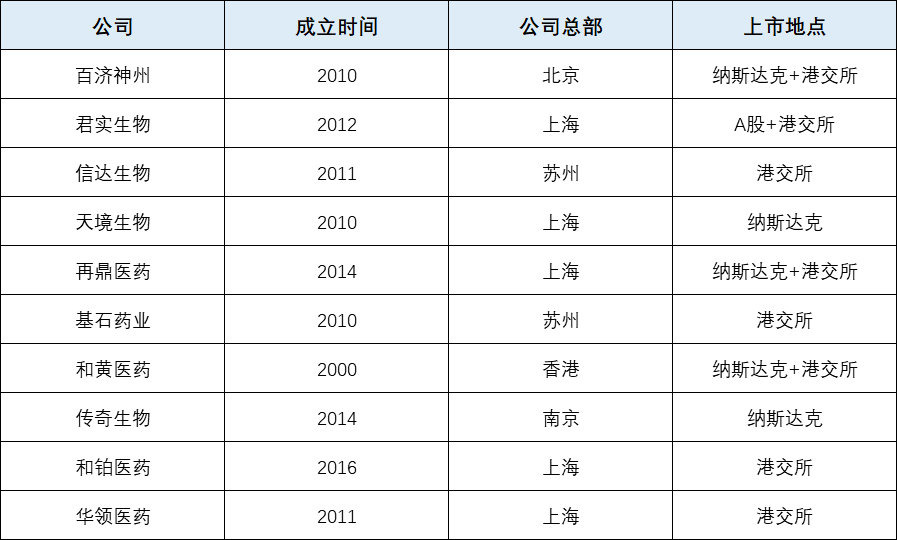
授权合作是中国生物技术行业一种流行的策略,它是快速启动现金流的低风险方式。中国生物技术公司获得的一些巨额融资也表明,资金对它们而言不一定是个大问题。 2019年,中国生物制药公司共进行了81轮融资。根据GBI的数据,截至今年11月1日,已经进行了133轮融资(包括二次发行),总价值估计约为800亿元人民币(120亿美元)。但与金钱相比,真正的创新仍然非常罕见。即使到了今天,大多数中国公司研发的品种仍然是“me too”或者“me better”,在国际市场上缺乏足够的竞争力。 因此,到目前为止,中国的生物技术行业繁荣仍主要是内部状况,而不是全球性事件。当然,中国的生物技术还很年轻,需要时间发展成熟。但是,从长远来看,无论是从品牌建设还是从业务可持续角度而言,内部研发能力都至关重要。 与美国更具多样性的研究方向不同,肿瘤领域是中国生物技术的主要部分(该10家公司中仅有1家关注非肿瘤领域),对心血管疾病和代谢疾病缺乏关注。 百济神州 CEO:John Oyler 成立时间:2010
在创立百济神州之前,John Oyler已成功创立并出售了两家公司 Telephia 和BioDuro,他还曾担任麻省理工衍生公司Galenea和专注肿瘤学研究的Genta公司的CEO。他创立百济神州,专注于肿瘤学领域, 目标是“打造中国的基因泰克”。 像许多其他生物技术公司一样,百济神州的高层为接受过西方高等教育的生物制药行业资深人士。包括联合创始人王晓东,著名的生物化学家,于2004年当选为美国国家科学院院士。 百济的发展道路还与跨国制药企业有着密切关系。 2011年,有消息称该公司从默克公司获得了一笔可观的投资,这比其获得A轮7500万美元的融资早了三年多。 2013年,百济因向默克公司出售PARP抑制剂pamiparib (BGB-290)和RAF二聚体抑制剂lifirafenib (BGB-283)的权利而名声大起,尽管这些交易后来被终止了。 2011年,有消息称该公司从默克公司获得了一笔可观的投资,这比其获得A轮7500万美元的融资早了三年多。 2013年,百济因向默克公司出售PARP抑制剂pamiparib (BGB-290)和RAF二聚体抑制剂lifirafenib (BGB-283)的权利而名声大起,尽管这些交易后来被终止了。 在创业初期,百济采用了中国生物技术行业一种流行的策略“授权合作”,希望尽早实现营收,以便在其自主研发的药物进入市场之前支持运营。2011年,百济获得强生公司intetumumab 和MTKi-327的许可。然而,这两种药物临床失败,没有获得盈利,百济的发展因此放缓。参与交易的一些人,包括创始总裁Peter Ho在那之后都离开了公司。 不过,百济并没有放弃“授权许可”,2018年末,它获得了Zymeworks her2靶向双特异性抗体zanidatamab (ZW25)和基于该抗体的抗体-药物偶联物ZW49的亚洲授权。近期还与Assembly Biosciences签订了一项5.4亿美元的协议,以获得其三个乙肝候选药物的中国授权。 2016年,百济以1.58亿美元在纳斯达克上市,该公司的第一个重大拐点出现在一年后。2017年百济通过收购新基在中国的全部业务进入商业公司行列。此外,新基支付了2.63亿美元的预付款以及里程碑,以获取百济PD-1抑制剂tislelizumab(当时称为BGB-A317)亚洲以外的权利。2019年,安进公司以27亿美元的价格收购了百济神州20.5%的股份,百济获得其Xgeva,Kyprolis和Blincyto中国销售权,也将帮助安进公司在全球开发20种抗癌药物,并在此后获得某些药物的中国商业权。 同时,百济的自主研发也已初具规模,2019年Brukinsa获得FDA批准,用于治疗既往接受过至少一项疗法的成年套细胞淋巴瘤(MCL)患者,成为国内首个获得FDA批准的抗癌药物。至于PD-1抑制剂tislelizumab,由于与O药发生冲突,新基在其与施贵宝合并后退还了该药,百济于2019年3月份将其推向中国拥挤的PD-1/L1市场,首先作为经典霍奇金淋巴瘤的治疗方法,后续进行非小细胞肺癌的探索。 如今,百济神州基本上是中国蓬勃发展的生物技术产业的发源地。随着名气的增加,它的规模也成倍增加。截至2020年1月,该公司拥有约3500名员工,而2016年底仅为300名,并在中国,美国和欧洲的17个地区设有办事处。 君实生物 CEO:李宁 成立时间:2012
君实生物总部位于苏州,已于香港和科创板上市,它以拥有第一个获得NMPA批准的国产PD-1抑制剂,用于治疗既往标准治疗失败后的局部进展或转移性黑色素瘤;第一个获得FDA突破性疗法认定的国产PD-1抑制剂,用于治疗鼻咽癌而出名。对于初创公司而言,这为占有市场份额提供了更大的机会,而且有助于提高公司在医生、患者、投资者、人才和公众中的声誉。 在新冠肺炎疫情大流行期间,君实生物与中国科学院微生物所共同开发的的重组全人源抗SARS-CoV-2单克隆抗体JS016引起了人们的广泛关注。 2020年5月,礼来与君实生物达成合作协议,负责其在中国以外地区的临床开发生产和商业化。礼来将JS016与bamlanivimab LY-CoV555联合使用,用于治疗新冠肺炎患者,该临床于2020年10月暂停,官网说法为“实验的独立数据安全监控委员会建议暂停继续招募实验参与者”。 除了上述两种药物,君实在肿瘤领域的布局还包括PD-L1、BTLA、TIGIT、CTLA和CDK,并且在心血管疾病、自身免疫性疾病一级神经病学方面也有涉猎。 信达生物 CEO:俞德超 成立时间:2011
信达生物因其与礼来在PD-1抑制剂达伯舒(信迪利单抗)的合作而闻名,该药已于2018年12月获得NMPA批准用于复发或难治性霍奇金淋巴瘤。礼来于2012年首次投资信达,然后在2015年3月,礼来就临床前阶段肿瘤免疫分子和CD20抗体支付了5600万美元的预付款,即为信迪利单抗和利妥昔单抗生物类似药IBI301。 信达将开发和销售普通老百姓负担得起的高质量生物药作为其使命,在此指导下,以及为了在竞争日益激烈的中国快速抢占市场份额,降价成为首个进入中国医保目录的PD-1抑制剂,2020年上半年其销售额达到9.209亿元。 PD-1/L1抑制剂的主要商业化优势之一是有望拓展到多个癌症类型,信迪利单抗已经在非小细胞肺癌、一线鳞状非小细胞肺癌方面取得了积极的成果,已提交NMPA审查。 除了信迪利单抗方面的合作,信达和礼来签署合作开发三种基于PD-1的双特异性抗体,2019年8月信达还获得了礼来GLP-1和GCCR双重激动剂OXM3的许可。 目前,信达已建立了具有超过20种候选药物的产品管线,涵盖肿瘤、代谢、眼科和自身免疫性疾病。 天境生物 CEO:申华琼 成立时间:2016
葛兰素史克中国研发部前负责人Zingwu Zang于2016年成立天境生物,现任CEO申华琼于2017年加入公司。天境生物已于2020年1月在美国纳斯达克上市,在上市之前,它还是中国一些最大规模融资活动的主角,包括2.2亿美元的C轮融资和1.5亿美元的B轮融资。 天境中国管线中的主要候选药物是从德国生物技术公司获得授权的CD38抗体felzartamab(TJ202/MOR202),之所以选择这种药物,是因为它的输液时间更短(≤2h),而同类品种则长达6.5h。 目前,天境有两项正在进行的felzartamab注册试验,一项与地塞米松联合用于三线复发/难治性多发性骨髓瘤的2期试验,以及一项将Revlimid作为第二线患者第三组分的3期试验。该公司表示将于2021年第二/第三季度提交上市申请。 2020年9月,艾伯维支付首付款和里程碑付款高达19.4亿美元,与天境生物在研抗癌药——CD47单克隆抗体lemzoparlimab(TJC4)的开发和商业化达成全球战略合作。美国的1/2期研究最近完成了剂量递增阶段,表明该药耐受性良好,没有发生重大血液学安全性问题。目前,该药物已经进入了第二阶段的试验,将默克的K药联合用于实体瘤的治疗,并与罗氏的Rituxan联合用于非霍奇金淋巴瘤的治疗。 天境生物在研药物还有被称为plonmalimab的GM-GSF抗体,主要针对类风湿性关节炎以及CAR-T治疗相关的细胞因子释放综合征。 再鼎医药 CEO:杜莹 成立时间:2014
再鼎位列榜单主要是因为其创始人兼CEO杜莹是一位名人企业家,而且在很多人看来,她是中国生物技术行业的教母。二十年前,中国的医药主要以仿制药为发展路线时,杜莹离开了工作7年的辉瑞公司,加入新生的和黄医药,在她的带领下和黄建立了一条创新的平台,随后她于2011年加入红杉投资公司,然后在2014年她创立了再鼎医药,已于纳斯达克和香港上市。 再鼎的企业定位为“全国生物制药企业转入中国市场的最佳合作伙伴”,凭借其自身强有力的业务拓展/授权和早期资产分子的开发能力核对中国创新药市场深入的了解,与多家领先的跨国药企开展了多项战略合作,包括葛兰素史克、再生元、Incyte、Deciphera等。 2016年,再鼎获得了Tesaro的PARP抑制剂Zejula的中国权利,该药在2019年获得NMPA批准用于对铂类化学疗法有完全或者部分反应的复发性上皮性卵巢癌、输卵管或原发性腹膜癌患者的维持治疗。这也是再鼎在中国首个商业化药物。 另外一款已上市药物是Novocure的肿瘤治疗电场Optune,用于治疗新发多形性胶质母细胞瘤。2020年上半年,这两款药物为再鼎带来了1920万美元的销售额。 此外,再鼎还有针对多种癌症类型的CD47、针对银屑病的IL-17等在研品种。 基石药业 CEO:Frank Ningjun Jiang 成立时间:2015
2016年,基石药业凭借1.5亿美元的A轮融资和拥有赛诺菲14年工作经验的CEO Frank Ningjun Jiang立即引起了我们的注意。并且,该公司于2018年进行了2.6亿美元的B轮融资,这是当时中国生物技术公司最大的B轮融资。 但是实际上,基石最近与辉瑞的一笔交易才使其一举成名。2020年9月,辉瑞投资2亿美元获得基石9.9%股份,高达2.8亿美元的里程碑,以获得PD-L1抗体sugemalimab在中国的独家商业化权利。一个月后,这家生物技术公司签署了EQRx协议,以1.5亿美元的预付款和11.5亿美元的里程碑授予了sugemalimab及其PD-1抑制剂CS1003的15项中国以外的开发和商业化权利。 基石的战略是围绕sugemalimab、CS1003和CTLA-4抑制剂CS1002这三种主要的肿瘤免疫药物,建立起一个癌症组合管线。 为了建立该组合管线,2018年 6月基石与Blueprint Medicines达成交易,获得其肿瘤药物Ayvakit(2020年1月获得FDA批准用于治疗带有PDGFRα18号外显子突变的胃肠道间质瘤,但是其在较晚期的胃肠道间质瘤与拜耳的Stivarga头对头试验未获认可,目前适应症正在中国审查中)、RET抑制剂Gavreto(最近获得FDA批准用于治疗RET基因异常的非小细胞肺癌,在中国的应用已被接受为优先审批)和FGFR4抑制剂fisogatinib的中国权利。 尽管这两种license in的药物可能为基石的最先商业化药物,但是该公司产品线的核心依然是sugemalimab。为了帮助开发这种药物,基石在2016年底聘请了来自百济神州的杨建新为其首席医疗官,目前正在以4期非小细胞肺癌提出新的适应症。这与公司招股说明书中提出的最初策略不同,原来打算从最小适应症慢性霍奇金淋巴瘤和自然杀伤性T细胞淋巴瘤获得审查,从而早日进入市场,这也是百济、恒瑞、信达所采用的方式。但是在3期非小细胞肺癌方面,sugemalimab是孤独的,基石称其为全球首创,sugemalimab联合化疗将疾病进展或死亡的风险降低了一半。 基石在2020年半年度报告中表示,sugemalimab在3期放化疗后非小细胞肺癌的3临床试验主要数据预计将在2021年初公布。当然,基石也没有放弃血液肿瘤方面的适应症,10月份FDA授予sugemalimab突破性疗法,用于治疗复发性和难治性结外自然杀伤细胞/T细胞淋巴瘤。此外,基石还针对胃癌和食道癌进行了注册试验。 除了以上三款候选药物,基石还获得了Agios的IDH抑制剂Tibsovo的许可。它还与拜耳保持着长期合作关系,涉及与Stivarga联合使用。该公司其他处于研发早期的候选药物还有MEK靶向药物,HDAC6和CDK4/6。 和记黄埔 CEO:Christian Hogg 成立时间:2000年
和黄医药于2000年创立,后来与李嘉诚CK Hutchison集团合并,该公司的最早定位为所谓的 “商业平台”。该公司与中国知名制药企业创立合资公司,主要业务是处方药和消费者保健品,以及为第三方提供分销和营销服务,其商业平台在2019年的收入为1.89亿美元。CEO Christian Hogg曾效力于快消巨头宝洁公司,加入和黄成为其一号员工。 在辉瑞资深人士杜莹的带领下,和黄发展内部“创新平台”,从真正意义上成为一家生物技术公司。 2018年,基于3期临床结果与安慰剂相比将死亡风险降低35%,VEGFR抑制剂Elunate(呋喹替尼)获得中国批准,用于治疗至少两次治疗失败的大肠癌患者。这是该公司的首个创新药,也是首个完全在中国研发和商业化的针对主要癌症类型的国产药物。通过降价37%,Elunate进入国家医保目录,在20年上半年处方量增长了174%,销售额达到1400万美元。 在中国以外的地区,和黄于2018年建立了美国业务。该团队最近启动了转移性结直肠的Fresco-2全球注册试验。还与百济神州、礼来探讨了在全球范围内将Elunate与他们的PD-1抑制剂相结合的可能性。 为了后续商业化做好准备,和黄已将其肿瘤营销团队由年初的90人扩大多了350人,还将进一步增加,预计到2023年这一数字将超过1000。 当然,这一雄心勃勃的目标主要取决于后续是否有两种药物研发成功。 其中一种是名为surufatinib的血管免疫激酶抑制剂,它被设计用于治疗晚期非胰腺神经内分泌肿瘤,其两项关键性Ⅲ期临床试验因达到临床主要终点提前终止,目前在审评中。 另外一种MET抑制剂savolitinib正在与阿斯利康合作共同开发,2020年5月NMPA根据一项开发标签的2期临床试验结果,接受了在非小细胞肺癌中具有MET14号外显子突变的新药申请。与阿斯利康的合作也使得和黄有机会将savolitinib与英国制药公司的Tagrisso和Imfinzi联合使用,1期结果显示一些对EGFR抑制剂产生抗药性的患者仍然对savolitinib-Tagrisso产生应答。 除了产品,由于《外国公司担责法案》,和黄目前面临着一些股市问题,它还一直想在香港上市,但是由于市场不确定性目前已推迟。 南京传奇生物 CEO:黄颖 成立时间:2014
南京传奇生物是我们在2017年美国临床肿瘤学年会上发现的黑马,当大家都在关注诺华和Kite(后被吉利德收购)之间的CAR-T战争时,南京传奇生物LCAR-B38M在既往治疗后复发的多发性骨髓瘤治疗方面的数据引起了轰动,35名患者中,有33人在接受治疗后2个月获得临床缓解,显示明显的骨髓瘤临床缓解,客观缓解率达到100%。该结果也引起了强生的注意,强生支付3.5亿美元预付款获得LCAR-B38M中国以外的权利。 该公司认为LCAR-B38M因其独特的CAR结构与众不同,采用双特异性抗体平台设计,与肿瘤上的两个关键BCMA位点结合,首席科学官Frank Fan将这种机制比作用两只手抓球。这样可以实现更紧密的结合,从而大大降低癌细胞逃逸的可能性。后续各项临床数据也表现出了积极结果,基于这些积极数据,FDA授予其突破性疗法认定,预计也将于2021年提交中国上市申请。 该公司于2020年6月在纳斯达克上市,随后公司似乎出现了一些波动,高层发生了一系列变动,目前由原首席财务管黄颖担任CEO。 除了LCAR-B38M,南京传奇生物候选药物还包括用于治疗弥散性大B细胞淋巴瘤的CD19xCD22双特异性抗体,用于治疗急性髓性白血病的CD33xCLL-1双特异性抗体等。 和铂医药 CEO:王劲松 成立时间:2016
和铂医药自称为一家全球性生物制药公司,致力于肿瘤免疫治疗领域大分子单抗创新药物的开发,2016年底在上海设立办事处,并从两家风险投资公司Advantech Capital和Legend Capital筹集了5000万美元。其CEO王劲松曾是赛诺菲中国研发部负责人和亚太地区转化医学负责人。 作为一家公司,它做的第一件事是购买抗体,此次收购为和铂提供了两种转基因小鼠技术平台-HCAb和H2L2,它们作为该公司的科学基础,用于人类抗体的发现。 H2L2最近帮助该公司和其他机构的研究人员一起发现了一种在体外培养中可以有效中和SARS病毒和新冠肺炎病毒,称为47D11的抗体,该抗体还引起了艾伯维的注意,双方目前正展开合作。在与艾伯维达成交易后不久,该公司启动了1.028亿美元的C轮融资,之后还与Vir Biotechnology签署了战略合作协议,8月18日申请在香港交易所上市。 该公司的两个主要药物,从HanAll Biopharma获得授权,分别为anti-FcRn 抗体 batoclimab 和TNF-α抑制剂tanfanercept,目前正针对多种疾病(例如视神经脊髓炎谱系病、重症肌无力)进行临床试验中,预计将于2022年提交上市申请。 此外,在2018年通过与科伦生物的交易,获得了PD-L1抗体在中国以外地区的授权,但是在最新的募股申请中,该药物已经从“核心产品”列表中消失了,据CEO表示该公司目前正在评估PD-L1在美国开发的策略。 目前,该公司产品管线中最先进的候选药物是被称为HBM4003的CTLA-4抑制剂,计划将于2021年初报告1期实体瘤的主要试验结果。同时它还将关注黑素瘤、非小细胞肺癌和MSI-H大肠癌方面适应症。 除了上述药物,候选药物还包括HER2Xcd3特异性抗体,以及抗CD73、BCMAxCD3、PD-L1xTGFb等分子。 华领医药 CEO:陈力 成立时间:2011
在专注肿瘤学领域的公司如雨后春笋般涌现时,华领是一个例外,它主要开发治疗糖尿病和中枢神经系统疾病的药物,2018年以1.1亿美元的首次公开募股定价于香港上市。 华领以葡萄糖激酶(一种位于胰腺和肝脏的葡萄糖感应器)为靶点,开发口服糖尿病创新药。激活有缺陷的葡萄糖激酶以恢复葡萄糖糖水平的正常调节是对抗2型糖尿病的主要希望之一,但是尽管取得了令人鼓舞的早期成果,许多跨国制药公司仍然半路折戟。 罗氏首先进行了探索(陈力在创立华领之前,曾在罗氏工作了18年),但是其葡萄糖激酶激活剂paragliatin 2期临床失败,默克公司的MK-0941、安进公司和 Array Biopharma 的AMG151均失败。相比同类药物,陈力博士认为华领的dorzagliatin(HMS5552)更具优势,该药物的设计主要是在有效治疗浓度下提高葡萄糖激酶的效率,同时保持其葡萄糖感应的功能。 基于陈力博士罗氏的工作经验,他创立华领后首先从投资机构获得基金,以200万美元预付款形式从瑞士制药公司购买了dorzagliatin,其3期临床达到主要临床终点,目前离获批上市仅一步之遥。 中国糖尿病市场巨大,约有1.16亿患者,但却被礼来、诺和诺德、赛诺菲等跨国药企,以及甘李等一些国内大型企业主导。华领知道自己无法单独从与这些公司的竞争中获胜,因此2020年8月份该公司与拜耳合作,拜耳将负责其在中国的商业活动。除了直接竞争,dorzagliatin正在与胰岛素、二甲双胍、DPP-4、SGLT-2和GLP-1进行大量的组合研究,其中与二甲双胍联合用药的Ⅲ期临床已取得积极结果。 除了dorzagliatin,华领还有一款处于临床前阶段靶向谷氨酸感应器的中枢神经系统药物,mGluR5NAM。 原文链接: https://www.fiercepharma.com/special-report/10-biotechs-to-know-china 版 权 声 明 本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系([email protected]),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。 返回搜狐,查看更多 |
【本文地址】