| CDE发布《化学仿制药参比制剂遴选申请资料要求》,自发布起实施! | 您所在的位置:网站首页 › 化学药品统计表模板 › CDE发布《化学仿制药参比制剂遴选申请资料要求》,自发布起实施! |
CDE发布《化学仿制药参比制剂遴选申请资料要求》,自发布起实施!
|
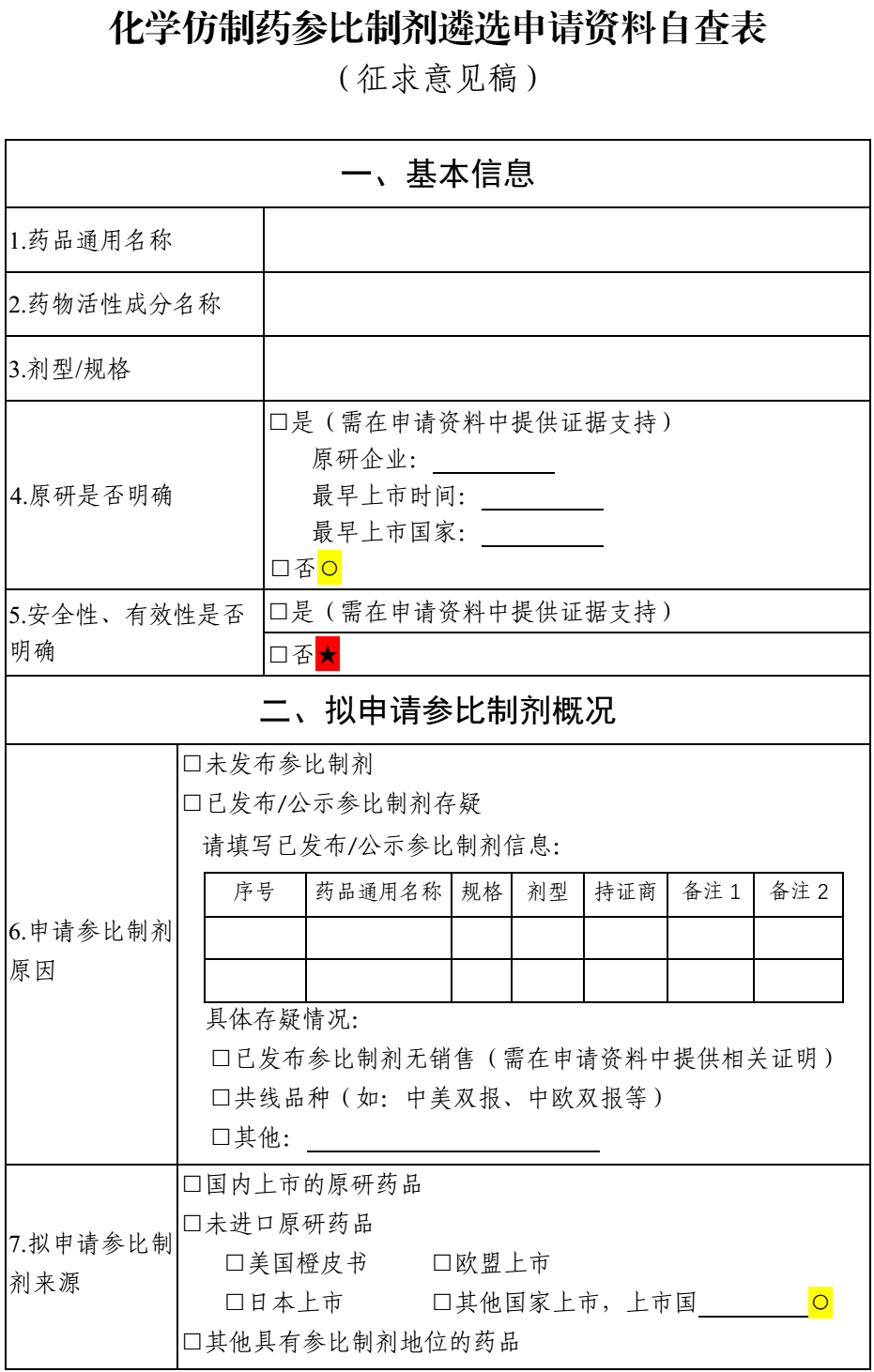
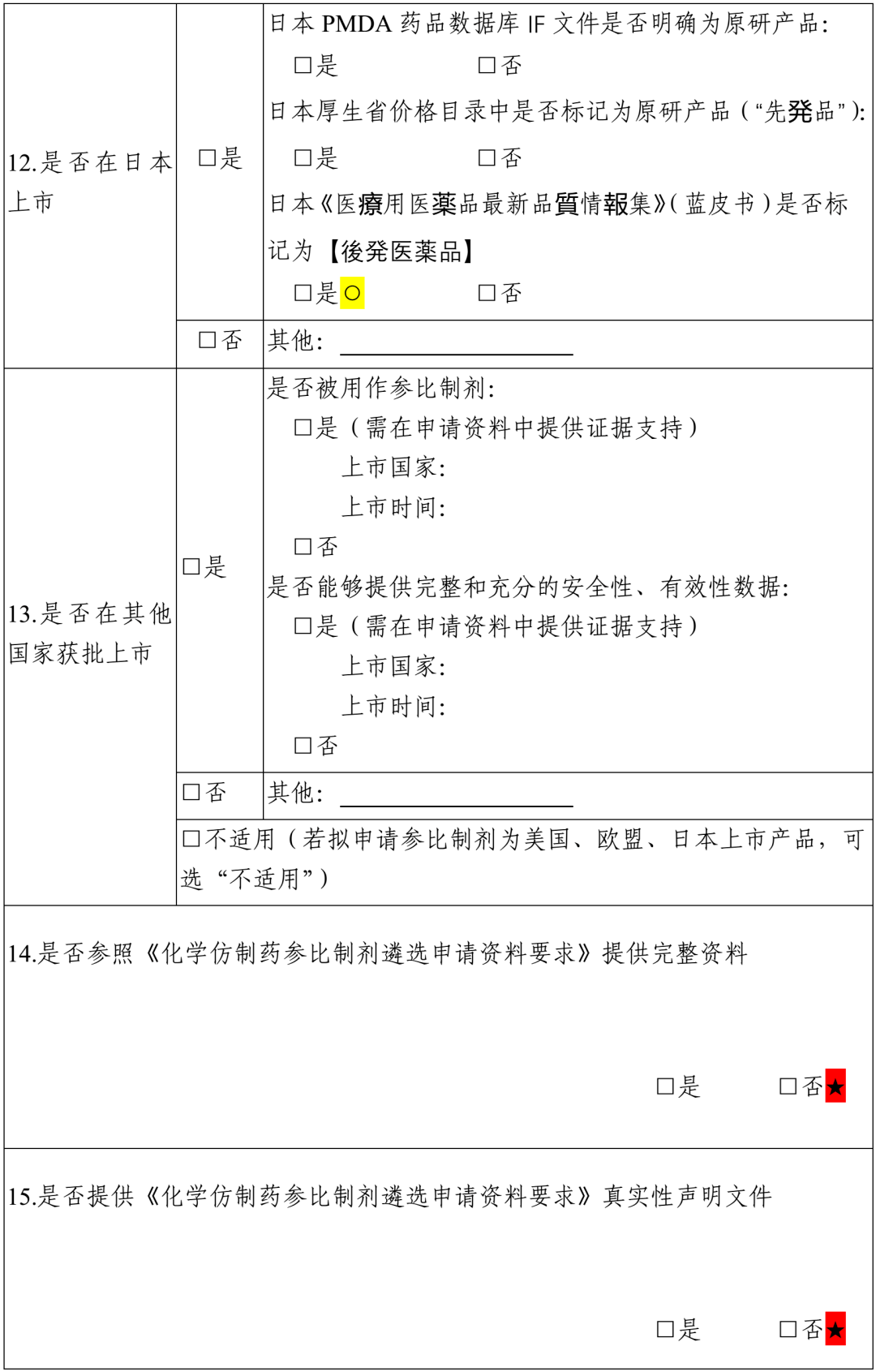
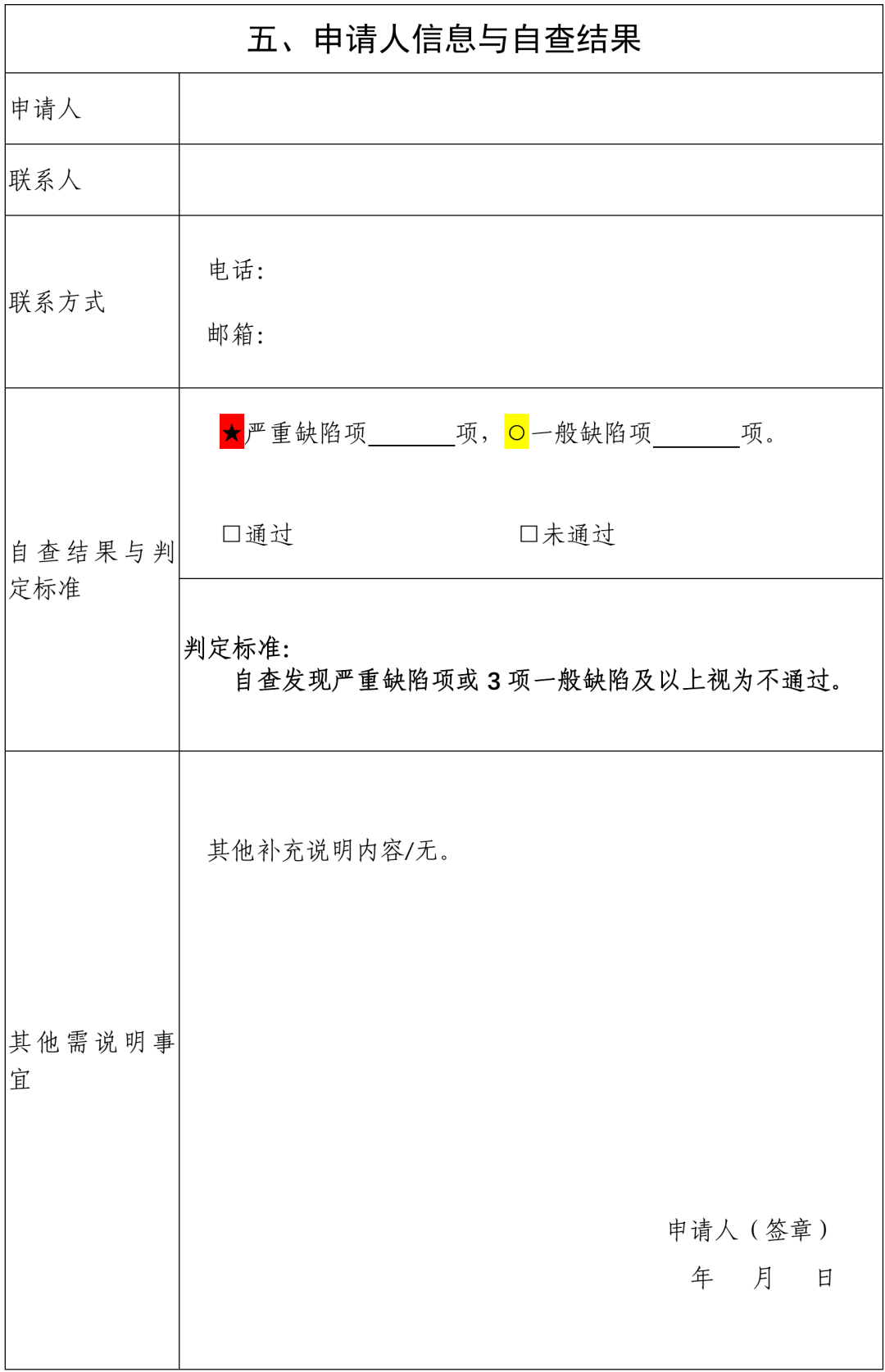
序号 药品通用名称 规格 持证商 备注1 备注2 7.品种原研信息 7.1 原研是否明确 是/否。简要概述原研产品上市情况(建议包括但不限于原研企业,上市时间、最早上市国家、商品名、剂型、规格等)。如持证商发生变更,请说明时间节点和变更情况。应提供原研调研信息及相关证明性文件。 7.2 临床安全有效性是否明确 是/否。简要概述原研药品上市前、后临床研究信息。 综上,本品属于(原研明确、疗效明确;原研不明、疗效明确;原研明确、疗效不明;原研不明、疗效不明)类化学药品。 (二)参比制剂申请依据 根据《化学仿制药参比制剂遴选与确定程序》进行综合评估,包括但不限于以下内容: 1.参比制剂申请原因 如国家药品监督管理局尚未发布参比制剂,或对已发布参比制剂存在异议(需明确具体原因,并提供相关证明性文件)。 2.拟申请参比制剂是否为原研 应明确拟申请参比制剂是否为原研,持证商,以及来源。 3.拟申请参比制剂上市时是否有完整和充分的安全、有效性数据 如拟申请参比制剂为原研产品,则此项内容可填写为同“(一)品种基本信息下7.2 项”,无需赘述。 如拟申请参比制剂为其他国际公认产品,需简要评价产品作为参比制剂的依据及其安全有效性。 4.拟申请参比制剂的质量是否可控、是否符合现行的国际通用技术要求(如ICH 等) 如尚未开展相关研究,说明情况即可。如已有研究数据,可简要概述拟申请参比制剂质量是否可控。 5.拟申请参比制剂是否可及 提供销售数据或其他能够证明可及性的文件均可。 6.拟申请参比制剂在美、欧、日等其他国家及国内上市同品种(如有)的处方是否一致 结合调研信息,简要概述拟申请参比制剂在美、欧、日及国内的处方情况,明确是否一致,如不一致可简要分析处方差异对产品的影响。 7.拟申请参比制剂在美、欧、日及国内上市的适应症是否一致 结合调研信息,简要概述拟申请参比制剂在美、欧、日及国内的获批适应症情况,明确是否一致,以及拟开发产品的拟定适应症情况。 8.其他需要说明问题。 表xx:本品种拟申请参比制剂信息 序号 药品通用名称 规格 持证商 备注1 备注2 注:参照已发布参比制剂目录填写。 二、调研信息 (一)国内外批准情况 1.国内上市情况 1.1 进口药品批准情况 原研药品批准情况应列表说明,仿制药情况简要概述。 表xx:本品种国内进口药品批准情况表 通用名 商品名 规格 公司名称 生产厂商 原研药/仿制药 中文/英文名 1.2 国产药品批准情况 原研药品批准情况应列表说明,仿制药批准情况简要概述。 表xx:本品种国产药品批准情况表 通用名 商品名 规格 上市许可持有人/生产单位 原研药/仿制药 中文/英文名 2.美国上市情况 2.1 美国橙皮书收载情况 本品种参比制剂收载情况应列表说明,仿制药情况简要概述。 表xx:本品种FDA橙皮书参比制剂收载情况表 通用名 商品名 规格 申请号 持证商 RLD/RS 批准时间 (含已撤市) 2.2 其他上市情况 如OTC Monograph、膳食补充剂管理等橙皮书未收载情况应予以简单说明。 3.欧洲上市情况 3.1 欧盟EMA 官网收载情况 本品种原研药品批准情况应列表说明,仿制药情况简要概述即可。若拟申请参比制剂是通过EMA 集中审批程序上市的原研产品,则3.2 和3.3 项下可填写为“不适用”。 表xx:本品种EMA 官网收载情况表 通用名 商品名 规格 持证商 生产商 上市时间 原研药/仿制药 3.2 欧盟HMA 官网收载情况 本品种原研药品批准情况应列表说明,仿制药情况简要概述即可。如原研药品未通过互认审批程序获批上市,则此项可填写为“未调研到相关资料”。 表xx:本品种HMA 官网收载情况表 通用名 商品名 规格 持证商 生产商 上市国家 上市时间 原研药/仿制药 是否被用作参比制剂 (是/否) 3.3 欧盟各国的批准情况 本品种原研药品在欧盟各国批准情况应列表说明,仿制药情况简要概述即可。如原研药品是通过集中审批程序或互认程序获批上市,则此项可填写为“不适用”。 表xx:本品种欧盟各国批准情况表 上市国家 商品名 规格 持证商 生产商 上市时间 原研药仿制药/ 是否被用作参比制剂 (是/否) 4.日本上市情况 4.1 日本PMDA 官网收载情况 原研药品批准情况应列表说明,仿制药情况简要概述。 表xx:本品种日本PMDA 官网收载情况表 通用名 商品名 规格 持证商 参比制剂 上市时间 IF 文件中是否明确为原研品 4.2 日本厚生省价格目录收载情况 表xx:本品种日本厚生省价格目录中收载情况表 通用名 商品名 规格 持证商 是否标记为“先発品” 4.3 日本《医療用医薬品最新品質情報集》(蓝皮书)收载情况 参比制剂收载情况应列表说明,仿制药情况简要概述。 表xx:本品种日本《医療用医薬品最新品質情報集》收载情况表 通用名 商品名 规格 持证商 是否标记为“后発品” 上市时间 5.其他国家上市情况 若拟申请参比制剂为美国、欧盟、日本上市产品,此项可填写为“不适用”。 表xx:本品种其他国家药品批准情况表 通用名 商品名 规格 持证商 生产商 上市国家 上市时间 原研药/仿制药 是否被用作参比制剂 (是/否) (二)国内外使用情况 1.拟申请参比制剂在中国、美国、日本、欧盟及其他国家获批适应症用法用量对比可结合调研情况对拟申请参比制剂在美、欧、日及国内等获批的适应症用法用量进行对比,如适应症用法用量内容较多,可简要概述后进行对比。 表xx:本品种在各国上市的适应症及用法用量情况 国家 通用名称 规格 适应症 用法用量 中国 美国 欧盟 日本 其他 2.拟申请参比制剂同适应症的其他药品概述 简要概述与拟申请参比制剂品种同适应症的其他药品上市情况。 3.拟申请参比制剂在中国、美国、欧盟、日本及其他国家上市产品的处方对比 结合调研情况对拟申请参比制剂在美、欧、日及国内等获批的处方组成进行对比。 表xx:本品种在各国上市的处方情况 国家 通用名称 规格 处方组成 包材 中国 美国 欧盟 日本 其他 4.中国、美国、欧盟、日本及其他国家安全性警示信息 应提供中国、美国、欧盟、日本及其他各国药监官网发布的安全性警示信息。如未调研到相关信息,如实填写即可。 5.其他 其他需特殊说明情况。 三、调研信息网址链接 序号 查询信息 网址链接 1 拟申请参比制剂国内上市信息查询网址 2 拟申请参比制剂美国上市信息查询网址 3 拟申请参比制剂欧盟上市信息查询网址 4 拟申请参比制剂日本上市信息查询网址 5 拟申请参比制剂其他国家上市信息查询网址 四、附件 附件1 化学仿制药参比制剂遴选申请资料自查表 附件2 申报资料真实性声明文件 附件3 拟申请参比制剂可及性证明文件 附件4 拟申请参比制剂说明书 附件5 拟申请参比制剂相关审评报告、临床研究信息等(如FDA 审评报告、PMDA IF 文件、EMA 审评报告等) 附件6 其他信息 五、填写说明 1.申请资料中目录及项目编号不得改变,无法提供某一项的相关信息时,该项目的编号和名称也应保留,可在该项下注明“未调研到相关资料”或“不适用”。 2.“四、附件”项下内容可以合并在一个WORD 文档内提交,建议大小不超过100M。 3.关键性资料应在对应资料后附中文翻译稿。 附件 1 化学仿制药参比制剂遴选申请资料自查表 (征求意见稿)
|
【本文地址】
| 今日新闻 |
| 推荐新闻 |
| 专题文章 |


 返回搜狐,查看更多
返回搜狐,查看更多