| 中考干货:初中化学思维导图最全总结,提高效率必备神器! | 您所在的位置:网站首页 › 初中化学空气氧气思维导图 › 中考干货:初中化学思维导图最全总结,提高效率必备神器! |
中考干货:初中化学思维导图最全总结,提高效率必备神器!
|
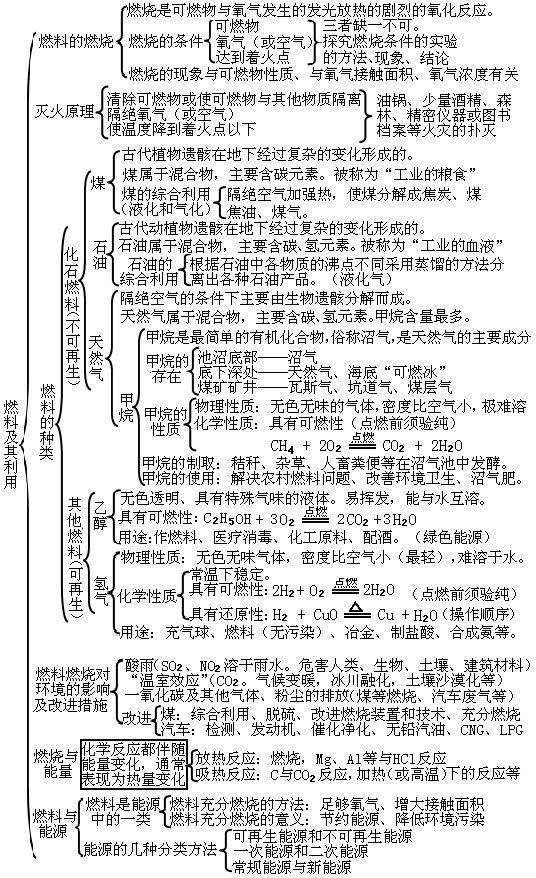
05 第五单元:化学方程式 06 第六单元:碳和碳的氧化物 07 第七单元:燃料及其利用
08 第八单元:金属和金属材料 09 第九单元:溶液 10 第十单元:酸 碱 盐 一、化学用语 1、电离方程式: 2、物质的俗称和主要成分: 生石灰CaO; 熟石灰、消石灰、石灰水的主要成分Ca(OH)2; 石灰石、大理石CaCO3; 食盐的主要成分NaCl ; 纯碱、口碱Na2CO3; 烧碱、火碱、苛性钠NaOH; 胆矾、蓝矾CuSO4·5H2O; 碳酸钠晶体Na2CO3.10H2O; 氨水NH3.H2O。 二、金属活动性 1、金属活动性顺序: K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H)Cu>Hg>Ag>Pt>Au 2、金属活动性顺序的意义: 在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。 3、金属活动性顺序的应用: (1)排在氢前的金属能置换出酸里的氢(元素)。 (2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。 三、酸、碱、盐的溶解性 1、常见盐与碱的溶解性: 钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。 硫酸盐不溶硫酸钡,氯化物不溶氯化银。 碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。 碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。 2、八个常见的沉淀物: 氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁 3、四微溶物: Ca(OH)2(石灰水注明“澄清”的原因); CaSO4(实验室制二氧化碳时不用稀硫酸的原因); Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因); MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)。 4、三个不存在的物质: 氢氧化银、碳酸铝、碳酸铁 四、复分解反应发生的条件反应 有气体、水或沉淀生成(即有不在溶液中存在或在水溶液中不易电离的物质) 1、不溶性碱只能与酸性发生中和反应; 2、不溶性盐,只有碳酸盐能与酸反应; 3、KNO3、NaNO3、AgNO3、BaSO4不能做复分解反应的反应物。 五、溶液的酸碱性与酸碱度的测定 1、指示剂:溶液的酸碱性 紫色的石蕊试液遇酸性溶液变红;遇碱性溶液变蓝;无色的酚酞试液只遇碱溶液变红。 注:不溶性碱与指示剂无作用; 碱性溶液不一定是碱的溶液(特例:碳酸钠的水溶液显碱性) 2、pH值:溶液的酸碱度 pH7溶液为碱性(越大碱性越强) 六、离子的检验 Cl-(在溶液中):在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的白色沉淀,则原被测液中含氯离子。 SO42-(在溶液中):在被测溶液中加入氯化钡(或硝酸钡、或氢氧化钡)溶液,如果生成不溶于硝酸(或盐酸)的白色沉淀,则原被测液中含硫酸根离子。 CO32- 1.(固体或溶液):在被测物质中加入稀酸溶液,如果产生能使澄清石灰水变浑浊的气体,则原被测物质中含碳酸根离子。 2.(在溶液中):在被测溶液中加入氯化钡或硝酸银溶液,如果产生能溶于硝酸的白色沉淀,且同时生成能使澄清的石灰水变浑浊的气体,则原被测溶液中含碳酸根离子。 注: 1、在鉴别Cl-和SO42-时,用氯化钡溶液,不要用硝酸银溶液,这是因为硫酸银为微溶性物质,使鉴别现象不明显。 2、在一未知溶液中加入氯化钡溶液,若产生不溶于硝酸的白色沉淀,则原被测液中可能含银离子也可能含硫酸根离子。 七、物质的颜色 1、固体(多为白色) 黑色:CuO、C粉、MnO、2Fe3O4、 紫黑色:KMnO4 红色:Cu、Fe2O3 红褐色:Fe(OH)3 蓝色:Cu(OH)2、CuSO4.5H2O 绿色:Cu2(OH)2CO3 2、溶液(多为无色) 浅绿色溶液:(亚铁盐溶液)FeCl2溶液、FeSO4; 黄色溶液:(铁盐溶液)FeCl3溶液、Fe2(SO4)3 溶液、Fe(NO3)3; 蓝色溶液:(铜盐溶液)CuCl2溶液、CuSO4溶液、Cu(NO3)2; 蓝绿色溶液:CuCl2溶液(较浓)。 八、酸、碱、盐的特性 1、浓盐酸:有挥发性、有刺激性气味、在空气中能形成酸雾。 2、浓硝酸:有挥发性、有刺激性气味、在空气中能形成酸雾,有强氧化性。 3、浓硫酸:无挥发性。粘稠的油状液体。有很强的吸水性和脱水性,溶水时能放出大量的热。有强氧化性。 4、氢氧化钙:白色粉末、微溶于水。 5、氢氧化钠:白色固体、易潮解,溶水时放大量热。能与空气中的二氧化碳反应而变质。 6、硫酸铜:白色粉末、溶于水后得蓝色溶液(从该溶液中析出的蓝色晶体为五水合硫酸铜CuSO4.5H2O)。 7、碳酸钠:白色粉末,水溶液为碱性溶液(从溶液中析出的白色晶体为碳酸钠晶体Na2CO3.10H2O)。 8、氨水(NH3.H2O):属于碱的溶液。 九、酸与碱的通性和盐的性质 1、酸的通性 (1)酸溶液能使紫色的石蕊试液变红,不能使无色的酚酞试液变色; (2)酸能与活泼金属反应生成盐和氢气; (3)酸能与碱性氧化物反应生成盐和水; (4)酸能与碱反应生成盐和水; (5)酸能与某些盐反应生成新的盐和新的酸。 2、碱的通性 (1)碱溶液能使紫色的石蕊试液变蓝,并能使无色的酚酞试液变红色; (2)碱能与酸性氧化物反应生成盐和水; (3)碱能与酸反应生成盐和水; (4)某些碱能与某些盐反应生成新的盐和新的碱。 3、盐的性质 (1)某些盐能与较活泼的金属反应生成新的盐和金属; (2)某些盐能与酸反应生成新的盐和新的酸; (3)某些盐能与某些碱反应生成新的盐和新的碱。 一、初中化学常见物质的分类 1、单质:非惰性气体一般由两个原子组成:F 2 ,O 2 ,H 2 ,Cl 2 2、惰性气体:一般由一个原子组成:He,Ne,Ar,Kr,Xe 3、化合物:氢化物居多:H 2 S,HCl,H 3 P,HF,HBr,HI 二、初中化学常见物质的颜色 (一)、固体的颜色 1、红色固体:铜,氧化铁 2、绿色固体:碱式碳酸铜 3、蓝色固体:氢氧化铜,硫酸铜晶体 4、紫黑色固体:高锰酸钾 5、淡黄色固体:硫磺 6、无色固体:冰,干冰,金刚石 7、银白色固体:银,铁,镁,铝,汞等金属 8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭) 9、红褐色固体:氢氧化铁 10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁 (二)、液体的颜色 11、无色液体:水,双氧水 12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液 13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液 14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液 15、紫红色溶液:高锰酸钾溶液 16、紫色溶液:石蕊溶液 (三)、气体的颜色 17、红棕色气体:二氧化氮 18、黄绿色气体:氯气 19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢等气体。 三、初中化学敞口置于空气中质量改变的 (一)质量增加的 1、由于吸水而增加的:氢氧化钠固体,氯化钙,氯化镁,浓硫酸; 2、由于跟水反应而增加的:氧化钙、氧化钡、氧化钾、氧化钠,硫酸铜; 3、由于跟二氧化碳反应而增加的:氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙; (二)质量减少的 1、由于挥发而减少的:浓盐酸,浓硝酸,酒精,汽油,浓氨水; 2、由于风化而减少的:碳酸钠晶体。 四、初中化学物质的检验 (一)、气体的检验 1、氧气:带火星的木条放入瓶中,若木条复燃,则是氧气. 2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气. 3、二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳. 4、氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气. 5、水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气. (二)、离子的检验. 6、氢离子:滴加紫色石蕊试液/加入锌粒 7、氢氧根离子:酚酞试液/硫酸铜溶液 8、碳酸根离子:稀盐酸和澄清的石灰水 9、氯离子:硝酸银溶液和稀硝酸,若产生白色沉淀,则是氯离子 10、硫酸根离子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴入氯化钡 11、铵根离子:氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口 12、铜离子:滴加氢氧化钠溶液,若产生蓝色沉淀则是铜离子 13、铁离子:滴加氢氧化钠溶液,若产生红褐色沉淀则是铁离子 (三)、相关例题 14、如何检验NaOH是否变质:滴加稀盐酸,若产生气泡则变质 15、检验生石灰中是否含有石灰石:滴加稀盐酸,若产生气泡则含有石灰石 16、检验NaOH中是否含有NaCl:先滴加足量稀硝酸,再滴加AgNO 3 溶液,若产生白色沉淀,则含有NaCl。 五、初中化学之三 1、我国古代三大化学工艺:造纸,制火药,烧瓷器。 2、氧化反应的三种类型:爆炸,燃烧,缓慢氧化。 3、构成物质的三种微粒:分子,原子,离子。 4、不带电的三种微粒:分子,原子,中子。 5、物质组成与构成的三种说法: (1)、二氧化碳是由碳元素和氧元素组成的; (2)、二氧化碳是由二氧化碳分子构成的; (3)、一个二氧化碳分子是由一个碳原子和一个氧原子构成的。 6、构成原子的三种微粒:质子,中子,电子。 7、造成水污染的三种原因:(1)工业“三废”任意排放,(2)生活污水任意排放 (3)农药化肥任意施放 8、收集方法的三种方法:排水法(不容于水的气体), 向上排空气法(密度比空气大的气体), 向下排空气法(密度比空气小的气体)。 9、质量守恒定律的三个不改变:原子种类不变,原子数目不变,原子质量不变。 10、不饱和溶液变成饱和溶液的三种方法:增加溶质,减少溶剂,改变温度(升高或降低)。 11、复分解反应能否发生的三个条件:生成水、气体或者沉淀 12、三大化学肥料:N、P、K 13、排放到空气中的三种气体污染物:一氧化碳、氮的氧化物,硫的氧化物。 14、燃烧发白光的物质:镁条,木炭,蜡烛(二氧化碳和水)。 15、具有可燃性,还原性的物质:氢气,一氧化碳,单质碳。 16、具有可燃性的三种气体是:氢气(理想),一氧化碳(有毒),甲烷(常用)。 17、CO的三种化学性质:可燃性,还原性,毒性。 18、三大矿物燃料:煤,石油,天然气。(全为混合物) 19、三种黑色金属:铁,锰,铬。 20、铁的三种氧化物:氧化亚铁,三氧化二铁,四氧化三铁。 21、炼铁的三种氧化物:铁矿石,焦炭,石灰石。 22、常见的三种强酸:盐酸,硫酸,硝酸。 23、浓硫酸的三个特性:吸水性,脱水性,强氧化性。 24、氢氧化钠的三个俗称:火碱,烧碱,苛性钠。 25、碱式碳酸铜受热分解生成的三种氧化物:氧化铜,水(氧化氢),二氧化碳。 26、实验室制取C O 2 不能用的三种物质:硝酸,浓硫酸,碳酸钠。 27、酒精灯的三个火焰:内焰,外焰,焰心。 28、使用酒精灯有三禁:禁止向燃着的灯里添加酒精,禁止用酒精灯去引燃另一只酒精灯,禁止用嘴吹灭酒精灯。 29、玻璃棒在粗盐提纯中的三个作用:搅拌、引流、转移 30、液体过滤操作中的三靠:(1)倾倒滤液时烧杯口紧靠玻璃棒,(2)玻璃棒轻靠在三层滤纸的一端,(3)漏斗下端管口紧靠烧杯内壁。 31、固体配溶液的三个步骤:计算,称量,溶解。 32、浓配稀的三个步骤:计算,量取,溶解。 33、浓配稀的三个仪器:烧杯,量筒,玻璃棒。 34、三种遇水放热的物质:浓硫酸,氢氧化钠,生石灰。 35、过滤两次滤液仍浑浊的原因:滤纸破损,仪器不干净,液面高于滤纸边缘。 36、药品取用的三不原则:不能用手接触药品,不要把鼻孔凑到容器口闻药品的气味,不得尝任何药品的味道。 37、金属活动顺序的三含义: (1)金属的位置越靠前,它在水溶液中越容易失去电子变成离子,它的活动性就越强; (2)排在氢前面的金属能置换出酸里的氢,排在氢后面的金属不能置换出酸里的氢; (3)排在前面的金属能把排在后面的金属从它们的盐溶液中置换出来。 38、温度对固体溶解度的影响: (1)大多数固体物质的溶解度随着温度的升高而增大, (2)少数固体物质的溶解度受温度影响变化不大 (3)极少数固体物质的溶解度随着温度的升高而减小。 39、影响溶解速度的因素:(1)温度,(2)是否搅拌(3)固体颗粒的大小 40、使铁生锈的三种物质:铁,水,氧气。 41、溶质的三种状态:固态,液态,气态。 42、影响溶解度的三个因素:溶质的性质,溶剂的性质,温度。 六、初中化学常见混合物的重要成分 1、空气:氮气(N 2 )和氧气(O 2 ) 2、水煤气:一氧化碳(CO)和氢气(H 2 ) 3、煤气:一氧化碳(CO) 4、天然气:甲烷(CH 4 ) 5、石灰石/大理石:(CaCO 3 ) 6、生铁/钢:(Fe) 7、木炭/焦炭/炭黑/活性炭:(C) 8、铁锈:(Fe 2 O 3 ) 七、初中化学常见物质俗称 1、氯化钠(NaCl):食盐 2、碳酸钠(Na 2 CO 3 ):纯碱,苏打,口碱 3、氢氧化钠(NaOH):火碱,烧碱,苛性钠 4、氧化钙(CaO):生石灰 5、氢氧化钙(Ca(OH) 2 ):熟石灰,消石灰 6、二氧化碳固体(CO 2 ):干冰 7、氢氯酸(HCl):盐酸 8、碱式碳酸铜(Cu 2 (OH) 2 CO 3 ):铜绿 9、硫酸铜晶体(CuSO 4 .5H 2 O):蓝矾,胆矾 10、甲烷(CH 4 ):沼气 11、乙醇(C 2 H 5 OH):酒精 12、乙酸(CH 3 COOH):醋酸 13、过氧化氢(H 2 O 2 ):双氧水 14、汞(Hg):水银 15、碳酸氢钠(NaHCO 3 ):小苏打 八、物质的除杂 1、CO2(CO):把气体通过灼热的氧化铜, 2、CO(CO 2 ):通过足量的氢氧化钠溶液 3、H 2 (水蒸气):通过浓硫酸/通过氢氧化钠固体 4、CuO(C):在空气中(在氧气流中)灼烧混合物 5、Cu(Fe):加入足量的稀硫酸 6、Cu(CuO):加入足量的稀硫酸 7、FeSO 4 (CuSO 4 ):加入足量的铁粉 8、NaCl(Na 2 CO 3 ):加入足量的盐酸 9、NaCl(Na 2 SO 4 ):加入足量的氯化钡溶液 10、NaCl(NaOH):加入足量的盐酸 11、NaOH(Na 2 CO 3 ):加入足量的氢氧化钙溶液 12、NaCl(CuSO 4 ):加入足量的氢氧化钡溶液 13、NaNO 3 (NaCl):加入足量的硝酸银溶液 14、NaCl(KNO 3 ):蒸发溶剂 15、KNO 3 (NaCl):冷却热饱和溶液。 16、CO 2 (水蒸气):通过浓硫酸。 九、化学之最 1、未来最理想的燃料是H 2 。 2、最简单的有机物是CH 4 。 3、密度最小的气体是H 2 。 4、相对分子质量最小的物质是H 2 。 5、相对分子质量最小的氧化物是H 2 O。 6、化学变化中最小的粒子是原子。 7、PH=0时,酸性最强,碱性最弱。 PH=14时,碱性最强,酸性最弱。 8、土壤里最缺乏的是N,K,P三种元素,肥效最高的氮肥是尿素。 9、天然存在最硬的物质是金刚石。 10、最早利用天然气的国家是中国。 11、地壳中含量最多的元素是氧。 12、地壳中含量最多的金属元素是铝。 13、空气里含量最多的气体是氮气。 14、空气里含量最多的元素是氮。 15、当今世界上最重要的三大化石燃料是煤,石油,天然气。 16、形成化合物种类最多的元素:碳 十、有关不同 1、金刚石和石墨的物理性质不同:是因为碳原子排列不同。 2、生铁和钢的性能不同:是因为含碳量不同。 3、一氧化碳和二氧化碳的化学性质不同:是因为分子构成不同。 (氧气和臭氧的化学性质不同是因为分子构成不同;水和双氧水的化学性质不同是因为分子构成不同。) 4、元素种类不同:是因为质子数不同。 5、元素化合价不同:是因为最外层电子数不同。 6、钠原子和钠离子的化学性质不同:是因为最外层电子数不同 十一:有毒的物质 1、有毒的固体:亚硝酸钠(NaNO 2 ),乙酸铅等; 2、有毒的液体:汞,硫酸铜溶液,甲醇,含Ba 2 +的溶液(除BaSO 4 ); 3、有毒的气体:CO,氮的氧化物,硫的氧化物。 十二:实验室制法 1、实验室氧气:2KMnO 4 =====2K 2 MnO 4 +MnO 2 +O 2 ↑ 2KClO 3 =======2KCl+3O 2 ↑ 2H 2 O 2 =======2H 2 O+O 2 ↑ 2、实验室制氢气 Zn+H 2 SO 4 ===ZnSO 4 +H 2 ↑(常用);Fe+H 2 SO 4 ===FeSO 4 +H 2 ↑ Mg+H 2 SO 4 ===MgSO 4 +H 2 ;2Al+3H 2 SO 4 ==Al 2 (SO 4 ) 3 +3H 2 ↑ Zn+2HCl===ZnCl 2 +H 2 ↑;Fe+2HCl===FeCl 2 +H 2 ↑ Mg+2HCl===MgCl 2 +H 2 ↑;2Al+6HCl===2AlCl 3 +3H 2 ↑ 4、实验室制CO 2 : CaCO 3 +2HCl==CaCl 2 +CO 2 ↑+H 2 O 十三:工业制法 1、O 2 :分离液态空气 2、CO 2 :高温煅烧石灰石(CaCO 3 =========CaO+CO 2 ↑) 3、H 2 :天然气和水煤气 4、生石灰:高温煅烧石灰石(CaCO 3 =========CaO+CO 2 ↑) 5、熟石灰:CaO+H 2 O==Ca(OH) 2 6、烧碱:Ca(OH) 2 +Na 2 CO 3 ===CaCO 3 ↓+2Na OH 十四:初中常见化学反应归类 化合反应 1、镁在空气中燃烧:2Mg+O 2 点燃2MgO 2、铁在氧气中燃烧:3Fe+2O 2 点燃Fe 3 O 4 3、铝在空气中燃烧:4Al+3O 2 点燃2Al 2 O 3 4、氢气在空气中燃烧:2H2+O 2 点燃2H 2 O 5、红磷在空气中燃烧:4P+5O 2 点燃2 P 2O 5 6、硫粉在空气中燃烧:S+O 2 点燃SO 2 7、碳在氧气中充分燃烧:C+O 2 点燃CO 2 8、碳在氧气中不充分燃烧:2C+O 2 点燃2CO 9、二氧化碳通过灼热碳层:C+CO 2 高温2CO 10、一氧化碳在氧气中燃烧:2CO+O 2 点燃2CO 2 11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO 2 +H 2 O=H 2 CO 3 12、生石灰溶于水:CaO+H2O=Ca(OH) 2 13、无水硫酸铜作干燥剂:CuSO4+5H 2 O=CuSO 4 •5H 2 O 14、钠在氯气中燃烧:2Na+Cl 2 点燃2NaCl 分解反应 15、实验室用双氧水制氧气:2H 2 O 2 MnO 2 2H 2 O+O 2 ↑ 16、加热高锰酸钾:2KMnO 4 加热K 2 MnO 4 +MnO 2 +O 2 ↑ 17、水在直流电的作用下分解:2H 2 O通电2H 2 ↑+O 2 ↑ 18、碳酸不稳定而分解:H 2 CO 3 =H 2 O+CO 2 ↑ 19、高温煅烧石灰石(二氧化碳工业制法):CaCO 3 高温CaO+CO 2 ↑ 置换反应 20、铁和硫酸铜溶液反应:Fe+CuSO 4 =FeSO 4 +Cu 21、锌和稀硫酸反应(实验室制氢气):Zn+H 2 SO 4 =ZnSO 4 +H 2 ↑ 22、镁和稀盐酸反应:Mg+2HCl=MgCl 2 +H 2 ↑ 23、氢气还原氧化铜:H2+CuO加热Cu+H 2 O 24、木炭还原氧化铜:C+2CuO高温2Cu+CO 2 ↑ 25、甲烷在空气中燃烧:CH 4 +2O 2 点燃CO 2 +2H 2 O 26、水蒸气通过灼热碳层:H 2 O+C高温H 2 +CO 27、焦炭还原氧化铁:3C+2Fe 2 O 3 高温4Fe+3CO 2 ↑ 其他 28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO 4 ==Cu(OH) 2 ↓+Na 2 SO 4 29、甲烷在空气中燃烧:CH 4 +2O 2 点燃CO 2 +2H 2 O 30、酒精在空气中燃烧:C2H 5 OH+3O 2 点燃2CO 2 +3H 2 O 31、一氧化碳还原氧化铜:CO+CuO加热Cu+CO 2 32、一氧化碳还原氧化铁:3CO+Fe 2 O 3 高温2Fe+3CO 2 33、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH) 2 +CO 2 =CaCO 3 ↓+H 2 O 34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+CO 2 ====Na 2 CO 3 +H 2 O 35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法): CaCO 3 +2HCl===CaCl 2 +H 2 O+CO 2 ↑ 36、碳酸钠与浓盐酸反应(泡沫灭火器的原理):Na 2 CO 3 +2HCl===2NaCl+H 2 O+CO 2 ↑ 十五:初中化学常考的几个反应 一、物质与氧气的反应: (1)单质与氧气的反应: 1.镁在空气中燃烧:2Mg+O 2 点燃2MgO 2.铁在氧气中燃烧:3Fe+2O 2 点燃Fe 3 O 4 3.铜在空气中受热:2Cu+O 2 加热2CuO 4.铝在空气中燃烧:4Al+3O 2 点燃2Al 2 O 3 5.氢气中空气中燃烧:2H 2 +O 2 点燃2H 2 O 6.红磷在空气中燃烧:4P+5O 2 点燃2P 2 O 5 7.硫粉在空气中燃烧:S+O 2 点燃SO 2 8.碳在氧气中充分燃烧:C+O 2 点燃CO 2 9.碳在氧气中不充分燃烧:2C+O 2 点燃2CO (2)化合物与氧气的反应: 10.一氧化碳在氧气中燃烧:2CO+O 2 点燃2CO 2 11.甲烷在空气中燃烧:CH 4 +2O 2 点燃CO 2 +2H 2 O 12.酒精在空气中燃烧:C 2 H 5 OH+3O 2 点燃2CO 2 +3H 2 O 二、几个分解反应: 13.水在直流电的作用下分解:2H 2 O通电2H 2 ↑+O 2 ↑ 14.加热碱式碳酸铜:Cu 2 (OH)2CO 3 加热2CuO+H 2 O+CO 2 ↑ 15.加热氯酸钾(有少量的二氧化锰):2KClO3====2KCl+3O 2 ↑ 16.加热高锰酸钾:2KMnO 4 加热K2MnO 4 +MnO 2 +O 2 ↑ 17.碳酸不稳定而分解:H 2 CO 3 ===H2O+CO 2 ↑ 18.高温煅烧石灰石:CaCO 3 高温CaO+CO 2 ↑ 三、几个氧化还原反应: 19.氢气还原氧化铜:H2+CuO加热Cu+H 2 O 20.木炭还原氧化铜:C+2CuO高温2Cu+CO 2 ↑ 21.焦炭还原氧化铁:3C+2Fe 2 O 3 高温4Fe+3CO 2 ↑ * 注:由于排版器功能有限,部分化学式书写格式不严谨,请同学们按照课本及老师要求严格书写及记忆~ 素材:综合整理自网络,版权归原作者所有,文章贵在分享,如涉及侵权,请联系小编删除。 编辑:宇安返回搜狐,查看更多 |
【本文地址】