| Science:给Suzuki | 您所在的位置:网站首页 › 偶联反应分类有哪几种 › Science:给Suzuki |
Science:给Suzuki
|
Science:给Suzuki-Miyaura偶联加点“氮”
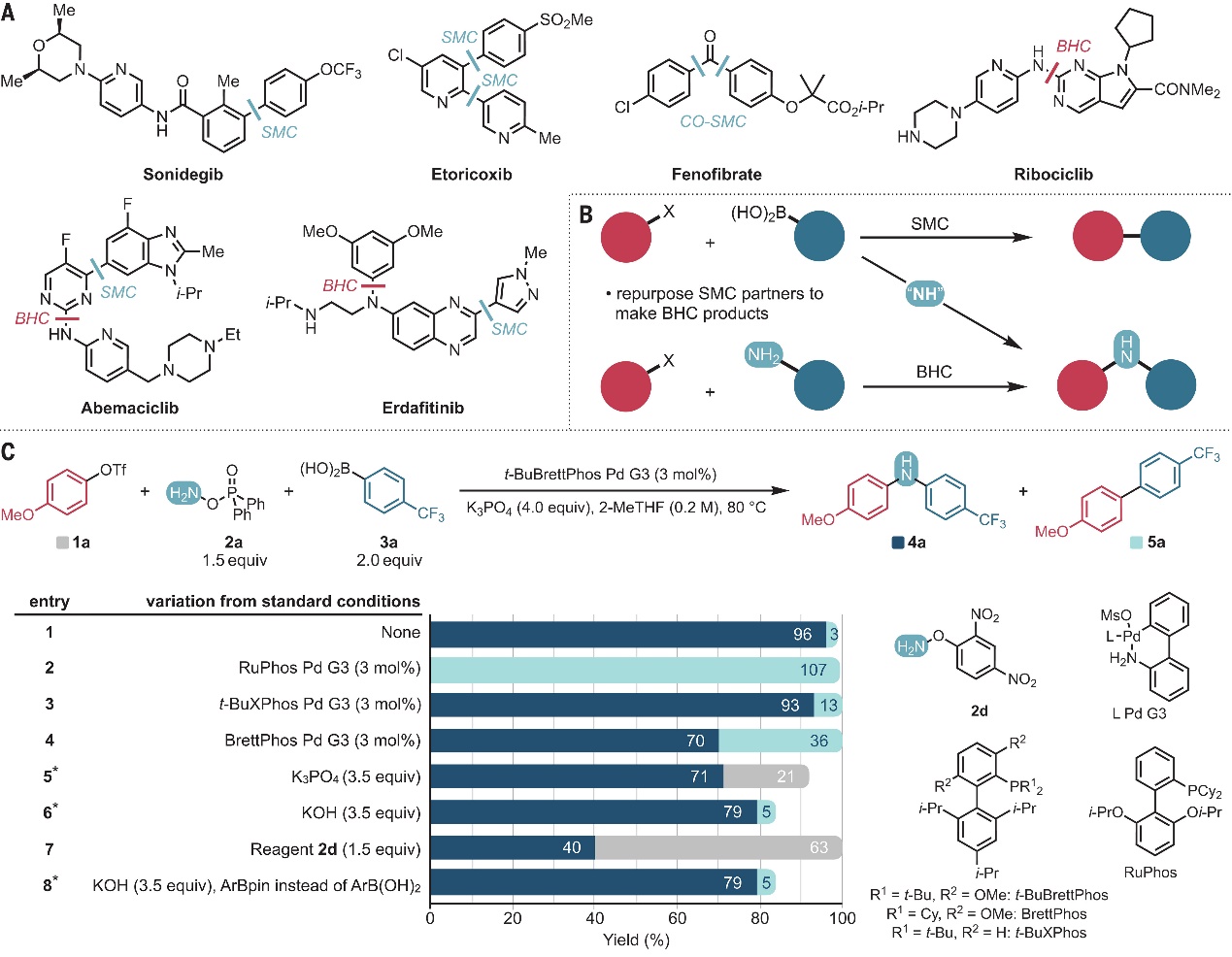
在过去的几十年里,过渡金属催化的交叉偶联反应已成为有机合成的重要手段之一,广泛应用于合成药物分子、天然产物、农业化学、储能材料和功能聚合物等领域,例如,Suzuki-Miyaura偶联反应和Buchwald-Hartwig偶联反应分别被广泛用于形成碳-碳(C-C)键和碳-氮(C-N)键,在药物分子合成中应用颇多(图1A)。如果可以拓展交叉偶联反应的产物结构,那么就能增加候选药物分子的结构多样性,从而提高药物开发的速度和成功率。通常情况下,拓展交叉偶联反应的合成实用性研究主要集中于开发催化剂和反应条件,进而使不同的反应性试剂(亲电试剂或亲核试剂)能够参与该反应,例如:芳基亲电试剂的氟化和三氟甲基化、烷基亲电试剂的C-C键偶联、还原性亲电交叉偶联以及用于交叉偶联的C-H键活化。在过去的十年里,后期插入和删除反应作为一种结构多样化策略引起了化学家的广泛关注,例如:Stille羰基化偶联反应可以制备结构多样化的酮产物,但是要想插入其它两亲性组分,尤其是杂原子组分却极具挑战性。 在此前研究基础上,美国哈佛大学的Richard Y. Liu教授课题组设想能否在钯催化的Suzuki-Miyaura交叉偶联途径中引入氮宾插入(图1B),这样就能将原来的联芳基产物(C-C)转变为二芳基胺(C-N-C),后者是生物活性化合物中的一种特殊亚结构单元。然而,实现这种三组分偶联反应需解决以下三大难题:1)如何减缓钯催化的Suzuki-Miyaura交叉偶联反应,而且在氮插入后,金属中心必须能够实现第二个C-N键的形成;2)氮宾试剂的反应性必须精确调整;3)避免自偶联现象的产生。近日,他们利用大位阻膦配体络合的钯催化剂和市售的胺化试剂组合,成功地在Suzuki-Miyaura偶联反应中引入氮宾插入过程,将产物从C-C连接的联芳基变成C-N-C连接的二芳基胺(Buchwald-Hartwig偶联产物)。值得一提的是,该反应可以兼容多种亲电试剂(如:芳基氯化物、溴化物、三氟甲磺酸酯和甲苯磺酸酯),并且能够耐受多种极性官能团以及药物化学相关的杂环。此外,机理研究揭示了键形成的灵活性,这表明胺化交叉偶联反应有可能拓展到不同的亲核试剂和亲电试剂以及四组分变体。相关成果发表在Science 上。
图1. 背景介绍。图片来源:Science 首先,作者选择4-甲氧基苯基三氟甲磺酸酯(1a)和4-(三氟甲基)苯基硼酸(3a)为模板底物对反应条件进优化(图1C),并获得最佳反应条件:即1a、3a和胺试剂O-二苯基膦酰羟胺(DPPH,2a)在t-BuBrettPhos Pd G3(3 mol%)为催化剂、K3PO4(4.0 equiv)为碱、2-MeTHF(0.2 M)为溶剂的条件下于80 ℃反应12 h,能以96%的产率获得所需的胺化偶联产物4a,同时仅有痕量的Suzuki-Miyaura偶联产物5a。
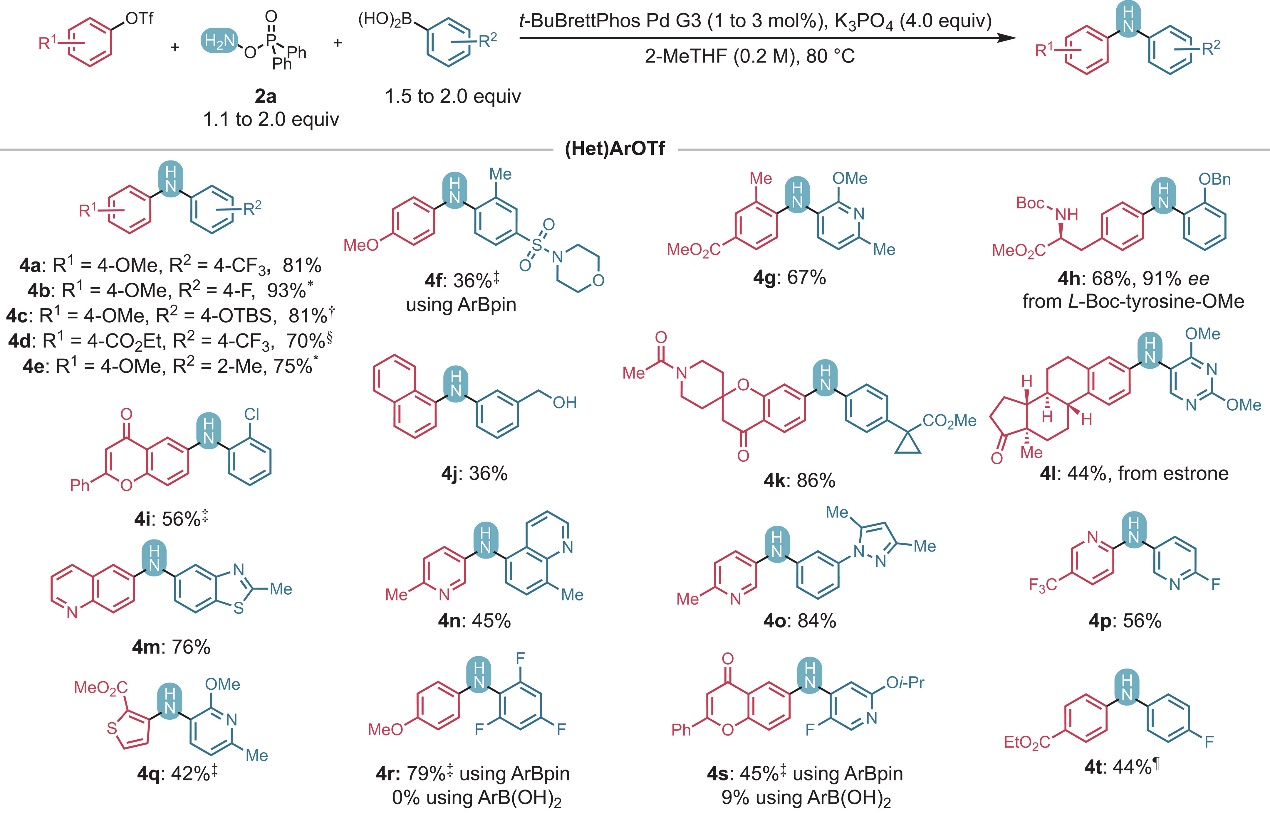
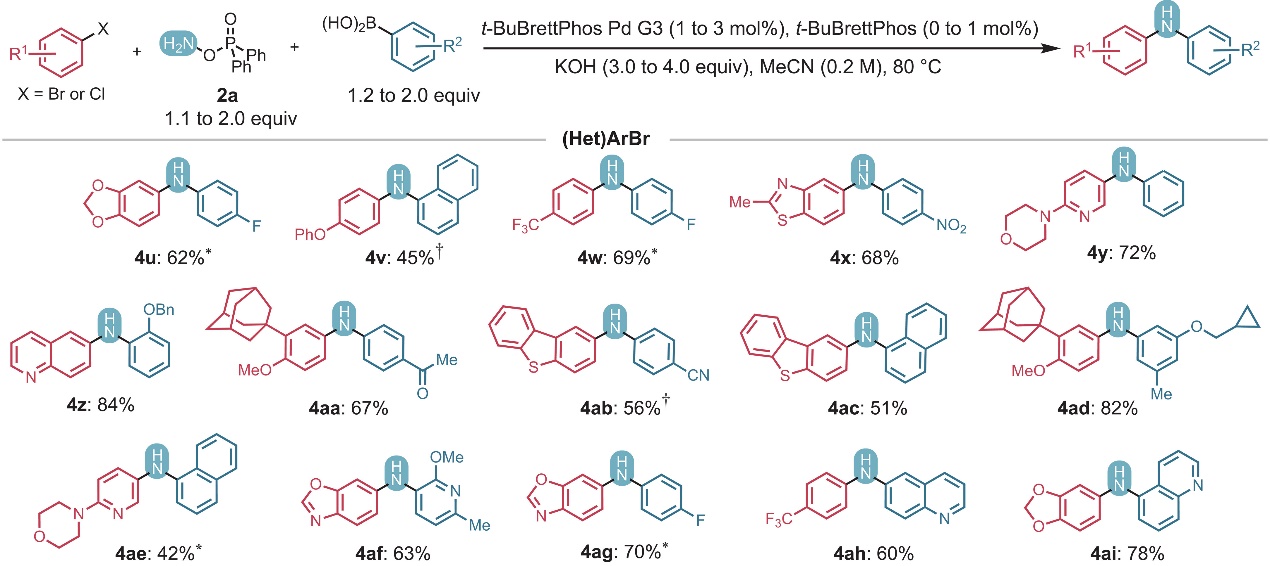
图2. 底物拓展一。图片来源:Science 在最优条件下,作者对底物范围进行了考察(图2、图3),结果显示苯环对位带有供/吸电子基团(4a-4d)、邻位带有甲基(4e-4g、4aj、4al)、烷氧基(4g-4h、4l、4q、4y-4z、4af、4ak)和卤化物(4i、4r-4s)的芳基三氟甲磺酸酯/卤化物和芳基硼酸均能兼容该反应,以中等至良好的产率获得相应产物,其中芳基卤化物进行反应时仅需稍加修改反应条件。类似地,含有羧酸衍生物(如:酰胺(4k)、α-酸性芳基酮(4k、4aa)、烷基酮(4l)、酯基(4d、4g-4h、4k、4q、4am)、氨基甲酸酯(4h、4al))的底物、含氮杂环衍生物(4g、4l、4n-4q、4s、4y、4ae)和稠合杂环衍生物(4m-4n、4ab-4ac、4af-4ag、4ah-4ai、4am)甚至天然产物(如:L-酪氨酸(4h)、雌酮(4l)、黄酮(4i和4s))也能顺利地实现这一转化,而带有伯醇的底物却只能以36%的产率获得产物4j,这可能是由于O-芳基化和醇氧化副反应所致。此外,高度缺电子的硼酸(如:4r和4s)在标准条件下难以进行Suzuki-Miyaura交叉偶联反应,这是因为反应过程中存在快速竞争性的质子化脱硼。有趣的是,如果使用所需硼酸的频哪醇硼酸酯,则能以79%(4r)和45%(4s)的产率获得所需产物。
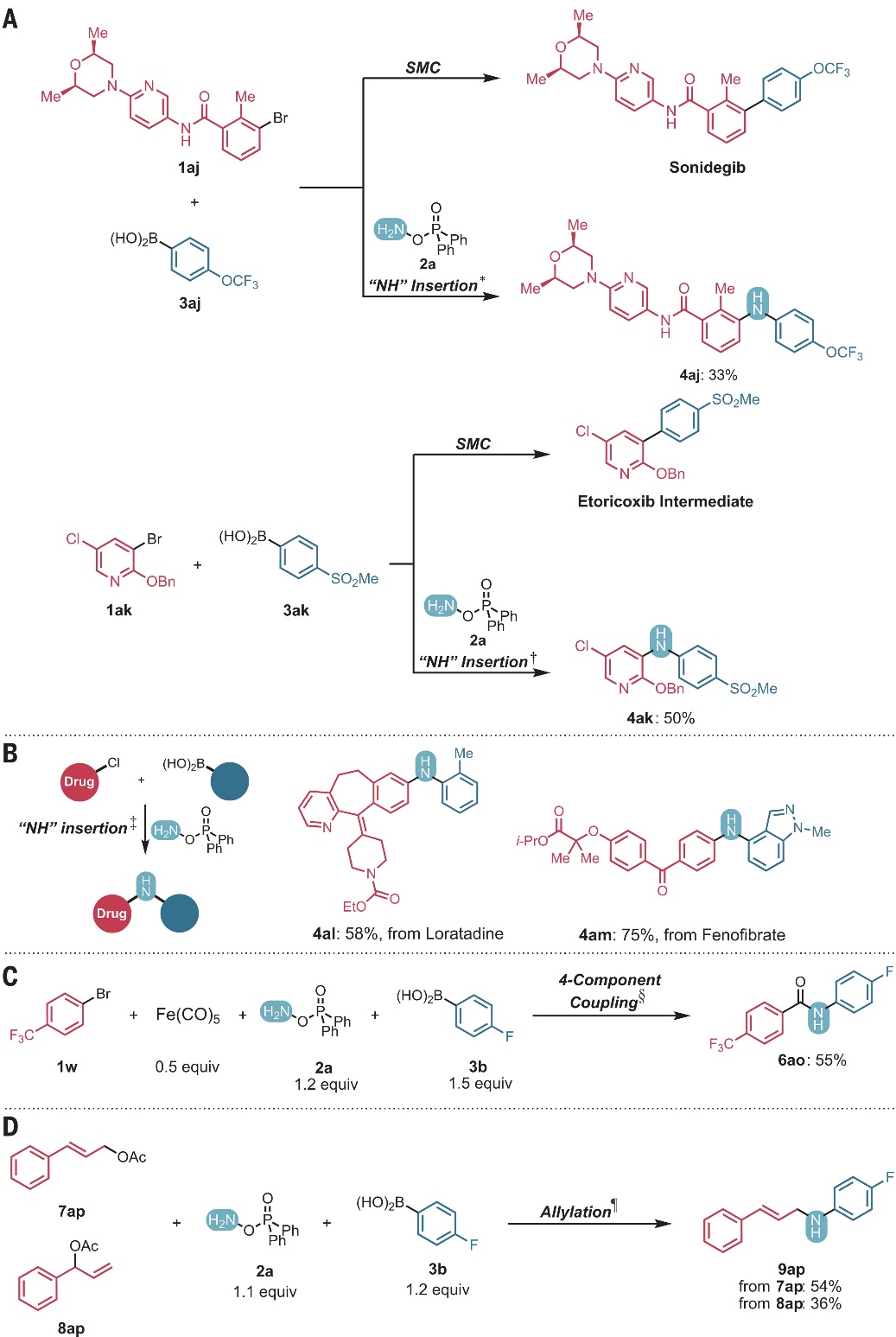
图3. 底物拓展二。图片来源:Science 接下来,作者进行了合成应用,具体而言:1)通常情况下,1aj和3aj经Suzuki-Miyaura交叉偶联反应可以制备Sonidegib(一种用于治疗基底细胞癌的 Smoothened(SMO)抑制剂);若向其中加入DPPH,则能以33%的产率提供N-H键插入类似物4aj(图4A,顶部)。类似地,1ak通过Suzuki-Miyaura偶联反应可以合成依托考昔(用于治疗关节炎疼痛的环氧合酶-2(COX-2)抑制剂),而将1ak和3ak置于胺化偶联条件下,则能以1 mmol规模和50%的产率获得一种改良的依托考昔中间体4ak(图4A,底部);2)利用该方法,以含有芳基氯的药物中间体和小分子药物为原料,分别实现了氯雷他定(4al,产率:58%)和非诺贝特的后期修饰(4am,产率:75%);3)在Suzuki-Miyaura偶联过程中串联插入N-H键和羰基(C=O)便可实现酰胺的合成,例如:1w和3b在2a和五羰基铁[Fe(CO)5]作为羰基源的存在下进行偶联,以55%的产率获得6ao(图4C),这也是传统酰胺合成的一种替代方法;4)N-H键插入也可应用于Pd催化的烯丙基化(Tsuji-Trost)反应(图4D),例如:在未优化的条件下,底物7ap/8ap与胺化试剂2a和硼酸3b进行偶联时,分别以54%和36%的产率提供相同的线性产物9ap,这说明反应是通过Pd π-烯丙基中间体进行的。
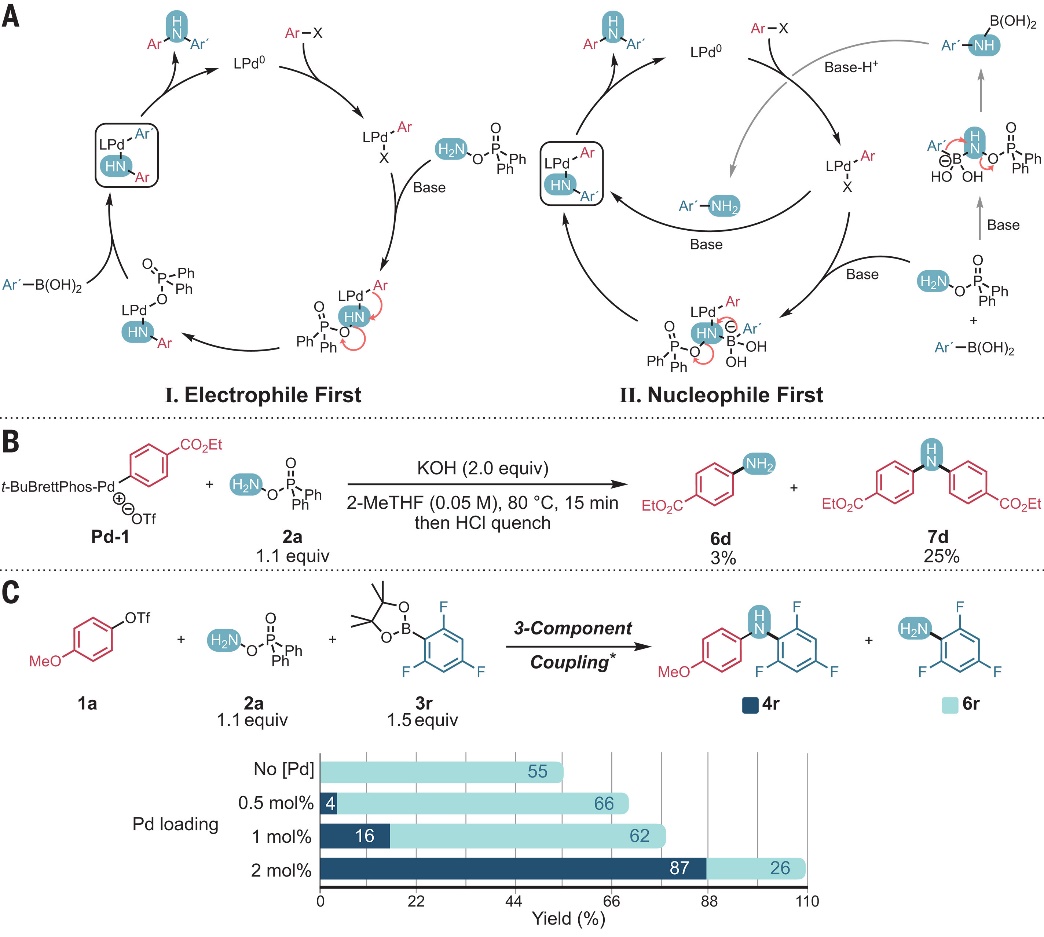
图4. 合成应用。图片来源:Science 如图5A所示,作者提出了两种可能的反应机理:1)Electrophile First(亲电试剂优先,机制I),即芳基亲电试剂形成初始C-N键过程中可能涉及芳基偶联体的1,2-迁移(Pd(II)→去质子化2a)并获得氨基复合物LPd(NHAr)OPOPh2,再与硼酸进行转金属化、还原消除便可得到所需产物。实际上,芳基亲电试剂的胺化可能先于芳基亲核试剂形成C-N键的观点与某些情况下前者衍生苯胺的观察结果相一致,例如:生成4j的反应中分离出8%的1-萘胺。作为进一步的证据,Pd-1与试剂2a在碱的存在下进行化学计量反应时产生3%的苯胺6d和25%的二芳基胺7d,进而表明(拟)卤化物在该反应条件下可以形成 C-N键(图5B)。在没有其它竞争性亲核试剂的情况下,6d与Pd-1的反应可能会形成7d;2)Nucleophile First(亲核试剂优先,机制II),即芳基钯(II)、硼酸和DPPH形成络合物,其中金属的Lewis酸性增加了氮原子的亲电性并促进了芳基的1,2-迁移。由于这一途径,在相同条件下胺化Suzuki反应的产率可以超过预生成苯胺的Buchwald-Hartwig胺化产率。在优化的反应条件下,对于某些底物组合,芳基硼化物可以形成与钯无关的苯胺,并且在一种可能性中,这种苯胺可以通过典型的Buchwald-Hartwig途径进行芳基化,从而形成三组分偶联产物。然而,硼酸酯形成C-N键的总量(4r和6r的产率之和)会随着催化剂负载量的增加而增加,同时4r与6r的相对比率也增加(图5C),这意味着C-N键的形成依赖于Pd。
图5. 机理研究。图片来源:Science 总结 Richard Y. Liu教授以原子插入、分子编辑的策略,利用大位阻膦配体络合的钯催化剂和市售的胺化试剂组合,成功地在Suzuki-Miyaura偶联反应中引入氮宾插入过程,从而将产物从C-C连接的联芳基变成C-N-C连接的二芳基胺(Buchwald-Hartwig偶联产物)。该反应不仅可以兼容多种亲电试剂(如:芳基氯化物、溴化物、三氟甲磺酸酯和甲苯磺酸酯),而且能够耐受多种极性官能团以及药物化学相关的杂环,同时还能实现天然产物和药物分子的后期修饰。 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):
Aminative Suzuki–Miyaura coupling Polpum Onnuch, Kranthikumar Ramagonolla, Richard Y. Liu Science, 2024, 383, 1019-1024. DOI: 10.1126/science.adl5359 (本文由吡哆醛供稿) 如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载! 点击分享 收藏 取消收藏 评论: 0 |
【本文地址】