| Nat. Chem.:活细胞中“捕捉”DNA G | 您所在的位置:网站首页 › 体外结构 › Nat. Chem.:活细胞中“捕捉”DNA G |
Nat. Chem.:活细胞中“捕捉”DNA G
|
Nat. Chem.:活细胞中“捕捉”DNA G-四链体相互作用蛋白质组
1953年,诺贝尔奖得主、英国剑桥大学科学家沃森(James Watson)和克里克(Francis Crick)发表了关于DNA双螺旋结构的经典论文(Nature, 1953, 171, 737–738),开启了以DNA为核心的生命科学研究的新纪元。60年后,英国剑桥大学Shankar Balasubramanian团队发现了一种非经典的四螺旋DNA存在于人类细胞的基因组中,这就是DNA G-四链体(G-quadruplex, G4)(Nat. Chem. Biol., 2012, 8, 301–310; Nat. Biotechnol., 2015, 33, 877–881)。 人类基因组计划的完成,标志着以蛋白质为研究中心的后基因组时代的到来。蛋白质通过与DNA相互作用参与调控各类关键的生命活动,如DNA复制和修复以及基因表达等。开发新颖高效的方法研究细胞内具有特定结构特征或序列的DNA相互作用蛋白质组,有助于从根本上理解其分子机制,不过,这在当前仍是巨大的挑战。  2021年6月28日,Illumina二代测序(NGS)技术发明人、英国皇家学会院士、剑桥大学Shankar Balasubramanian爵士研究团队在国际著名期刊Nature Chemistry 在线发表研究论文,开创性的提出了共结合介导的蛋白质组学分析(Co-binding-mediated protein profiling, CMPP)的设计概念(图1),系统地在活细胞中“捕捉”到了DNA G-四链体的相互作用蛋白质组,并验证了若干个新颖的G-四链体特异结合蛋白。进一步研究揭示了SWI/SNF染色质重塑复合物关键蛋白SMARCA4可能通过结合体内G-四链体而被招募到染色质,并参与转录调控的潜在分子机制。该研究的第一作者是英国剑桥大学化学系的博士后张小昀以及剑桥癌症研究所博士后Jochen Spiegel,通讯作者是Shankar Balasubramanian教授。
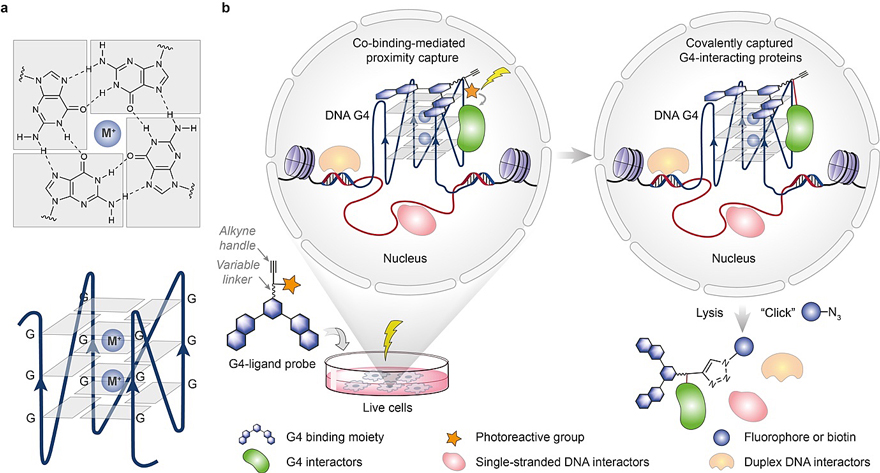
图1. CMPP概念设计示意图。图片来源:Nat. Chem. DNA G4是一种特殊的四链 DNA二级结构,通常能在富含鸟嘌呤碱基的序列中形成(图1a)。近期研究表明,DNA G4存在于人类活细胞中且其形成处于动态平衡。这些G4形成主要集中在染色质开放区域及癌基因的启动子区域,并与转录紧密相关。并且,它们有偏向性的在一些特定亚型乳腺癌组织中形成。此外,不同功能的蛋白能特异地结合G4。由此可知,体内G4动态形成及其功能很可能受到不同类型蛋白质的调控。因此,开发系统性分析G4相互作用蛋白质的方法,不仅能让我们从分子层面了解其作用机制,还有可能为以G4为生物标志物的新的抗肿瘤策略提供启发。目前已有的方法主要依赖于利用人工合成的寡聚G4 DNA从细胞裂解液中亲和富集G4结合蛋白质。然而,这些方法无法实现对活细胞中瞬息万变的微环境下的G4-蛋白质相互作用的分析,尤其是可能损失一些重要的瞬时的但生理上很相关的相互作用。 为了解决该难题,基于前期发现的G4配体小分子和蛋白质能共同结合G4的特点,该团队巧妙设计时空可控的光交联配体小分子探针,他们推测体积相对微小的探针分子在特异性地靶向DNA G4的同时,几乎不干扰G4-蛋白相互作用,从而可能在活细胞里通过附着在G4上的探针分子基于邻近效应实现化学共价交联G4相互作用蛋白质组,该方法被称为CMPP(图1b)。
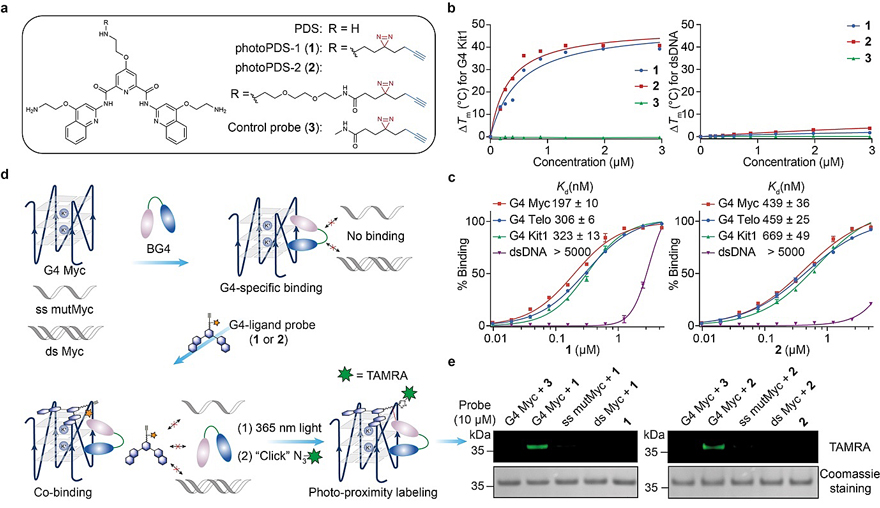
图2. 体外共结合介导的邻近标记G4结合蛋白。图片来源:Nat. Chem. 基于以上设计,作者首先基于G4特异结合小分子Pyridostatin(PDS)结构骨架,合成了G4配体光交联探针photoPDS-1(1)、photoPDS-2(2)以及对照3(图2a)。为了验证探针分子是否保持了G4结合特异性,接着,作者通过荧光能量共振转移(FRET)熔点分析和荧光淬灭(Fluorescence quench)结合实验证明了探针1和2能够高选择性地稳定并结合各类具有不同拓扑结构的G4 DNA(图2b-c)。最后,他们选用G4特异抗体BG4以及经典的G4 DNA—Myc为模型,单链G4突变体DNA序列和相应双链DNA为对照,对CMPP概念进行了体外验证(图2d)。胶内荧光扫描结果表明只有同时与G4 Myc和探针分子1或2 存在的BG4才能被标记,证明BG4极有可能通过与小分子探针共同结合G4 Myc而被邻近共价标记。值得一提的是,含有较短臂长的1具有较高标记效率,说明小分子与BG4结合位点空间上彼此邻近。
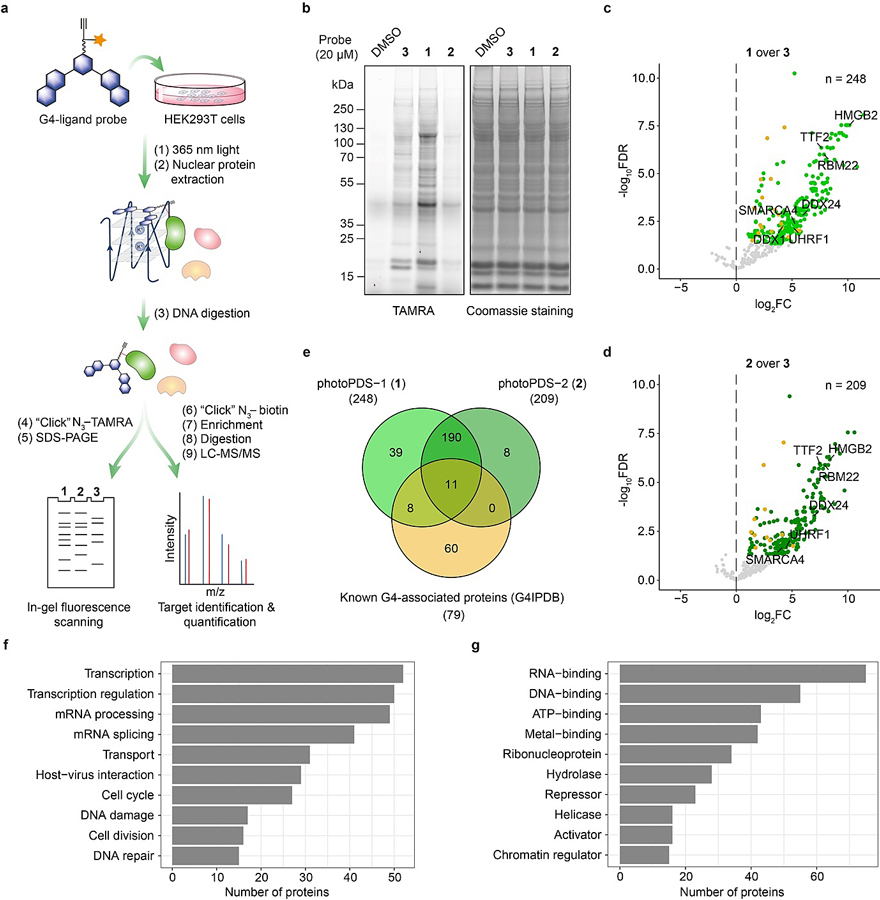
图3. 人类细胞内G4相互作用蛋白质组分析。图片来源:Nat. Chem. 接下来,作者对活细胞中的G4相互作用蛋白质进行了系统性的探索。他们对经探针分子孵育的人胚胎肾细胞(HEK293T)进行原位光交联、核蛋白提取和荧光素或生物素标记(图3a)。1和2标记到一系列的特有蛋白条带(图3b),说明两者都能较好的进入细胞核。随后,作者通过无标记定量质谱分析 ,分别鉴定到248 和 209个1和2特异标记的候选蛋白(图3c-d)。经与数据库G4IPDB (G4 Interacting Proteins DataBase)中已知 G4结合蛋白(79个)对比(图3e),作者发现1和2分别鉴定到了约24%(19/79)和14%(11/79)的已知G4结合蛋白质,表明了该方法具有较高的G4特异性及可信度。 作者分析了1和2鉴定的所有256个蛋白质所涉及的生物过程及其分子功能(图3f-g),发现大多数蛋白都与转录有关(图3f),这与已报道的G4在转录调控中发挥了重要作用相一致。经进一步分析候选蛋白质,作者发现了若干非常有意思的潜在未知G4结合蛋白质,包括表观遗传调控因子UHRF1、转录终止因子TTF2、RNA解旋酶DDX1及DDX24、前体信使RNA拼接因子RBM22以及若干SWI/SNF染色质重塑复合物的重要组成蛋白质,如SMARCA4。
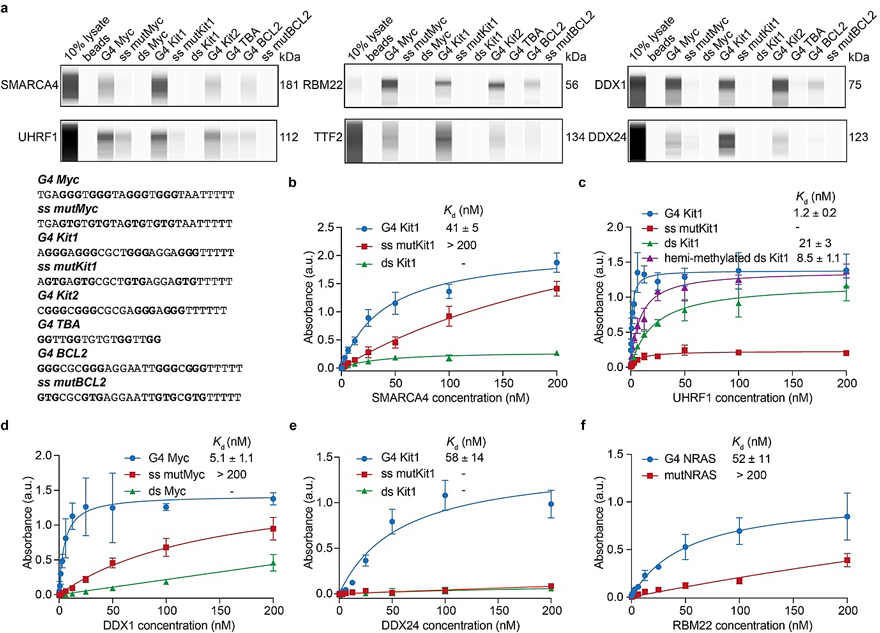
图4. G4选择性结合蛋白质的验证。图片来源:Nat. Chem. 为了验证这些新颖的候选蛋白质(SMARCA4、UHRF1、RBM22、TTF2、DDX24、DDX1及HMGB2)与G4的结合特性,作者选用了一系列3’端修饰有生物素的能形成不同拓扑结构的G4 DNA在HEK293T细胞核裂解液中进行亲和富集并结合蛋白质印迹进行分析。值得注意的是,其中的6个蛋白都较高选择性地结合G4(图4a)。唯独HMGB2只与单链和双链DNA结合,作者推测其可能是结合G4邻近的双链或者对面互补的单链。 由于从细胞核裂解液中亲和富集的方法较难区分蛋白是间接通过形成蛋白复合物还是直接结合G4,作者最后运用酶联免疫分析对纯化的人源重组蛋白(SMARCA4、UHRF1、DDX1、DDX24和RBM22)与G4的直接结合进行了验证(图4b-f)。结果证明5个候选蛋白都是直接结合G4,且具有很高的选择性,进一步证明了CMPP的高效性。
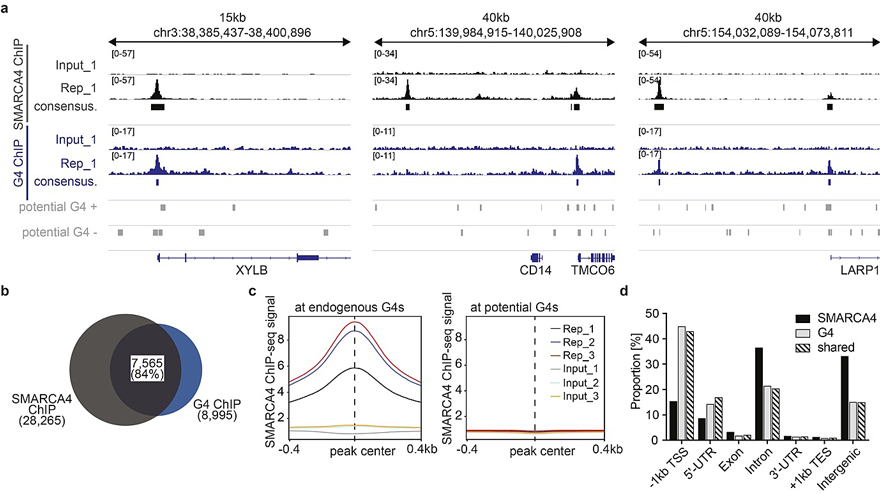
图5. SMARCA4结合内源的G4。图片来源:Nat. Chem. 此前研究表明染色质结构与内源G4的形成密切相关,作者推测染色质重塑关键蛋白质SMARCA4可能与G4s的形成及功能有关。于是作者通过染色质免疫沉淀测序(CHIP-seq)分析了SMARCA4在整个基因组的结合位点(图5)。值得注意的是,高达84%的内源G4的形成位点与SMARCA4的结合位点重合(图5a-b),相反,那些含有G4形成序列但不能被内源G4测序检测到的位点基本没有SMARCA4的结合(图5c),该结果表明SMARCA4在细胞内是直接结合折叠成二级结构的G4而不是只富含鸟嘌呤的双链DNA序列。作者进一步分析发现大部分SMARCA4与G4重叠的结合位点(42%)分布在基因启动子区域(图5d),揭示SMARCA4-G4相互作用对转录调控发挥着重要作用,并且SMARCA4可能通过G4被招募到染色质。 总结 Shankar Balasubramanian教授团队独辟蹊径,开创了无偏向性的活细胞中共结合介导的邻近标记分析G4相互作用蛋白质组的策略,发现了许多新颖的重要体内G4结合蛋白质,并进一步阐明了染色质重塑蛋白质SMARCA4通过结合G4被招募到染色质的另一种潜在的新机制。该工作为后续的G4形成机理和功能的研究,以及以G4为生物标志物的抗肿瘤策略的发展提供了新思路。可以预见,该策略也有望被用于活细胞内具有其他特定结构特征的核酸相互作用的蛋白质组的研究。 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):
Chemical profiling of DNA G-quadruplex-interacting proteins in live cells Xiaoyun Zhang, Jochen Spiegel, Sergio Martínez Cuesta, Santosh Adhikari, Shankar Balasubramanian Nat. Chem., 2021, DOI: 10.1038/s41557-021-00736-9 (本文作者:朱盼) 如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载! 点击分享 收藏 取消收藏 评论: 0 |
【本文地址】