| 科普 | 您所在的位置:网站首页 › 人血白蛋白有哪几种图片 › 科普 |
科普
|
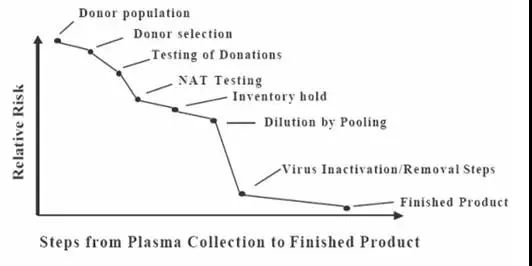
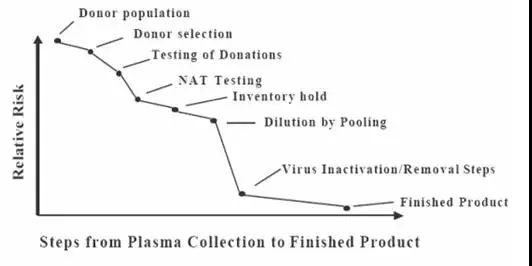
临床上广泛应用的血液制品,因其原料血浆来源于人体,具有潜在的病毒污染的风险。在血液制品的应用史上,亦曾发生血生性病毒疾病的传播。严格控制血液制品的病毒安全性是血液制品应用领域一直关注的主题。各国对血液制品的病毒安全性技术,特别是病毒灭活和去除都有严格的要求和规定。[1-5] 2 血液制品安全性风险的控制 血液制品病毒安全性风险控制是一个综合管理过程。包括献浆人群的筛选、严格献血员的筛检、不断提升的献浆员合格标准、检测方法不断更新换代、检疫期管理、血浆合并与稀释、采用有效的病毒灭活/去除技术、严格的GMP管理。
▲表3 90年代中以来,我们已进入输血、血液制品传播相关传染病风险极低的低危险时期,尤其是血液制品传播乙肝、丙肝、HIV等重大传染性疾病的风险已得到有效控制[6-7]。 1 单采血浆的管理 单采血浆的管理是病毒安全性风险控制的源头,是严把安全性风险的第一关。单采血浆站设置、献血浆者筛选、血浆采集、单采血浆站血浆检测及储存等的管理需符合《血液制品管理条例》和国家卫生行政管理部门的相关规定。 献浆人群的筛选是单采血浆站设置的重要依据。血液制品企业在设置建设单采血浆站时应充分开展当地传染病流行学调查,评估当地重要传染性疾病的风险,将单采浆站建设在重要传染性疾病发生率低的地区。在已建并正常运营的单采浆站,企业也应定期对重要传染性疾病进行再评估,对新生传染性疾病进行流行病学调查,降低各类重要传染疾病可能对血液制品生产带来的风险。 为保障血液制品的安全性,行业以及国家监管部门也在不断提高献浆员的管理以及筛查的相关标准,通过管理以及技术标准降低病毒安全性风险。 2 血浆检测技术与检疫期管理 血浆标记物检测包括单采血浆站的检测和企业的检测,前者主要确认献浆员是否符合相关标准并确认每一次献浆是否符合献浆标准。企业的复检再次确认每一次献浆是否符合相关标准。 血浆是否携带传染性病毒,可通过病毒标记物检测来获知,这类标记物包括病毒DNA或RNA、病毒抗原、或人体免疫应答而产生的抗体。其中DNA或RNA检测技术为核酸筛查(简称NAT)技术,而抗原或抗体检测技术为酶联免疫筛查(ELISA)技术。 虽然随着科学技术的发展,检测技术在不断提高,但是任何一种检测技术都存在局限性。因此,即便检测结果为阴性,也不能完全否定已知病毒的存在。基于检测技术的自身局限性,实施原料血浆检疫期管理可进一步提高血液制品的病毒安全性。 病毒进入人体内开始复制到血浆可检测到病毒标记物称为检测“窗口期”。不同的病毒,采用不同的检测技术,其“窗口期”亦有差异。为避免“窗口期”感染血浆进入生产流程,国家监管部门特制定了“检疫期”管理要求,采用ELISA技术筛查血浆,“检疫期”管理要求为90天;采用NAT技术筛查血浆,检疫期管理要求为60天。通过“检疫期”管理,可避免感染“窗口期”血浆进入生产流程。与国外检疫期管理不同的是,我国要求必须获得献浆员血浆标记物检测合格的证据后,前60天或90天的血浆才能判定为检疫期管理合格血浆,进入生产流程。如不能获得血浆标记物合格的证据,60天或90天内所有血浆(包括检测合格的血浆)都须判定为检测期不合格的血浆,不能用于生产。、
▲表4 不同检测技术检测主要病毒的窗口期 3血浆合并及血浆病毒标记物的检查 血浆混合合并的过程也是对每一份血浆的稀释过程,可有效对因技术原因而漏检的血浆进行有效稀释。中国药典在静丙以及特免生产的要求中,也明确了原料血浆的份数要求,其中IVIG合并血浆的人份数不得小于1000人份,而特免球蛋白要求不得少于100人份。实际生产过程中,多数企业投料生产的合并血浆份数都在10000份或以上,这可有效稀释可能存在的病原体。同时,来源不同人体的血浆中所带病原体中和抗体可进一步降低病毒载量。 血浆混合后,在进行血液制品各组分提取前,企业会按要求对每个合并容器的合并血浆样品,检测HBV、HCV以及HIV病毒标记物,进一步控制原料血浆的病毒安全性。 4 病毒灭活与去除 生产过程中组合的病毒灭活/去除技术是保障血液制品安全性的最有效措施。各步病毒灭活/去除工艺须经验证确认病毒灭活/去除能力。 病毒去除/灭活能力验证的目的是为生产过程灭活/去除相关病毒提供有力证据。除了验证对已知病毒的去除/灭活能力,还需要评估其对未知病毒(或未经筛查的病毒)的去除/灭活能力,需证明生产过程可以清除各种具有不同物理化学特征的病毒,如HCV、B19病毒等。在验证病毒去除/灭活能力的时候,需考虑病毒的大小、形状、耐热性、有无脂包膜以及核酸的种类等因素,以选择合适的模拟病毒。此外,病毒去除/灭活能力的验证应充分考虑产品的生产工艺及生产条件等。 1.巴氏病毒灭活 巴氏病毒灭活工艺是最经典的病毒灭活工艺。40年代,Cohn在发明人血白蛋白的生产工艺——低温乙醇法时,就考虑到防止乙肝病毒传播的风险,在生产工艺中加入了巴氏灭活工艺以保障人血白蛋白的病毒安全性。后续的研究证明,该工艺是病毒灭活谱最广的、最有效的病毒灭活工艺。 巴氏病毒灭活工艺是将蛋白质原液置于60℃条件加热处理10小时灭活病毒。该工艺的不足之处在于对蛋白质的热稳定性要求高。作为生物活性分子的蛋白质,通常情况下对热不稳定,巴氏病毒灭活过程中需添加稳定剂以提高蛋白质的热稳定性。但多数稳定剂对病毒也会起到保护作用因而限制了灭活效果。 2.低pH孵放病毒灭活 低pH灭活技术是传统的病毒灭活技术之一。通常情况下,低pH条件可对蛋白质产生变性作用而使用蛋白质失活。病毒荚膜以及脂包膜上的蛋白质是病毒进入敏感细胞的重要蛋白质分子,在低pH条件下往往失活而导致病毒失去感染细胞的作用,因而灭活病毒。 该灭活工艺的不足之处在于⑴通常情况下,多数血浆蛋白在低pH条件下不稳定,导致该工艺的适用性不广。但免疫球蛋白的稳定条件就是低pH。该方法在目前的血液制品种类中,仅适用于在球蛋白类制品中应用;⑵对非脂包膜病毒的灭活效果有限。 3.纳米膜过滤去除病毒 膜过滤技术是一种膜截流技术,通过纳米级膜的阻挡,小于膜孔径的蛋白质分子透过纳米膜,而大于膜孔径的病毒颗粒被截流,因而获得去除病毒的效果。该病毒去除技术只与膜孔径和病毒有效直径相关。部分大分子血液制品如FVIII的实用性差。 4.S/D病毒灭活 该方法是美国纽约红会学者Horowitz于80年代初发明的病毒灭活方法,以解决80年代初突发的凝血因子传播HIV的问题。S/D(有机溶剂/去污剂)病毒灭活技术是通过S/D对病毒脂包膜蛋白、荚膜蛋白的变性作用使用病毒失活。该灭活谱与低pH灭活工艺的灭活谱相似,对脂包膜病毒灭活效果好,但对非脂包膜病毒的灭活效果有限。 S/D灭活技术常用的灭活条件是在蛋白质原料中加入⑴0.3%TNBP和1%吐温-80,在24℃处理至少6小时;或⑵0.3%TNBP和1%Triton X-100,在24℃处理至少4小时。 因S/D有残留毒性,一般将该技术组合到生产工艺的前端,以利于在生产过程中有效去除S/D,将其残留量降低到无害的水平。 5.干热灭活 干热灭活工艺是将制品冷冻干燥后,加热灭活病毒的技术,通常条件为80℃加热72小时或100℃加热30分钟。 该技术需将制品冻干,故通常将该灭活步骤组合到生产工艺的末端。作为热灭活过程,可能导致蛋白质聚合或变性,该聚合或变性蛋白将无法去除,在临床上可能导致副反应的发生。如FVIII输注后抑制物的产生可能与此有关。 6.分离工艺灭活/去除病毒 通常情况下,病毒颗粒是极易沉淀的物质,在低温乙醇或其它沉淀(如辛酸沉淀、PEG沉淀过程)过程中在沉淀中富集从而达到去除的效果。目前国内普遍采用低温乙醇沉淀法生产人血白蛋白和静注人免疫球蛋白类制品,都是采用选择性沉淀技术分配和沉淀不同的蛋白。白蛋白的生产过程中,病毒可通过FI+II+III以及FIV的沉淀过程有效去除,而球蛋白的生产过程中,病毒可通过FI+III沉淀过程有效去除。[8] 层析技术是因子类产品通用纯化技术。该技术通过凝胶基质上交联的功能基团对蛋白质的选择性吸附或特异性吸附对不同的蛋白质进行分离。病毒颗粒是一种更大的蛋白质与其它物质的复合体,在层析分离特征上与蛋白质有本质的区别,可在层析分离过程中与目标蛋白分离。因而层析技术可有效或部分去除病毒。[9] 7.主要血液制品的常用病毒灭活/去除工艺 ※静注人免疫球蛋白 静注人免疫球蛋白通常采用低pH孵放工艺灭活病毒并经纳米膜过滤进一步降低残留病毒的载量,目前国内普遍采用的低温乙醇分离工艺也能有效去除脂包膜病毒和非脂包膜病毒。良好控制的生产条件下,IVIG生产过程可灭活/去除脂包膜病毒15log以上、非脂包膜病毒9~11log。 ※人血白蛋白 人血白蛋白是血浆蛋白质中对热稳定的蛋白质之一,自40年代首次应用于临床时,便已在生产工艺中采用了巴氏病毒灭活工艺。与IVIG相同,普遍采用的低温乙醇分离工艺亦能有效去除脂包膜病毒和非脂包膜病毒。几十年临床应用结果表明,白蛋白的巴氏消毒法对HIV和肝炎病毒是安全的。到目前为止,未见确证的人血白蛋白传播主要病毒的报道。 ※FVIII及其它因子类制品 因子类制品与白蛋白、球蛋白比较,稳定性差、对低pH稳定性差。通常采用S/D组合干热灭活或纳米过滤等其它方法的两步病毒灭活工艺组合。良好控制的生产条件下,因子类制品生产过程可灭活/去除脂包膜病毒12log以上、非脂包膜病毒7~9log。 5 严格的GMP管理 血液制品生产过程中不同阶段具有不同的病毒安全级别。不同安全级别的生产设施相互独立、独立的人流物流等GMP管理要素是防止交叉污染的重要措施,是保障制品病毒安全的重要手段。 3 血液制品成品中的病毒标记物的解释与理解 病毒感染人体需完整的病毒颗粒。病毒通过表位抗原与敏感细胞膜上的受体结合,然后通过注射或吞噬的方式将遗传物质转移到细胞中,然后在敏感细胞中复制、合成、组装、释放。 上市产品中病原体标记阳性不排除检测试剂的因素。检测试剂可能因技术原因,出现假阳性检测结果,这就需要在国家指定的确认实验室采用指定的确认实验技术进行确认试验。 当病毒标记物确认阳性,亦并不能完全代表制品具有传染性——独立的核酸无法进入敏感细胞而无法复制;仅有抗原而无完整病毒结构或遗传物质,则无法实现细胞内的复制、合成、组装流程;抗体阳性是人体应签的结果而非病毒。无论核酸、抗原、还是抗体检测都不是活病毒的检测结果,仅代表企业在原料血浆管理、生产过程管理中存在缺陷。 判断病原体阳性结果的制品是否具有传染性的金标准应是病毒培养。当病毒培养阳性则真正代表制品存在传播病毒的可能性。 参考资料 [1]WHOTRS 941, Annex4 Recommendations for the production, controland regulation ofhuman plasma for fractionation 2007 [2]WHO TRS 924, Annex 4 Guidelines on Viral inactivation and removal proceduresintended to assure the viral safety of human blood plasma products. 2004 [3]EMEA: Note for Guidance on Virus Valicdation Studies the Design, Contributionand Interpretation of Studies Validating the Inactivation and Removal ofViruses. CPMP/BWP/268/95 [4]EMEA Note for Guidance on Plasma-Derived Medicinal Products. CPMP/BWP/269/95rev.3 [5]国家药品监督管理局.血液制品去除/灭活病毒技术方法及验证指导原则.2002, 国药监注[2002] 160号 [6]Tabor, E. 1999. The epidemiology of virus transmission by plasma derivatives:Clinical studies verifying the lack of transmission of hepatitis B and Cviruses and HIV type 1. Transfusion 39: 1160-1168 [7]GD Minno, et al: Pathogen safety of long-term treatments for bleedingdisorders: still relevant to current practice. Haematologica. 2013,98(10):1495-1498 [8]HO Dichtemuller, et al: Contribution to safety of immunoglobulin and albuminfrom virus partitioning and inactivation by could ethanol fractionation: a datacollection from plasma protein theraypeutics association. Transfusion, 2011,51:1412-1430 [9]T Burnouf: Chromatography in plasma fractionation: benefits and future. JChromato B, 1995, 664:3-15 版 权 声 明 本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系([email protected]),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。返回搜狐,查看更多 |
【本文地址】