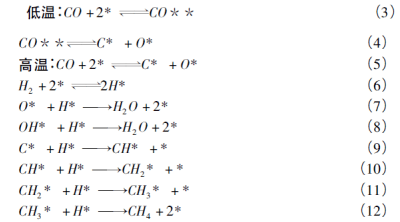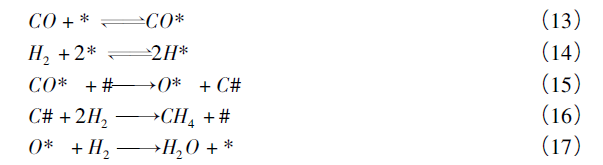| 二氧化碳甲烷化反应机理概述 | 您所在的位置:网站首页 › 二氧化碳制备甲烷 › 二氧化碳甲烷化反应机理概述 |
二氧化碳甲烷化反应机理概述
|
1.2.1 直接反应机理 该过程与水汽变换逆反应基本相同,认为二氧化碳直接与氢气直接生成一氧化碳与水(如式1所示) ,无任何中间体存在。 1.2.2 HCOO-中间体理论
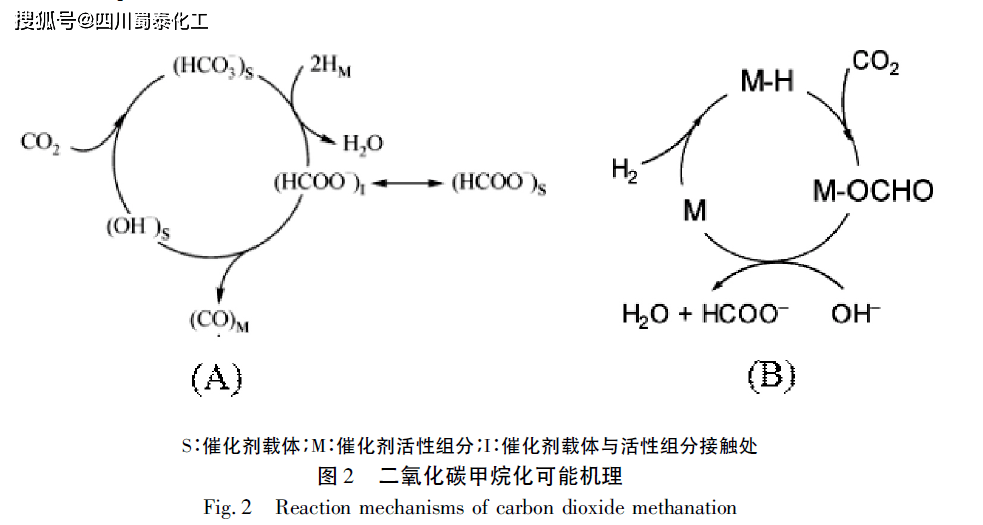
如图2所示,该理论认为HCOO-是CO2生成CO的重要中间体。Marwood等指出二氧化碳首先吸附在催化剂载体的表面,并与载体表面的OH-形成吸附态HCO3-。催化剂活性组分吸附解离的H原子与载体吸附的HCO3-于界面处反应生成HCOO- (该物质可在界面处与载体间移动) ,然后解离为CO类物质与载体上吸附态的OH-(如图2A)。而Prairie等则提出CO2首先与催化剂表面吸附态的H结合生成甲酰类络合物,然后才与OH-反应生成HCOO-中间体(如图2B) 。 2 CO2直接解离生成CO 目前,越来越多的研究表明在甲烷化过程中,在反应过程中不存在CHO,HCOH,HCOO-等中间体,而催化剂表面的碳物质的形成进一步证实了这个问题。CO2可能首先吸附在载体与催化剂的接触面,然后在催化剂活性组分表面解离为吸附态的CO与O(如式2),其中吸附态的CO氢化形成CH4。因此二氧化碳甲烷化与一氧化碳甲烷化反应路径之间有诸多相似之处,根据这一理论已经开发出多种双效催化剂以及仅适用于一氧化碳甲烷化的单效催化剂。而在吸附态的CO与O 如何进一步反应及反应限速步骤的选取上仍存在一些争议,目前相关机理大体可以分为Langmuir-Hinshelwood机理和Eley-Rideal机理两类。
2.1 Langmuir-Hinshelwood机理 Van Meerten等研究了5%Ni/SiO催化一氧化碳甲烷过程,重点研究了在187~567 ℃温度范围该过程的反应动力学与机理。结果表明,一氧化碳的吸附解离路径会随温度的改变发生变化。在低温条件下CO将在催化剂表面活性位吸附,然后解离为C与O; 而在高温条件下,CO直接在活性位解离为C与O(如式3-5),并且分别与H2在活性位表面吸附并解离的H逐步反应,最终生成CH4与H2O。其中,CO与H2在反应过程中将在同一活性位发生竞争吸附。其中,限速步骤可能有两个,分别为吸附态的C与O第二步氢化过程,即式(8)与(10)。而Hayes等开展了Ni/Al2O3在一氧化碳甲烷化中的动态响应研究,而认为解离后的C与H之间的反应(即式9)为限速步骤。
2.2 Eley-Rideal机理 Kammler等研究了超高真空(p<10-7 Pa) Ni表面的碳在气态的H原子作用下氢化的过程。实验结果表明,甲烷是气相中唯一的产物,并且即使没有氢原子存在,吸附态的甲烷依然可以稳定存在。这一实验现象无法用Langmuir- Hinshelwood机理解释,可通过Eley-Rideal机理阐述。该机理认为在催化剂表面存在两个活性位点: 一个活性位(#)仅负责CO解离的C的吸附,而另外一个活性位(*)则吸附其他反应中间物。在反应过程中,CO与H2在*活性位形成竞争吸附,而吸附态的CO 将解离为吸附在#活性位的C与*活性位的O,接下来两种物质分别与空气中的H2(非解离后的氢原子)反应分别生成CH4与H2O。其中普遍认为吸附态的CO的解离与吸附C的氢化(即式15与16)为限速步骤,且限速步骤与反应温度等条件有关,但是何种条件下限速步骤发挥作用暂时没有定论。
3 结论与展望 作为造成温室效应的主要气体之一,二氧化碳的减排已迫在眉睫。同时,作为重要的潜在C1资源,将二氧化碳高效绿色资源化利用具有重要意义。综合环境保护和能源化学两个方面上考虑,二氧化碳甲烷化反应过程将具有非常广阔的发展与应用前景。在工业甲烷化过程中,催化剂的表面常常出现表面碳,所以碳是最有可能的重要中间体。因此,二氧化碳甲烷化可能的反应路径如下,二氧化碳首先在催化剂表面吸附并解离,随后吸附态的一氧化碳逐步氢化生成甲烷。至于具体反应机理与诸多因素有关,目前仍需进一步的研究。返回搜狐,查看更多 |
【本文地址】