| 二甲基一氯硅烷和三氯氢硅的热氯化反应及机理研究 | 您所在的位置:网站首页 › 三氯氢硅生成硅烷的化学方程式 › 二甲基一氯硅烷和三氯氢硅的热氯化反应及机理研究 |
二甲基一氯硅烷和三氯氢硅的热氯化反应及机理研究
|
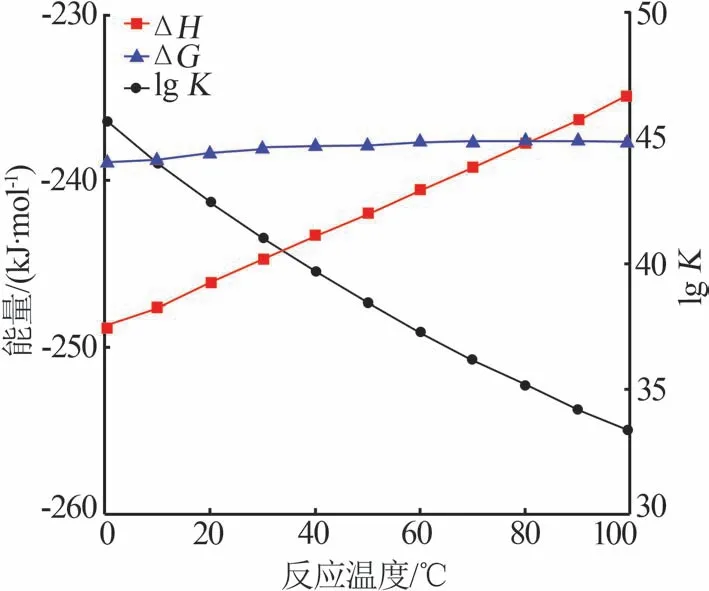
段 锐,贾朝航,徐茂兰,马天悦,彭文才,张建树 (石河子大学化学化工学院,化工绿色过程省部共建国家重点实验室培育基地,新疆石河子 832003) 多晶硅是光伏发电产业和电子半导体行业的基 础原料,对其纯度要求极高。近年来,生产多晶硅的主流工艺是改良西门子法[1-3]。多晶硅是由SiHCl3与H2在还原炉中进行气相沉积反应得到[2],SiHCl3的纯度会影响多晶硅的质量。SiHCl3中的含碳杂质主要是SiHCl3的甲基取代物[甲基氯硅烷,(CH3)nSiCl4-n,n=1~3][4]。然而,SiHCl3中的含碳杂质甲基二氯硅烷(CH3SiHCl2,41.9 ℃)、二甲基一氯硅烷[(CH3)2SiHCl,34.7 ℃]的沸点与SiHCl3的沸点(32.0 ℃)极为接近,在常规精馏中易形成共沸物,很难去除[5]。甲基氯硅烷在精制的SiHCl3中残留,质量分数高达1×10-6[5]。目前,用于降低SiHCl3中含碳杂质的主要方法有吸附法和反应精馏法[6]。 吸附法是利用分子间极性的差异,吸附质与吸附剂络合实现除杂。杨典等[7]以含氨基的树脂为吸附剂,在铂系催化剂下去除SiHCl3中的甲基取代物;在吸附温度为35~45 ℃时,可将2×10-5~7×10-5的甲基含量降至5×10-8以下,但催化剂价格昂贵、生产成本高。王红星等[5]利用分子间尺寸的差异,逐级吸附回收SiHCl3中的CH3SiHCl2和(CH3)2SiHCl;采用的吸附剂为硅胶、树脂、分子筛、活性炭等,吸附温度为20~50 ℃时,可将甲基取代物的含量降至3×10-7以下,但该工艺较为复杂。 反应精馏法是通过氯化反应将SiHCl3中的甲基取代物转化为高氯含量、高沸点的甲基氯硅烷,后续再进行精馏除杂,根据氯源的不同,分为氯气[8]、氯代烃[4,9]、氯硅烷[10-12]等。万烨等[8]提出CH3SiHCl2的光氯化反应,以Cl2为氯源在连续微通道反应器中进行反应,并经过精馏提纯;在最佳反应条件下,CH3SiHCl2的去除率高达99.67%;但该工艺仅适于实验室小试规模。张明鑫等[9]采用Pd/Al2O3催化剂,以CCl4为氯源探究了CH3SiHCl2的催化氯化反应;在最佳工艺条件下,甲基二氯硅烷的转化率为69.76%;该工艺以贵金属为催化剂,生产成本较高。GENG等[10]以活性炭为催化剂、SiCl4为氯源,探究了CH3SiHCl2的氯化反应;最佳反应条件下,CH3SiHCl2的转化率高达85%;但在反应过程中易生成硅颗粒堵塞催化剂的活性位点。 吸附法在生产过程中易达到吸附饱和,延长生产周期,并且吸附剂的选型较为困难;反应精馏法工艺简单,适合大批量生产。目前,CH3SiHCl2的氯化反应研究较多,鲜有关于(CH3)2SiHCl的氯化反应研究。由于(CH3)2SiHCl的沸点更接近SiHCl3的沸点,所以针对(CH3)2SiHCl 氯化反应的研究迫在眉睫。此外,甲基氯硅烷氯化的同时,SiHCl3也可能发生氯化反应[13],SiHCl3和甲基氯硅烷的氯化反应具有竞争关系。因此,本文选择Cl2为氯源,探究在相同条件下SiHCl3、(CH3)2SiHCl 的热氯化反应,并通过密度泛函理论探究反应机理。 1 实验部分1.1 实验试剂(CH3)2SiHCl、(CH2Cl)CH3SiCl2、SiCl4、SiHCl3、(CH3)2SiCl2,均为分析纯;Cl2,纯度≥99.99%。 1.2 实验方法将SiHCl3、(CH3)2SiHCl 分别溶解在SiCl4中,配制成溶质浓度均为0.5 mol/L 的四氯化硅溶液。实验在釜式反应器中进行,先通入氮气多次置换,然后将反应器抽至真空(-0.1 MPa)。将反应器置于恒温水浴中30 min,缓慢充入一定压力的氯气,将SiHCl3或(CH3)2SiHCl溶液通过高压注射器注入反应器中,使n(Cl2)∶n[SiHCl3/(CH3)2SiHCl]=0.6∶1。然后,将反应器置于一定温度的水浴中,开始反应并记录时间,反应后在冰盐浴(-20 ℃)中迅速冷却。结束后缓慢泄压,用气相色谱仪对氯硅烷溶液进行定性定量分析。 1.3 分析检测与表征氯硅烷溶液用GC 9790 plus型气相色谱仪进行分析,载气为高纯氢气,检测器为热导检测器TCD,色谱柱选择不锈钢填充柱(3 m×3 mm,25% DC-550/Chromo)。进样口和检测器的温度均为150 ℃,柱箱温度选择程序升温:先在60 ℃保持2.5 min,然后以30 ℃/min 升温至120 ℃,在120 ℃继续保持2.5 min。通过标准物质的保留时间确定反应产物组分,并根据峰面积确定产物的物质的量分数。SiHCl3的转化率通过式(1)计算,(CH3)2SiHCl 的转化率计算方法和SiHCl3相同。 式中:X(SiHCl3)表示SiHCl3的转化率,%;x(SiHCl3)in、x(SiHCl3)out分别表示反应前后SiHCl3的物质的量分数,%。 此外,为进一步确定反应产物组成,采用Avance Ⅲ型核磁共振波谱仪对产物进行氢谱分析,共振频率为400 MHz。 1.4 计算软件和方法推测SiHCl3可能与Cl2发生反应,因此通过HSCChemistry 热力学软件[14]对其进行热力学分析。该软件的反应平衡热力学计算模块可根据最小吉布斯自由能原理和熵增原理计算反应的吉布斯自由能变ΔG、反应平衡常数K、焓变ΔH,在热力学水平上初步判断反应进行的难易程度。 实验中Cl2、SiHCl3、(CH3)2SiHCl 均为共价化合物,SiCl4为非极性溶剂,则实验中所涉及的反应均为自由基反应。选择量子化学软件Gaussian,通过密度泛函理论(DFT)在B3LYP/6-311G++(2d,p)水平上优化反应物、反应产物和自由基,寻找过渡态(有且仅有一个虚频),并通过内禀坐标(IRC)确定过渡态的结构是否正确连接反应物、过渡态、反应产物[15]。本文中能量E均取自输出文件中的EE+Thermal Free Energy Correction(25 ℃),各反应的能垒EB、能量变化ΔE和解离能DE按式(2)~(4)计算。 2 结果和讨论2.1 Cl2和SiHCl3反应的热力学分析根据最小吉布斯自由能原理和熵增原理,计算0~100 ℃下Cl2和SiHCl3反应[式(5)]的ΔG、K、ΔH,结果如图1 所示。由图1 可知,该反应的ΔG小于-237.7 kJ/mol,且受温度影响较小;ΔH随着温度的上升而上升,从0 ℃的-249.0 kJ/mol增加到100 ℃的-235.0 kJ/mol;lgK随温度的上升而下降,从0 ℃的45.7 降至100 ℃的33.3。因此,Cl2和SiHCl3反应是自发进行的不可逆放热反应。
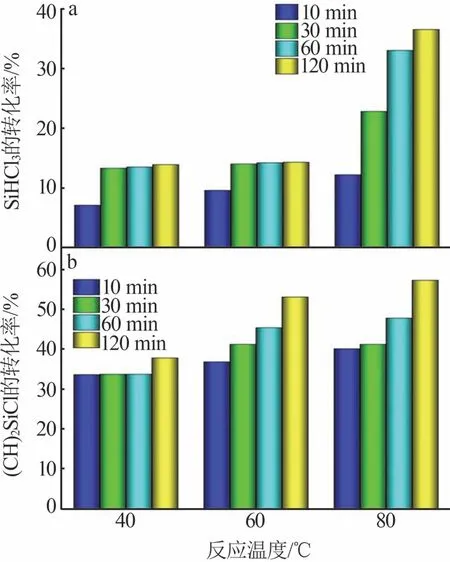
图1 Cl2和SiHCl3反应的热力学数据Fig.1 Thermodynamic datas for reaction of SiHCl3 with Cl2 2.2 SiHCl3、(CH3)2SiHCl氯化反应的实验探究不同温度下,SiHCl3、(CH3)2SiHCl 分别与Cl2反应的转化率如图2 所示。由图2a 可知,在40 ℃和60 ℃时,SiHCl3的转化率较低,小于14.3%,受温度影响较小;在80 ℃时,SiHCl3的转化率随着时间的增加而升高,从10 min 的12.2%升高至120 min 的36.5%。由图2b可知,(CH3)2SiHCl的转化率在40 ℃时较低,在60、80 ℃时均较高且相差不大;60 ℃时,转化率从10 min 的36.8%升高至120 min 的53.1%;80 °C 时,(CH3)2SiHCl 的转化率也随时间的增加而升高,在120 min 时为57.3%。综合考虑,(CH3)2SiHCl转化率最佳的条件为60 ℃、120 min。
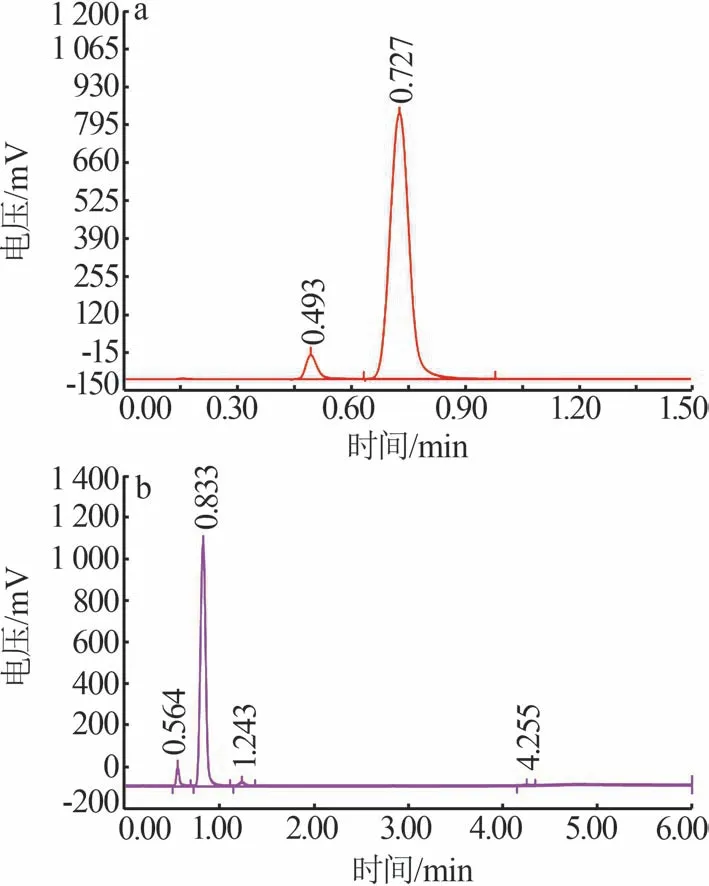
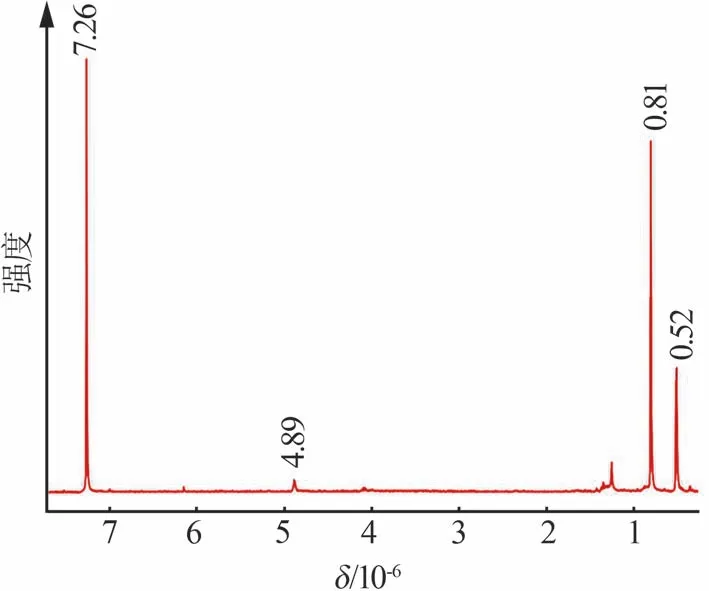
图2 不同温度下氯化反应的转化率Fig.2 Conversion rate of chlorination reaction at different temperatures 图3 为气相色谱仪测得的Cl2分别与SiHCl3、(CH3)2SiHCl反应的产物气相色谱图。由图3a可知,SiHCl3和Cl2的反应产物中含有SiHCl3(0.493 min处的峰)和SiCl4(0.727 min 处的峰),对比反应前后的峰面积,可确定产物为SiCl4。由图3b 可知,Cl2与(CH3)2SiHCl反应产物中不仅有反应物(CH3)2SiHCl(0.564 min处的峰)和溶剂SiCl4(0.833 min处的峰),还有主产物(CH3)2SiCl2(1.243 min 处的峰),以及少量的(CH2Cl)CH3SiCl2(4.255 min)存在。进一步通过1H NMR 对(CH3)2SiHCl 反应产物进行定性分析,结果如图4所示。由图4可知,在1H NMR 谱图上仅检 测 到(CH3)2SiHCl(4.89×10-6、5.2×10-7处的峰)和(CH3)2SiCl2(8.1×10-7处的峰),以及氘代试剂CDCl3(7.26×10-6处的峰),由于(CH2Cl)CH3SiCl2的含量极少,未检测到峰值。
图3 反应产物的气相色谱图Fig.3 Gas chromatograms for products
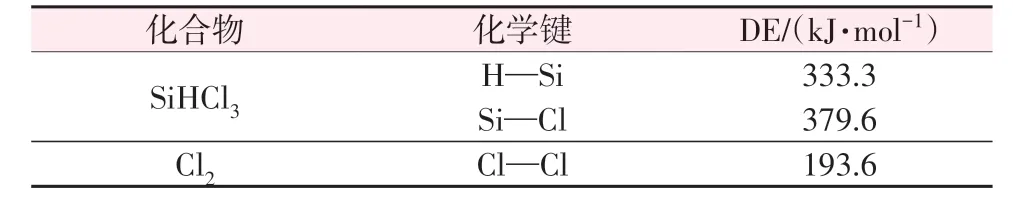
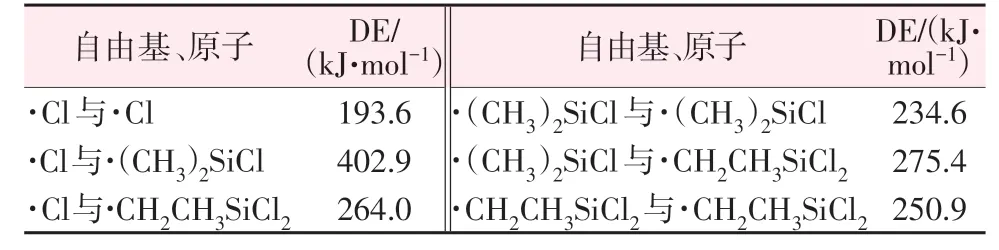
图4 Cl2与(CH3)2SiHCl反应产物的1H NMR分析谱图Fig.4 1H NMR spectra for product of(CH3)2SiHCl chlorination by Cl2 2.3 SiHCl3和Cl2反应的机理分析2.3.1 链引发反应 SiHCl3和Cl2中各键的解离能如表1 所示。在SiHCl3和Cl2中,Cl2中的Cl—Cl键的解离能最小。因此,链引发反应为Cl2的分解反应[见式(6)]。
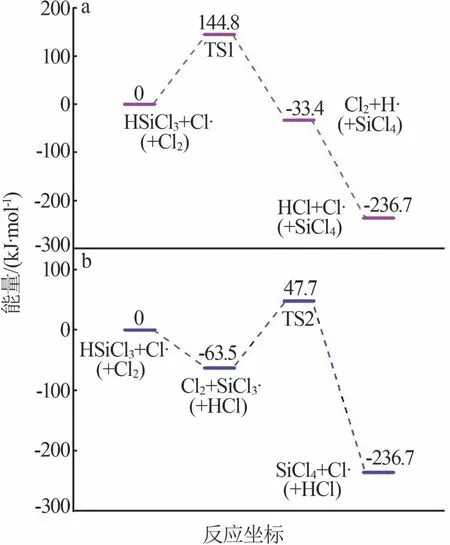
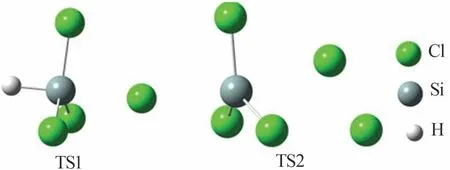
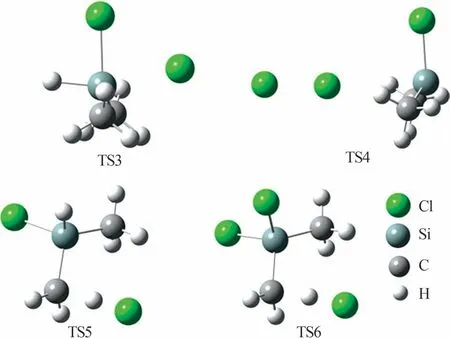
表1 SiHCl3和Cl2的解离能Table 1 Dissociation energies for SiHCl3 and Cl2 2.3.2 链增长反应 在SiHCl3和Cl2反应体系中,Cl2释放氯原子与SiHCl3反应有两条路径(取代反应和夺氢反应),各反应路径的能垒如图5 所示。图5a 为取代反应路径的能垒,由图5a 可知,氯原子进攻SiHCl3上的硅原子发生取代反应,生成SiCl4和氢原子;这一步反应能垒为144.8 kJ/mol,过渡态记为TS1。图5b为夺氢反应路径的能垒,由图5b 可知,氯原子直接夺取SiHCl3上的氢原子[式(7)]发生夺氢反应,生成SiCl3·,这一步反应认为没有能垒[16];SiCl3·继续与氯气反应[式(8)],反应能垒为111.2 kJ/mol,过渡态记为TS2。图6为SiHCl3和Cl2反应中涉及的过渡态结构。由于SiHCl3和氯原子发生夺氢反应的能垒低于取代反应,因此SiHCl3和氯原子反应是夺氢反应。
图5 SiHCl3和Cl2反应的反应势能图Fig.5 Potential energy diagrams for reactions of SiHCl3 with Cl2
图6 SiHCl3和Cl2反应中涉及的过渡态结构Fig.6 Structures of transition states formed during reactions of SiHCl3 with Cl2 2.3.3 链终止反应 在SiHCl3和Cl2反应过程中链增长反应是夺氢反应,则生成氯原子和SiCl3·。计算自由基、原子间相互结合生成键的解离能见表2,其中SiCl4中的Si—Cl 键的解离能最大(366.8 kJ/mol)。因此,SiHCl3和Cl2反应体系中的链终止反应是SiCl3·和氯原子的结合[式(9)]。
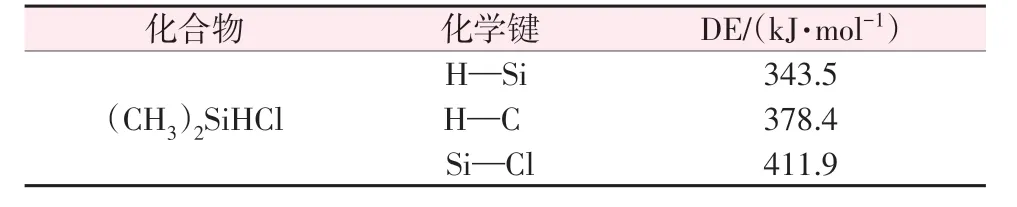
表2 SiHCl3和Cl2反应体系中涉及的自由基、原子和解离能Table 2 Free radicals,atoms and dissociation energies in chlorination reaction of SiHCl3 通过上述分析,可以确定SiHCl3和Cl2反应的化学方程式如式(5)所示。 2.4 (CH3)2SiHCl与Cl2反应的机理分析2.4.1 链引发反应 (CH3)2SiHCl 中各键的解离能如表3 所示。由表1和表3可知,在(CH3)2SiHCl和Cl2中的Cl—Cl键的解离能最小。因此,链引发反应也是Cl2的分解反应[式(6)]。
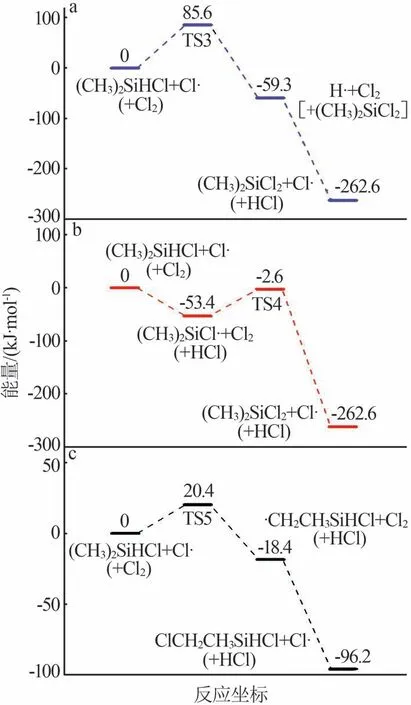
表3 (CH3)2SiHCl的解离能Table 3 Dissociation energies for(CH3)2SiHCl and Cl2 2.4.2 链增长反应 图7 为(CH3)2SiHCl 和Cl2反应的链增长反应势能图。由图7可见,在(CH3)2SiHCl和Cl2反应体系中,氯原子与(CH3)2SiHCl 反应有3条路径:1)取代反应(图7a),氯原子进攻(CH3)2SiHCl 上的硅原子,生成(CH3)2SiCl2和氢原子,这一步反应能垒为85.6 kJ/mol,过渡态记为TS3;2)夺氢(硅)反应(图7b),氯原子直接夺取硅上的氢原子生成(CH3)2SiCl·[式(10)],这一步也认为没有能垒,生成的(CH3)2SiCl·继续与Cl2反应[式(11)],能垒为50.8 kJ/mol,过渡态记为TS4;3)夺氢(碳)反应(图7c),氯原子夺取碳上的氢原子,生 成·(CH2)CH3SiHCl,反 应 能 垒 为20.4 kJ/mol,过渡态记为TS5。图8 为(CH3)2SiHCl 和Cl2反应中涉及的过渡态结构。由于夺氢(硅)反应中氯原子夺取硅上的氢没有能垒,且释放53.4 kJ/mol 的能量可直接用于跨越下一步的反应能垒50.8 kJ/mol。因此,(CH3)2SiHCl和氯原子反应是夺氢(硅)反应。
图7 (CH3)2SiHCl和Cl2反应的链增长反应势能图Fig.7 Potential energy diagrams for reactions of (CH3)2SiHCl with Cl2
图8 (CH3)2SiHCl和Cl2反应中涉及的过渡态结构Fig.8 Structures of transition states formed during reactions of(CH3)2SiHCl with Cl2 (CH3)2SiHCl 和Cl2反应生成的(CH3)2SiCl2继续与Cl2反应,Cl2分解释放氯原子夺取碳上的氢[式(12)],能垒为25.4 kJ/mol,过渡态(TS6)如图8 所示。(CH3)2SiCl2和Cl2反应的链增长反应势能图如图9所示。 2.4.3 链终止反应 (CH3)2SiHCl和Cl2反应体系中涉及的自由基和解离能见表4,其中解离能最大的是氯原子和(CH3)2SiCl·生成的Si—Cl 键,键能为402.9 kJ/mol。因此,(CH3)2SiHCl 和Cl2反应体系中的链终止反应是氯原子和(CH3)2SiCl·的结合[式(13)]。
表4 (CH3)2SiHCl和Cl2反应体系涉及的自由基、原子及解离能Table 4 Free radicals,atoms and dissociation energies in chlorination reaction of (CH3)2SiHCl 综上所述,(CH3)2SiHCl 和Cl2反应的总化学方程如下: 由图5b、图7b 可知,SiHCl3、(CH3)2SiHCl 与Cl2反应的第一步均是Cl2的分解反应,生成Cl·继续夺取硅上的氢原子生成自由基和HCl,自由基继续与Cl2反应。因此,SiHCl3、(CH3)2SiHCl分别与Cl2反应的能垒差在于SiCl3·、(CH3)2SiCl·与Cl2反应的能垒。Cl2与SiCl3·反应的能垒为111.2 kJ/mol,比与(CH3)2SiCl·反应的能垒高60.4 kJ/mol。在相同条件下,Cl2和(CH3)2SiHCl反应的转化率高于和SiHCl3反应的转化率。因此,理论计算和实验结果相一致。 3 结论通过探究相同条件下,(CH3)2SiHCl 和SiHCl3的热氯化反应,可得以下结论:1)SiHCl3和Cl2反应是自发进行的不可逆放热反应;2)(CH3)2SiHCl和Cl2反 应 的 主 产 物 是(CH3)2SiCl2,副 产 物 是(CH2Cl)CH3SiCl2,但 比 较 少;3)相 同 条 件 下,(CH3)2SiHCl 氯化反应的转化率远远高于SiHCl3的转化率,在60 ℃、120 min 时,(CH3)2SiHCl 的转论率最佳;4)SiHCl3、(CH3)2SiHCl 与Cl2反应的能垒差在 于Cl2分 别 与SiCl3·、(CH3)2SiCl·反 应 的 能 垒(111.2、50.8 kJ/mol),Cl2与SiCl3·反应的能垒比与(CH3)2SiCl·反应的能垒高60.4 kJ/mol。 本研究选择Cl2为氯供体,将(CH3)2SiHCl 转化为高沸点的甲基氯硅烷,增大SiHCl3和(CH3)2SiHCl的相对挥发度,便于后续的精馏提纯。可有效提高SiHCl3的纯度,进而生产高品质的多晶硅,为SiHCl3除碳工艺的研究提供一定的理论依据。 猜你喜欢 氯硅烷能垒过渡态 聚对苯二甲酸丁二醇酯二聚体热降解机理的理论研究燃料化学学报(2023年3期)2023-03-11浅谈多晶硅生产中碳杂质的分布和去除世界有色金属(2022年16期)2022-10-20基于LMI的过渡态主控回路闭环控制律优化设计北京航空航天大学学报(2022年5期)2022-06-06热耦合节能技术在甲基氯硅烷精馏中的应用云南化工(2021年11期)2022-01-12浅谈物理化学中过渡态的搜索方法大学化学(2021年8期)2021-09-26化学反应历程教学的再思考中学课程辅导·教学研究(2021年8期)2021-07-14重质有机资源热解过程中自由基诱导反应的密度泛函理论研究燃料化学学报(2021年5期)2021-06-02分离三氯氢硅中甲基二氯硅烷的研究进展无机盐工业(2021年3期)2021-03-11三氯氢硅副产物氯硅烷废液的处理方法研究河南科学(2020年3期)2020-06-02第一性原理研究铁铜合金催化氨硼烷水解脱氢电脑知识与技术(2018年3期)2018-03-21
|
【本文地址】

 无机盐工业2023年12期
无机盐工业2023年12期