| 超强干货丨一文看懂WB、qPCR生物测试,内含常见问题(附答案) | 您所在的位置:网站首页 › wb的检测蛋白浓度范围 › 超强干货丨一文看懂WB、qPCR生物测试,内含常见问题(附答案) |
超强干货丨一文看懂WB、qPCR生物测试,内含常见问题(附答案)
|
01蛋白质印迹(Western blotting)实验简介 蛋白质印迹(Western blotting)又称免疫印迹(immunoblotting),是采用印迹技术将蛋白质转移到膜上,再根据抗原-抗体的特异性结合,检测复杂样品中的某种蛋白的方法,该技术也广泛应用于检测蛋白水平的表达。 实验原理WB实验是通过聚丙烯酰胺凝胶电泳(PAGE)将混合蛋白质样品分离后,利用特殊虹吸或电场装置印迹至固相介质(例如PVDF膜)上,再以固相载体上的蛋白质或多肽作为抗原,与相对应的第一抗体特异性结合,之后再与酶或同位素标记的第二抗体相结合,最终通过底物显色或放射自显影来检测特异性目的基因表达的蛋白成分。 实验流程
一、为什么蛋白质印迹条带大小与预期的不同? 蛋白质印迹是一种基于蛋白质大小来分离蛋白质的技术。一般来讲,蛋白质越小,在胶上的迁移速度越快。但迁移速度也受其它因素的影响,因此,观察到的实际条带大小可能与预测的不同。 常见的因素包括: 1.翻译后修饰:例如磷酸化、糖基化等,可增加蛋白质大小。 2.翻译后切割:例如许多蛋白先被合成为前蛋白,然后被切割产生活性形式,例如前半胱天冬酶。 3.剪接变体和异形体:可变剪接和异形体可能从同一基因产生不同大小的蛋白质。 4.相对电荷-氨基酸(带电和不带电)多聚体组分,例如蛋白质的二聚化。这种情况通常在还原条件下需要防止,但强相互作用会导致较大的条带出现。 二、应该上样多少样品? 细胞裂解物、膜裂解物和核裂解物:每孔上样20-30g总蛋白。可根据测试样品中的蛋白质表达水平进行一些优化。纯化蛋白(重组或内源):上样10至100ng蛋白。 三、蛋白样本为什么要进行还原和变性? 为了使样本被还原和变性,样品缓冲液中会含有十二烷基硫酸钠(SDS)和β-巯基乙醇或二硫苏糖醇(DTT)。SDS是一种变性剂,用来打破蛋白的高级结构,变成初级的氨基酸结构,同时以恒定的质量比包被蛋白质,使其带上负电荷。这一恒定的负电荷比是下一步凝胶电泳分离的关键。β-巯基乙醇和DTT都是还原剂,用来断开蛋白自身的二硫键,进一步使蛋白质变成线性结构。顺便提一下,有些抗体只能够识别目标蛋白的天然结构,在这种情况下,样本不需要被还原和变性,所以还原和变性的步骤可以省略。但是,大多数蛋白质印迹分析都需要在还原和变性的体系中进行。
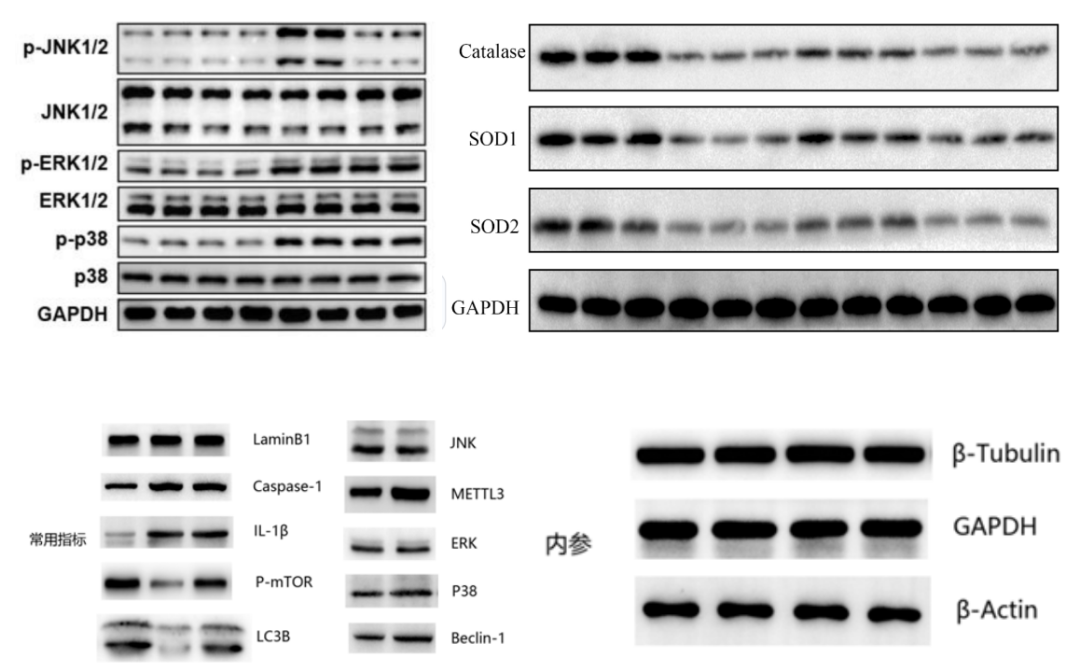
四、转膜选择半干转还是湿转? 常用的转印方法有两种,湿法和半干法。这两种方法的主要区别在于,湿法转印中,夹心层被浸没在注有电转缓冲液的槽中,而在半干法中,夹心层被直接置于阴极与阳极之间。半干法较快,但膜可能会干掉导致蛋白无法转印。湿法转印用时较长,但对于大分子蛋白或疏水蛋白等较难转印的蛋白,这个方法更适合。 五、为什么检测重组蛋白时难以获得条带? 抗体检测重组蛋白质时,存在难以克服的困难,有必要加以考虑。所以推荐确保样品中表达的重组蛋白包含所用抗体的免疫原序列。同时,如果重组蛋白带有标签,标签可能阻止抗体接近表位。尽可能让标签位于重组蛋白的C或N末端,以降低这种情况发生的可能性(而不是位于蛋白质的阅读框中间)。 六、牛奶和 BSA 封闭有区别? 抗体可能对封闭剂敏感,一般来讲,BSA会产生更清晰的结果,因为BSA含有较少的蛋白,因而抗体较少与其发生交叉反应。但并非总是如此,有些抗体在牛奶中的效果更好,因为牛奶含有更多种类的封闭蛋白,能封闭更多不同类型的蛋白质。 七、能否用室温下孵育一抗 1 小时代替 4 ℃ 过夜孵育? 蛋白质印迹中一抗孵育时间需要用户进行最终优化。一般来讲,4 ℃ 过夜孵育将产生更高效、更特异的染色。但许多抗体在室温下孵育1或2小时效果也非常好。 实验结果常常出现的问题一、无信号 1.一抗和二抗不相容,使用针对一抗来源物种产生的二抗(例如,一抗来源于兔,使用抗兔二抗)。 2.结合到目标蛋白的一抗或二抗不足,使用更高浓度的抗体,或在4℃下孵育更长时间(例如过夜孵育)。 3.封闭剂和一抗或二抗之间发生交叉反应,使用温和去垢剂,例如Tween20,或更换封闭剂(常用的封闭剂是牛奶、BSA、血清或明胶)。 4.一抗不识别测试物种中的蛋白查看数据表或进行BLASTp比对,检查抗体是否应与目标蛋白反应。 5.抗原不足,每个泳道上样至少20–30μg蛋白,使用蛋白酶抑制剂。 6.组织中目标蛋白丰度不够,利用富集步骤使信号达到最大(例如,对于核蛋白,制备核裂解物)。 7.蛋白转膜效果差,用可逆染料(例如丽春红)检查转膜情况。如果蛋白未有效转膜,检查转膜方向是否正确。如果使用PVDF膜,确保先将膜预浸在甲醇中,然后预浸在转膜缓冲液中。 8.膜洗涤过度减少洗涤步骤的数量或缩短洗涤步骤的时间。 二、“微笑”︶条带呈笑脸状 说明凝胶不均匀冷却,中间冷却不好;电泳系统温度偏高,这种情况在用较厚凝胶时常发生。 三、“皱眉”︵条带呈皱眉状 这种现象常常是由于装置不合适,特别是凝胶和玻璃挡板底部有气泡,或者两边聚合不完全就会产生这种现象。 四、“拖尾”现象和背景高 拖尾是电泳中最常见的现象,常常是由于样品溶解不佳引起的。解决办法为加样前离心,选用合适的样品缓冲液和凝胶缓冲液,加增溶辅助试剂,降低凝胶浓度。背景高是封闭时间不够,延长封闭时间。优化封闭试剂的类型和浓度;封闭试剂和抗体有交叉反应,则需要更换封闭试剂。磷酸化抗体不能使用含有酪蛋白的封闭试剂,推荐BSA封闭;一抗/二抗浓度太高时应降低抗体浓度。洗膜不充分,5*3mins,多次短时间的洗膜;曝光时间过长,应缩短曝光时间。出现干膜现象保证膜充分浸透,避免出现干膜。 五、非特异性条带现象 在标本制备时,二聚体或者多聚体应增加上样前煮沸变性时间;蛋白不同剪切体或者异构体存在;若蛋白样品降解,应使用新制备的标本,标本中加入新配制的蛋白酶抑制剂。上样品时,上样量过大,应减少上样量。封闭不充分,优化封闭时间和封闭试剂浓度。抗体孵育和检测一抗/二抗浓度是否过高,降低抗体浓度。 测试案例
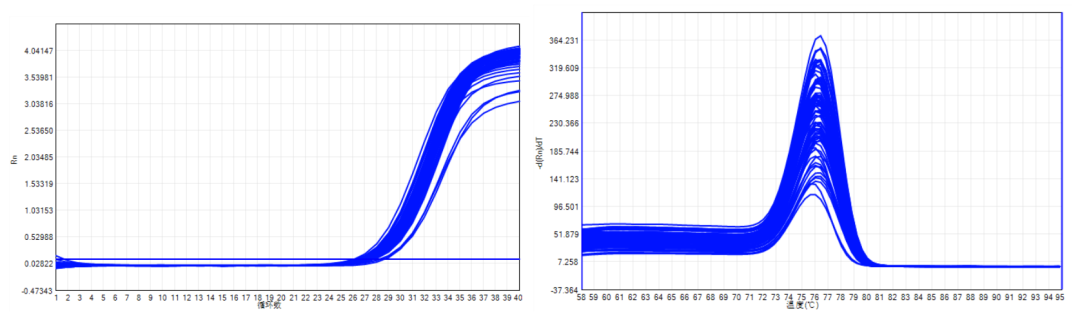
实时荧光定量PCR(Quantitative Real-time PCR)是一种在DNA扩增反应中,以荧光化学物质检测每次聚合酶链式反应(PCR)循环后产物总量的方法。通过内参或者外参法对待测样品中的特定DNA序列进行定量分析。 实验原理以cDNA为模板进行PCR,在PCR扩增过程中,通过收集荧光信号,对PCR进程进行实时检测。由于在PCR扩增的指数时期,模板的Ct值和该模板的起始拷贝数存在线性关系,所以可以定量。在实时PCR扩增过程中,荧光信号被收集,转化为成为扩增和熔解曲线。具体数据就是基线,荧光阈值和Ct值。 1.基线(baseline):一般来讲,第3-15个循环的荧光值就是基线,是由于测量的偶然误差引起的。 2.阈值(threshold):阈值一般是基线的标准偏差的10倍。在实际操作中也可以手动调节,位于指数期就可以。 3.Ct值(Ct value):Ct值就是荧光值达到阈值时候的PCR循环次数。所以是一个没有单位的参数。跟初始模板的量呈反比。 检测方法1.SYBRGreenⅠ法:在PCR反应体系中,加入过量SYBR荧光染料,SYBR荧光染料特异性地掺入DNA双链后,发射荧光信号,而不掺入链中的SYBR染料分子不会发射任何荧光信号,从而保证荧光信号的增加与PCR产物的增加完全同步。2.TaqMan探针法:探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5’-3’外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物的形成完全同步。实验流程
检测荧光信号的步骤有误:一般SybrGreen法采用72℃延伸时采集,Taqman法则一般在退火结束时或延伸结束采集信号。 1.引物或探针降解:可通过PAGE电泳检测其完整性。 2.模板量不足:对未知浓度的样品应从系列稀释样本的最高浓度做起。 3.模板降解:避免样品制备中杂质的引入及反复冻融的情况。 二、Ct值出现过晚(Ct>38)1.扩增效率低:反应条件不够优化。设计更好的引物或探针;改用三步法进行反应;适当降低退火温度;增加镁离子浓度等。 2.PCR各种反应成分的降解或加样量的不足。 3.PCR产物太长:一般采用80-150bp的产物长度。 三、标准曲线线性关系不佳1.加样存在误差:使得标准品不呈梯度。 2.标准品出现降解:应避免标准品反复冻融,或重新制备并稀释标准品。 3.引物或探针不佳:重新设计更好的引物和探针。 4.模板中存在抑制物或模板浓度过高 四、负对照有信号或者溶解曲线不止一个主峰1.引物设计不够优化:应避免引物二聚体和发夹结构的出现。 2.引物浓度不佳:适当降低引物的浓度,并注意上下游引物的浓度配比。 3.镁离子浓度过高:适当降低镁离子浓度,或选择更合适的mix试剂盒。 4.模板有基因组的污染:RNA提取过程中避免基因组DNA的引入,或通过引物设计避免非特异扩增。 五、扩增效率低1.反应试剂中部分成分特别是荧光染料降解。 2.反应条件不够优化:可适当降低退火温度或改为三步扩增法。 3.反应体系中有PCR反应抑制物:一般是加入模板时所引入,应先把模板适度稀释,再加入反应体系中,减少抑制物的影响。 六、同一试剂在不同仪器上产生不同的曲线,如何判断?1.判断标准:扩增效率,灵敏度,特异性; 2.如果扩增效率在90%-110%,都是特异性扩增,都可以把数据用于分析。 七、扩增曲线的异常?比如“S”型曲线?1.参比染料设定不正确(MasterMix不加参比染料时,选NONE) 2.模板的浓度太高或者降解 3.荧光染料的降解
|
【本文地址】