| Nature | 您所在的位置:网站首页 › rna连接酶是蛋白质吗还是蛋白 › Nature |
Nature
|
撰文 | 赤贞责编 | 兮 细胞内,RNA可通过提供多价互作位点,介导与其互作的蛋白质发生相分离现象。如在转录过程中,RNA参与到聚合酶Pol II与剪接复合物的相分离当中【1】;在翻译过程中,RNA与转录抑制因子Rck/p54/dhh1或脱帽酶Dcp2等形成P-bodies,介导mRNA的程序性降解并对翻译过程进行调控【2】;在细胞被剥夺营养的情况下,受到抑制的转录复合物与mRNA、Hsp70/Hsp40、DEAD-box解旋酶等形成应激颗粒stress granule【3】;在神经退行性疾病中,RNA与控制运动的神经细胞内的蛋白发生相分离、异常沉积导致细胞功能受损【4】。既往研究认为,phase-equilibrium/相平衡是调节RNA-蛋白质相分离/RNP的关键【5】,但较少有研究关注于其具体的调控机制。 2019年8月22日,Nature 杂志在线发表了瑞士苏黎世联邦理工学院Karsten Weis教授课题组的研究成果:“DEAD-box ATPases are global regulators of phase-separated organelles”(DEAD-box ATPase(DDX)能够调控RNA-蛋白质相分离的形成)。该研究首次阐释了一个在真核细胞与原核细胞内均通用的相分离形成与流动的调控机制——DDX家族蛋白通过调节相分离来影响RNA的成熟、RNP的组成、以及RNA的最终命运。  DEAD-box是一类在进化中高度保守的ATP酶活性依赖的RNA解旋酶,参与与RNA相关的所有生物学过程;该家族的蛋白均以两个RecA结构域为核心,两侧连以不同长度、不同序列组成的侧链;Karsten Weis教授课题组于2016年证实,酵母Dhh1能够在体外发生相分离现象,并通过其ATP酶活性动态调节p-bodies的形成,该研究发表在eLife上。 在后续研究中,研究者从促使Dhh1发生相分离的环境及序列因素入手,对DDX家族蛋白的相分离现象及意义进行了详细探讨。 酵母Dhh1由两个RecA 结构域和N端、C端两段无序区/低复杂度结构域构成,其中C端无序区富含谷氨酰胺,N端则富含天冬酰胺。 实验发现体外条件下,全长Dhh1能够与RNA发生相分离,这一现象随ATP浓度的增加而增强,在pH6.2-7.2区间内随pH升高而减弱,在RNA过多(高于0.5mg/ml)或盐浓度过高(高于200mM)时则受到抑制;去掉N端、C端无序区的Dhh1截断体在任何情况下都无法发生相分离现象,提示Dhh1的相分离是依赖其无序区的。 基于以上结果,研究者对DDX家族中的其他蛋白进行了分析,酵母Dhh1的同源蛋白人DDX6、同源蛋白拟南芥AT4G00660、酵母应激小体的主要成分Ded1及其同源蛋白人DDX3X、酵母的Dbp1、Dbp2、线虫的LAF-1、E.coli的DeaD、SrmB和RhlE等均能够依赖其内源性低复杂度结构域(LCD)发生相分离现象;相反,DDX家族中不含低复杂度结构域的蛋白如eIF4A、Dbp5、Sub2、RhIB等则无法发生相分离现象。 由于以上蛋白涉及RNA代谢的多个不同过程,研究者猜想,DDX家族蛋白可能通过形成相分离,对细胞内RNA的代谢过程进行调控。具体而言,ATP存在时,DDX家族蛋白与RNA间通过多价的相互作用网络促进相分离的发生;当DDX的ATPase活性被激活、ATP水解后,RNA则从DDX上释放出来,导致互作网络被破坏,促使相分离液滴分散开来。  图1:影响Dhh1相分离发生的环境及序列因素 图1:影响Dhh1相分离发生的环境及序列因素 图2:DDX家族蛋白依赖其低复杂度结构域发生相分离现象 图2:DDX家族蛋白依赖其低复杂度结构域发生相分离现象胞内实验表明,ATP水解酶活性缺陷的Dhh1、Ded1、DDX3X和DDX4在细胞生理情况下可形成持续的foci;Dhh1的激活因子Not1、Ded1的激活因子eIF4G可抑制体外条件下相分离的发生;这表明DDX的ATP水解酶活性能够调控相分离的发生。为验证DDX的ATP水解酶活性是通过控制RNA从相分离液滴中释放来调节相分离的,研究者以转录延伸抑制剂放线菌酮(cycloheximide)为入手点设计了实验:cycloheximide可抑制mRNA从停滞翻译的核糖体上解离,切断p-bodies和应激小体的RNA供应,阻止细胞生成更多的p-bodies和应激小体。 在DDX ATP水解酶活性缺陷的细胞中,p-bodies和应激小体数量是野生型的两倍多;在UAP56/人DDX39B敲低的A549细胞中,亚细胞核结构nuclear speckles的数量显著高于正常细胞;在Sub2敲除的酵母细胞中,转录位点会形成大量的明亮foci,表示mRNA在该处有大量的累积。这些结果均表明,DDX家族蛋白通过其ATP水解酶活性控制与RNA的结合,从而调节相分离的发生。  图3:DDX家族蛋白通过ATP水解酶活性调节RNA的聚集与相分离的形成 图3:DDX家族蛋白通过ATP水解酶活性调节RNA的聚集与相分离的形成 最后,在体外条件下,当Dhh1、RNA与Ded1同时存在时,RNA优先与Dhh1形成的相分离;当体系中加入Dhh1的激活因子Not1时,这一相分离液滴消失,游离的RNA参与到Ded1形成的相分离液滴中。反之,当Ded1的激活因子eIF4G溶解Ded1与RNA形成的相分离液滴时,游离的RNA则不再参与到Dhh1的相分离当中。由于在酵母中,p-bodies(Dhh1)先于stress granule(Ded1)形成,因此当Dhh1的ATP水解酶活性缺失时,RNA不能够从p-bodies中游离出来,下游stress granule无法形成。 综上,DDX家族蛋白可通过自身的低复杂度结构域形成不同的相分离,通过ATP水解酶活性调控RNA的参与与解离。这些相分离分别控制着RNA代谢的不同阶段,以DDX为核心形成一个个动态的生化反应中心,引导RNA分子完成加工、成熟及最终代谢过程。既往有研究表明,特定的激酶可以控制有丝分裂过程中相分离的产生【6】;Karsten Weis教授课题组的这一研究揭示了DDX家族蛋白对RNA代谢过程中的相分离现象的调控作用;日后,还将有更多的研究关注于其他可以调控相分离形成的机制。 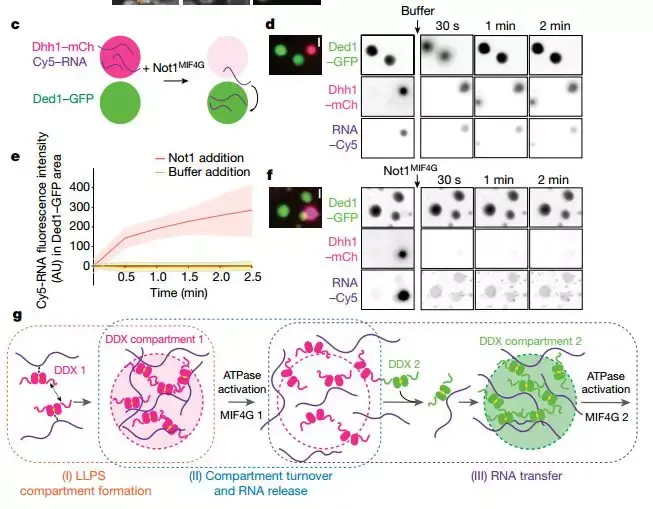 图4:DDX家族蛋白与RNA形成的相分离现象有特定的时序和空间顺序 图4:DDX家族蛋白与RNA形成的相分离现象有特定的时序和空间顺序 原文链接:https://doi.org/10.1038/s41586-019-1502-y 制版人:小娴子 参考文献 1.Guo,Y. E. et al. Pol II phosphorylation regulates a switch betweentranscriptional and splicing condensates. Nature (2019).doi:10.1038/s41586-019-1464-02. Mugler, C. F. et al. ATPaseactivity of the DEAD-box protein Dhh1 controls processing body formation.Elife5, (2016).3. Lin, Y., Protter, D. S. W., Rosen, M. K.& Parker, R. Formation and Maturation of Phase-Separated Liquid Droplets byRNA-Binding Proteins. Mol. Cell 60, 208–219 (2015).4. Gui, X. et al. Structural basisfor reversible amyloids of hnRNPA1 elucidates their role in stress granuleassembly. Nat. Commun. 10, (2019).5. Shin, Y. & Brangwynne, C. P. Liquidphase condensation in cell physiology and disease. Science 357,(2017).6. Rai, A. K., Chen, J. X., Selbach, M.& Pelkmans, L. Kinase-controlled phase transition of membranelessorganelles in mitosis. Nature 559, 211–216 (2018). 
|
【本文地址】