| 安进/百济 CD3/DLL3 双抗国内启动 III 期临床,针对小细胞肺癌 | 您所在的位置:网站首页 › pd1治疗前列腺癌的适应症 › 安进/百济 CD3/DLL3 双抗国内启动 III 期临床,针对小细胞肺癌 |
安进/百济 CD3/DLL3 双抗国内启动 III 期临床,针对小细胞肺癌
|
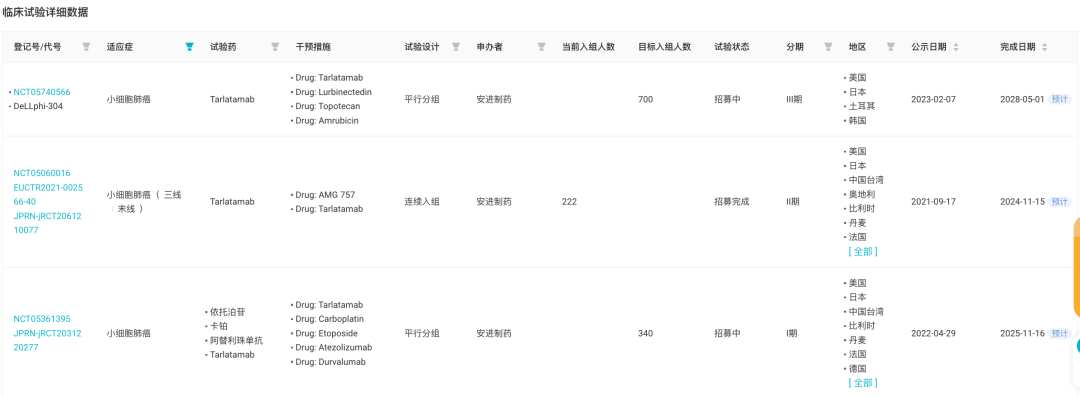
而在 2023 ASCO 会上,则公布了该项临床研究 Tarlatamab 根据基线脑转移(BM)情况进行安全性和疗效评估数据(摘要号:8582),表明 Tarlatamab 在 ES-SCLC 患者中,无论是否存在 BM,都具有令人鼓舞的疗效和安全性。 截至 2023 年 1 月 3 日,研究人员共纳入了 192 名SCLC 患者接受≥1 的含铂治疗和接受 Tarlatamab 一线治疗的患者,以及 BM 患者在 Tarlatamab 治疗前接受局部治疗≥2 周的患者。 结果显示:基线 BM 患者更多接受过>3线治疗(BM,29%;无BM,9%),既往更多接受脑部放射治疗(BM,85%;无BM,40%)。除此之外,两组患者的基本特征相似。 其中分析有效性数据, BM 和无 BM 患者的 ORR 分别为 19.6% 和 25.0%,疾病控制率(DCR)为 58.7% 和 50%,中位 DOR 分别为 14.9 个月和 13.0个月,中位 OS 分别为 13.2 个月和 15.5 个月。 期中分析有效性数据 目前,据 Insight 数据库显示,Tarlatamab 正在开展 5 项针对 SCLC 的临床研究,包括去年 4 月启动的一项与阿替利珠单抗联用的 I 期临床试验(登记号:NCT05361395)。 Tarlatamab 临床试验
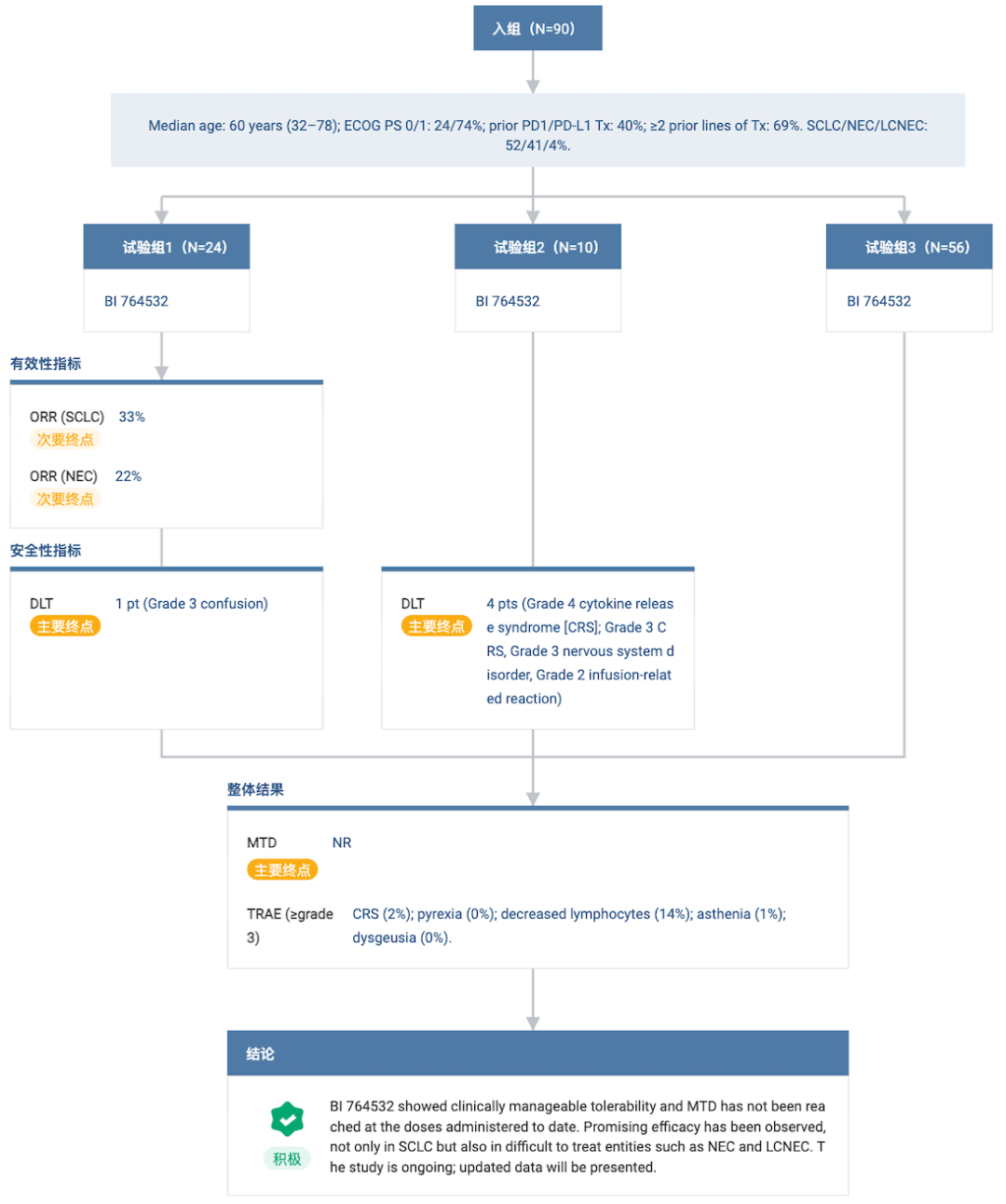
除 SCLC 外,安进还在探索 Tarlatamab 治疗前列腺癌的疗效。 Tarlatamab 全球项目开发进度甘特图 据 Insight 数据库显示,全球共有 5 款靶向 DLL3 的双特异性抗体进入临床阶段,包括 3 款 DLL3/CD3 双抗。进展最快的当属 Tarlatamab,其余处于早期研发阶段。 进入临床阶段的 5 款靶向 DLL3 的双特异性抗体 除 Tarlatamab 外,另两款 DLL3/CD3 双抗分别为 勃林格殷格翰制药 BI 764532以及 齐鲁制药 QLS31904。 2023 ASCO 年会上同样公布了 BI 764532 治疗局部晚期/转移性 SCLC、NEC 及大细胞 NEC 的临床 I 期研究最新结果(摘要 8502)。 共 90 例患者接受至少一剂药物治疗,40% 的患者既往接受免疫检查点抑制剂治疗,69% 的患者治疗线数大于 2 线。结果显示,任何级别 CRS 的发生率为 58%。在可评估 SCLC 患者中的 ORR 为 33%。 NCT04429087 研究结果
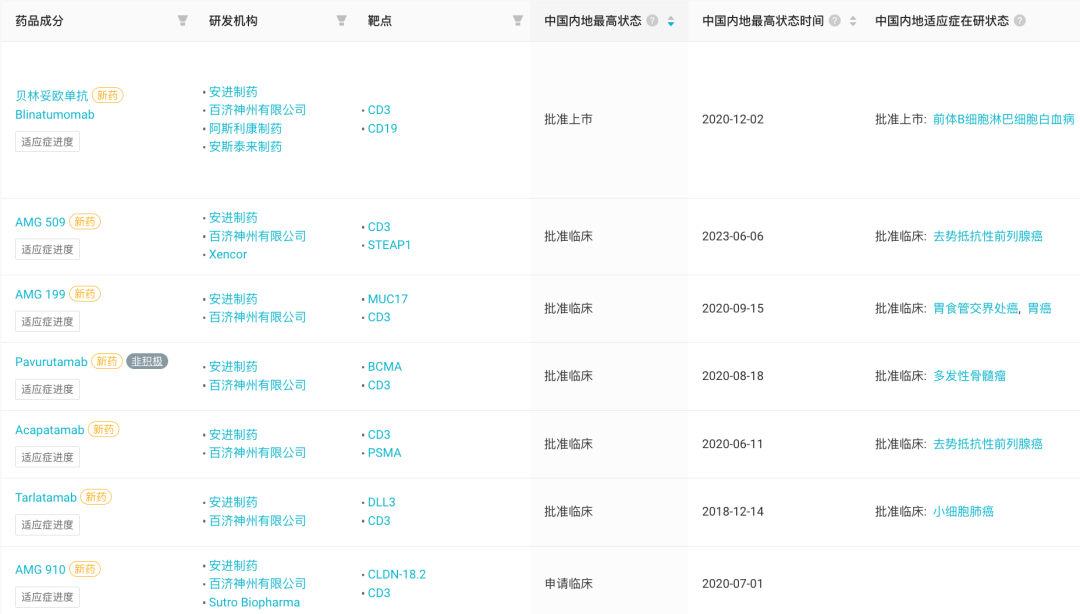
此外,也有布局靶向 DLL3 的 ADC 以及 多特异性抗体。 艾伯维布局的 Rovalpituzumab tesirine(Rova-T)是由 DLL3 抗体 rovalpituzumab 和细胞毒素 tesirine 组成的ADC。不过,此前由于针对晚期二线 SCLC 患者以及一线治疗小细胞肺癌的 III 期研究结果不佳,该产品已终止了相应的研发进程。 Harpoon Therapeutics 的 HPN328 则是利用 TriTAC™ 平台开发的、靶向 CD3、DLL3、ALB(白蛋白)的多特异性抗体,当前正在开展 I/II 期临床研究。 安进/百济全球肿瘤战略合作: 国内 7 款双抗进入临床 百济神州与安进在 2019 年 11 月达成了全球肿瘤战略合作关系,与安进共同开发包括 Tarlatamab在内的 20 款抗肿瘤管线药物。 据 Insight 数据库显示,在百济与安进合作的双抗项目中, 百济已将 7 款双抗在国内推进至临床开发阶段。 百济/安进共同研发 7 款双抗国内进入临床
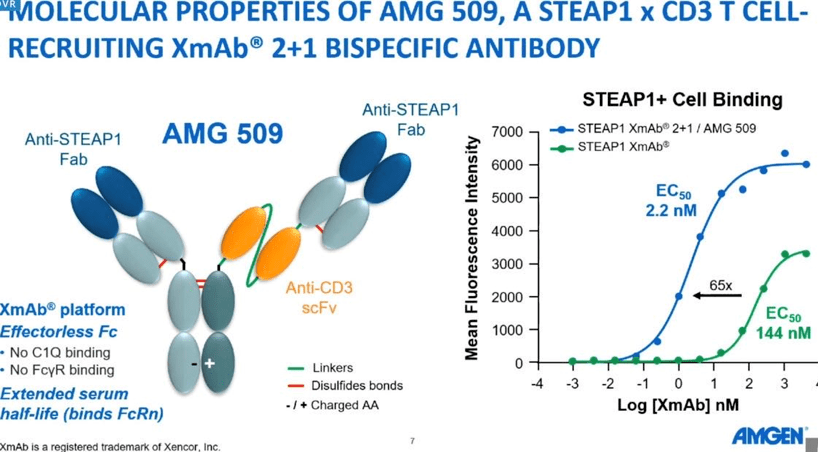
其中,CD3/CD19 双抗 贝林妥欧单抗开发进展最快,已于 2020 年 12 月在国内获批上市,用于治疗成人复发或难治性(R/R)前体 B 细胞急性淋巴细胞白血病(ALL)。此后,在去年 5 月,将适应症人群拓展至儿童患者。 贝林妥欧单抗国内获批适应症 AMG 509 是一款 CD3/STEAP1 双抗, 可与人、灵长类动物的 STEAP1 抗原和 T 细胞表面的 CD3 受体结合。 前列腺跨膜上皮抗原 1(STEAP1)是一种由雄激素诱导并在前列腺癌中高表达的细胞表面抗原。STEAP1 在尤因肉瘤(EWS)中也高度表达,且会形成 EWS / FLI1 的融合。EWS / FLI1 融合是该恶性肿瘤的主要致癌驱动因素。 在结构设计上,安进利用了 Xencor 公司的 Xmab 2+1 非对称技术,且延长了这一蛋白的半衰期。
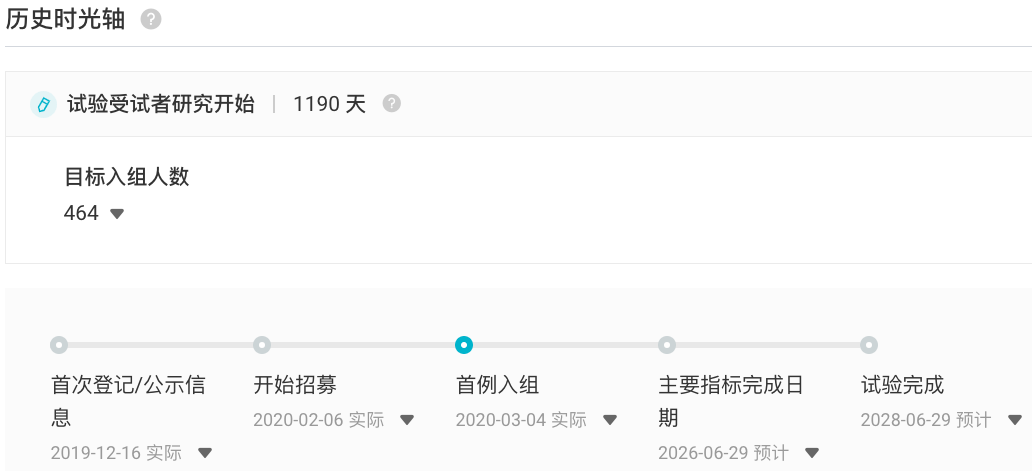
AMG 509 刚于今年 6 月在国内首次获批临床,用于 去势抵抗性前列腺癌。据 Insight 数据库显示,安进当前正在境外开展一项 AMG 509 治疗去势抵抗性前列腺癌的 I 期临床试验(登记号:NCT04221542)。该试验于 2020 年 3 月启动,预计于 2026 年 6 月完成试验的主要指标。 NCT04221542 试验历史时光轴
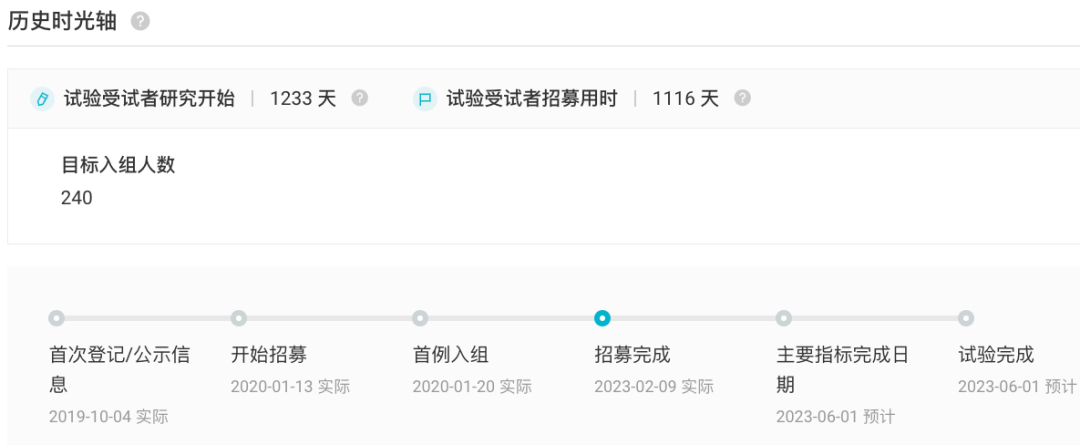
Acapatamab/AMG160 是一款 CD3/PSMA 双抗。在国内于 2020 年 6 月首次获批临床,用于治疗 去势抵抗性前列腺癌,不过当前暂未启动临床。 安进此前已在开展 Acapatamab 治疗去势抵抗性前列腺癌以及 PSMA 阳性非小细胞肺癌的 I/II 期、I 期临床试验,不过针对后者,安进在去年 11 月停止了该项研究(登记号:NCT04822298)。 AMG 199 则靶向 MUC17/CD3。2020 年 9 月首次在国内获批临床,用于治疗 MUC17 阳性的胃癌或胃食管交界部 (GEJ) 癌,当前暂未启动临床。 而在境外,安进则在同年 1 月启动了 AMG199 针对的胃癌或胃食管交界部 (GEJ) 癌、结直肠癌以及胰腺导管腺癌的 I 期临床试验(登记号:NCT04117958),并于今年 2 月完成受试者的招募工作。 NCT04117958 试验历史时光轴
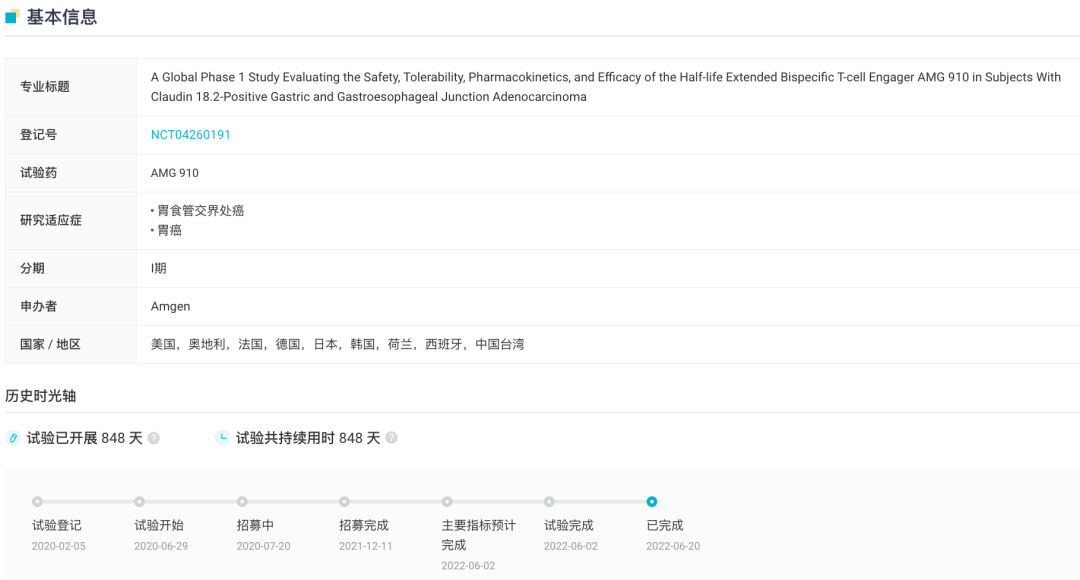
CLDN-18.2/CD3 双抗 AMG 910 在国内的开发进展则相对较缓慢,虽然早在 2020 年 7 月已申报临床,但目前仍未获批。安进开展的境外 I 期临床试验则已经在去年 6 月完成(登记号:NCT04260191)。 NCT04260191 试验信息
而对于 BCMA/CD3 双抗Pavurutamab/AMG 701,据安进 2022 Q2 财报显示,由于战略原因安进已停止该项目的研发,彼时临床开发已进入 II 期临床阶段。此举,再次引发业内人士对双抗半衰期问题的思考。 封面来源:站酷海洛 Plus 免责声明:本文仅作信息分享,不代表 Insight 立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。 编辑:Hebe PR 稿对接:微信 insightxb 投稿:微信 insightxb;邮箱 [email protected] 点击卡片进入 Insight 小程序 国内审评进度、全球新药开发… 随时随地查! 多样化功能、可溯源数据…… Insight 数据库网页版等你体验 点击阅读原文, 立刻解锁! 返回搜狐,查看更多 |
【本文地址】