| 浙江大学徐平龙团队:cGAS | 您所在的位置:网站首页 › nfkb信号通路下游 › 浙江大学徐平龙团队:cGAS |
浙江大学徐平龙团队:cGAS
|
原创 Cell Press CellPress细胞科学 收录于合集#细胞出版社Trends综述 208 个 #Trends in Cell Biology 9 个  生命科学 Life science 近日,浙江大学生命科学研究院的徐平龙教授受主编邀请,在Trends in Cell Biology期刊在线发表了题为“Cellular functions of cGAS-STING signaling”的加长篇幅的综述论文(Feature Review),系统地总结了目前已知的经典及非经典的cyclic GMP-AMP synthase (cGAS)-stimulator of interferon genes (STING)信号通路机制,详细阐述了cGAS-STING通路控制下的细胞功能,以及这些信号机制和细胞功能与多种疾病发生的病理联系。 功能 cGAS-STING信号通路是细胞感知并应答胞质异常存在的双链DNA(dsDNA)的主要效应器,通过诱导I型干扰素及干扰素刺激基因的表达与分泌,建立起有效的天然免疫应答,是生物体宿主防御的基本机制之一。除了由病原体入侵和复制导致的异源DNA释放,线粒体损伤以及基因组不稳定等因素也会引起机体自身dsDNA的异常泄露,进而被DNA受体cGAS所识别,激活cGAS-STING信号通路。因此,cGAS-STING机制构建起了一个广泛性的响应组织损伤和病原体入侵的重要监测系统,其异常则引发多种人类疾病,包括感染性疾病、自身免疫病、肿瘤、器官纤维化及神经退行性疾病等。 1. 经典cGAS-STING信号转导过程 在经典的cGAS-STING信号转导过程中,异常暴露在细胞质的dsDNA 能够被DNA受体cGAS所识别,催化GTP和ATP形成二级信使2’3’-cyclic-GMP-AMP (cGAMP)。cGAMP进而结合位于内质网膜的受体蛋白STING同聚双体,启动STING二聚体构象变化并因此激活。随着STING蛋白沿内质网-内质网高尔基体中间体(ERGIC)-高尔基体方向的转运,STING逐步多聚化聚集并招募关键激酶TBK1、转录因子IRF3以及众多的调控蛋白,形成功能信号复合体并导致IRF3的磷酸化。激活的IRF3二聚化并入核,促使I型干扰素及干扰素刺激基因的表达与分泌,进而抵御病原微生物的入侵以及维持组织稳态(图1)。 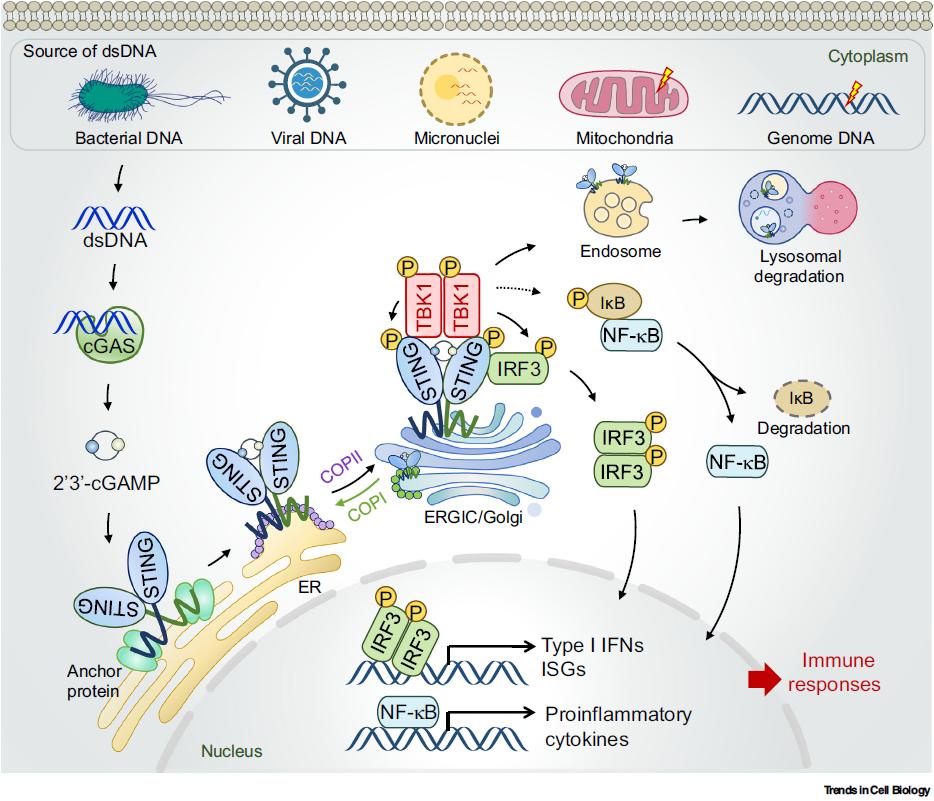 ▲图1 经典的cGAS-STING信号转导机制 2. 非经典的cGAS-STING信号转导途径 除了I型干扰素等细胞因子表达作为主要特征的经典cGAS-STING,近年来徐实验室和同行实验室的一系列研究鉴定了数种非经典的cGAS-STING信号转导机制,揭示了cGAS-STING信号通路在天然免疫应答、细胞生理功能调控以及疾病发展等过程中的信号枢纽作用(图2)。 2.1. STING-PERK-eIF2α信号通路 2022年5月,徐实验室鉴定了STING蛋白在内质网膜(ER)上介导的非经典信号转导途径:cGAS-STING-protein kinase R (PKR)-like ER kinase (PERK)- eukaryotic initiation factor 2α (eIF2α)信号通路[1]。机制上,STING在与cGAMP结合后,通过其定位于细胞质的羧基端结构域与PERK同样位于细胞质的激酶结构域互作并直接促使其激活,活化的PERK-eIF2信号显著抑制细胞总体水平的mRNA翻译,但却特异地促进部分炎症和存活相关蛋白的合成。干预该非经典cGAS-STING通路能够显著改善损伤造成的细胞衰老以及肺和肾两种器官的纤维化病变过程,揭示cGAS-STING-PERK-eIF2是控制细胞衰老以及器官纤维化的关键信号通路。 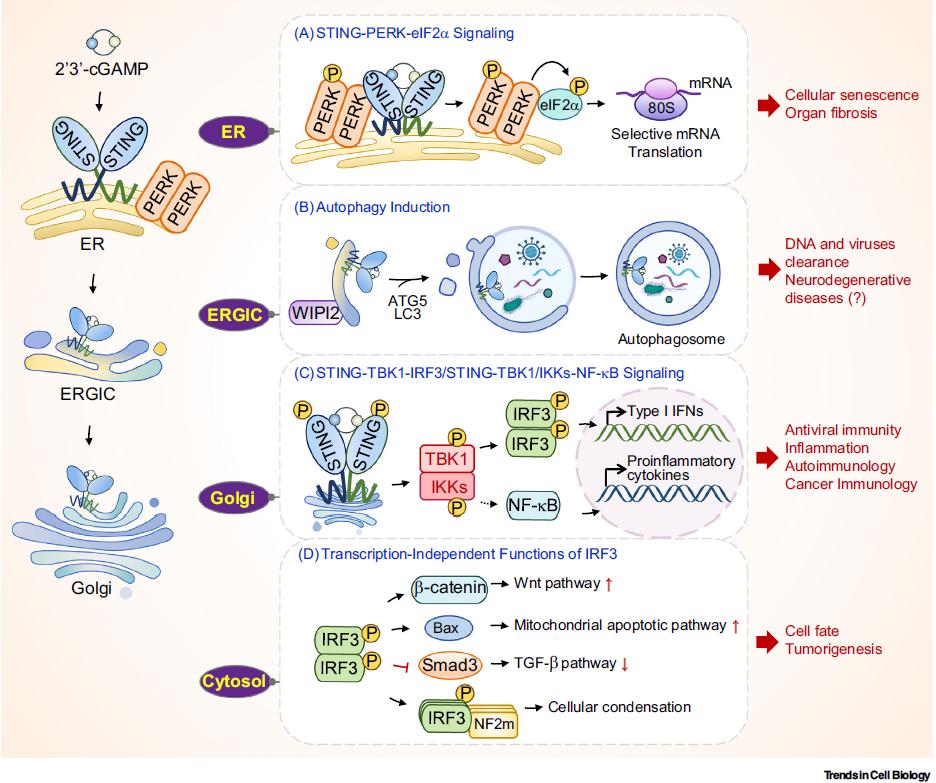 ▲图2 STING下游的信号转导途径 2.2. STING诱导自噬发生 STING诱导的自噬发生由陈佺教授实验室和陈志坚实验室分别鉴定,被认为是在物种进化上保守的非经典功能,这一过程独立于TBK1-IRF3以及经典的自噬信号分子[2, 3]。当活化的STING蛋白转位到内质网-高尔基中间体(ERGIC),STING作为潜在的自噬受体,以ERGIC作为主要膜供体,促进微管相关蛋白1轻链3 (LC3)的酯化反应,诱导自噬的发生,从而达到清除入侵宿主的病原微生物以及胞质DNA的目的,这对未具有干扰素合成系统的原始生物来说尤为重要。 2.3. STING介导NF-κB信号活化 cGAS-STING信号的激活通常伴随着NF-κB(nuclear factor κB)的活化。然而,STING激活NF-κB信号的具体机制仍存在争议。有研究认为,TBK1对IKKβ的磷酸化在NF-κB激活过程中是必需的;另一种观点则认为,低等生物的STING蛋白虽然缺少C-terminal tail (CT)区域,无TBK1激活和干扰素合成功能,但仍可以激活NF-κB信号并协助宿主抵抗外来入侵病原,表明STING可能独立于TBK1而激活NF-κB。此外,STING激活NF-κB的时空顺序也不十分清楚。有研究发现巨细胞病毒(cytomegaloviruses, CMV)蛋白能抑制STING向高尔基体转位以及干扰素合成,但不影响NF-κB的活化,提示STING激活NF-κB可能发生在STING转位至高尔基体前。总的来说,STING激活NF-κB信号的机制仍需要进一步研究。 2.4. IRF3独立于其转录活性的非经典功能 作为经典STING信号复合体中的关键因子,IRF3同样具有独立于其转录活性的非经典功能。研究表明,肠上皮细胞中的IRF3在静息状态下通过将β-catenin蛋白滞留在胞质内,从而阻止Wnt信号活化诱导的结直肠癌细胞增殖。相反,肠道微生物激活的IRF3丧失与β-catenin结合的能力,导致β-catenin入核、Wnt信号活化、以及最终结直肠癌的发生[4]。同时,活化的IRF3能够通过与促凋亡蛋白BCL2-associated X protein(Bax)结合,激活线粒体介导的经典细胞凋亡途径[5]。徐实验室的几项工作也揭示并拓展了IRF3的非经典功能:活化的IRF3能够竞争性结合CBP/p300转录共激活子并和SMAD蛋白互作,显著抑制转化生长因子β(transforming growth factor β, TGF-β)/SMAD信号介导的生物学功能[6];激活型IRF3可诱导二型神经纤维瘤(neurofibromin 2, NF2)突变体(NF2m)通过液-液相分离(liquid–liquid phase separation, LLPS)形成液滴状聚集体(cellularcondensation)。该NF2m聚集体招募TBK1和IRF3以及多种活性蛋白,包括蛋白磷酸酶PP2A,导致TBK1去磷酸化失活,从而强烈抑制cGAS-STING信号及其介导的抗肿瘤免疫[7]。 3. cGAS-STING信号参与调控多种细胞功能及人类疾病发生 cGAS-STING信号通路以经典或非经典的信号转导方式控制或调控多种细胞生物学过程,包括自噬(autophagy)、蛋白质合成(protein synthesis)、糖脂代谢(lipid and glucose metabolism)、无膜细胞器(membrane-less organelle)、DNA损伤修复(DNA damage repair)、细胞衰老(cellular senescence)以及多种类型的细胞死亡(cell death)等。此外在整体水平,cGAS-STING信号的失调与诸多疾病密切相关,例如Aicardi–Goutières综合征(AGS)、系统性红斑狼疮(SLE)、STING相关婴儿期血管病(SAVI)等自身免疫疾病,肿瘤发生、转移与肿瘤免疫监视,多种器官的纤维化病变,以及诸多神经退行性疾病如渐冻症(amyotrophic lateralsclerosis,ALS)、额颞叶痴呆(frontotemporaldementia, FTD)、帕金森病(Parkinson's disease)、亨廷顿舞蹈症(Huntington's disease)等(图3)。本文通过文字与图表的形式,系统地总结了cGAS-STING信号在细胞与整体水平、在正常生理与病理情况下的功能与调控机制,进而较为详细地探讨了靶向cGAS-STING信号通路在治疗上述相关疾病中的潜在应用。 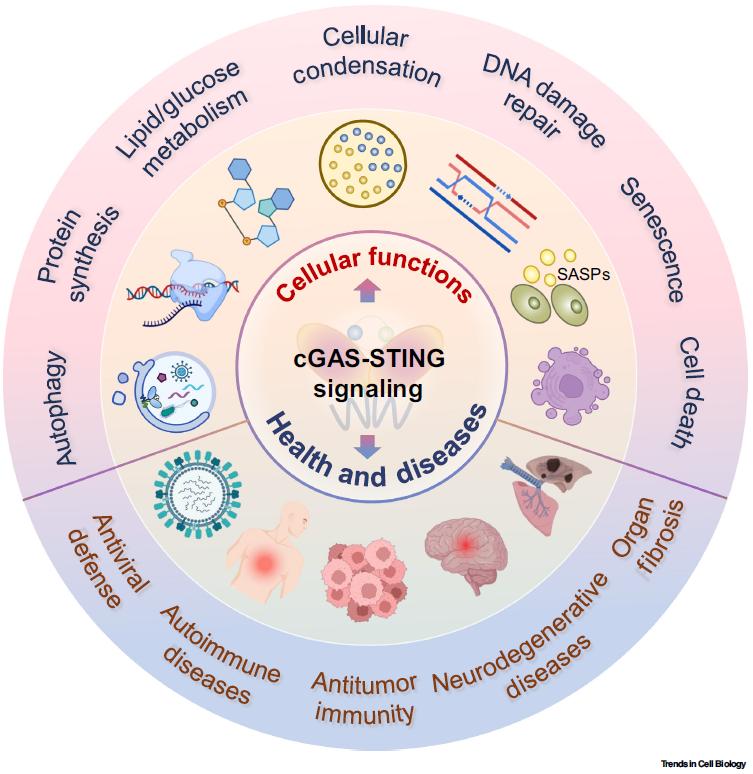 ▲图3 cGAS-STING信号通路调控的多种细胞功能及相关人类疾病 4. 总结与展望 自2013年cGAS-cGAMP-STING信号机制被鉴定至今,领域内对cGAS-STING信号的活化机制、调控范式以及生物学功能已经有了较全面的解析。特别地,近期的一系列开创性工作更是加深了对STING参与调控细胞命运选择、mRNA翻译、糖脂代谢和无膜细胞器等重要功能的认知与理解。然而,cGAS-STING信号如何协调并整合其介导的经典或非经典信号转导途径,进而精确调控细胞生理状态、影响疾病进程,其具体机制仍有待解析。这些问题的深入探索将更有助于临床药物的开发与实践。 本文参考文献 1. Zhang, D. et al. (2022) A non-canonical cGAS-STING-PERK pathway facilitates the translational program critical for senescence and organ fibrosis. Nat Cell Biol 24 (5), 766-782. 2. Liu, D. et al. (2019) STING directly activates autophagy to tune the innate immune response. Cell Death Differ 26 (9), 1735-1749. 3. Gui, X. et al. (2019) Autophagy induction via STING trafficking is a primordial function of the cGAS pathway. Nature 567 (7747), 262-266. 4. Tian, M. et al. (2020) IRF3 prevents colorectal tumorigenesis via inhibiting the nuclear translocation of beta-catenin. Nat Commun 11 (1), 5762. 5. Chattopadhyay, S. et al. (2010) Viral apoptosis is induced by IRF-3-mediated activation of Bax. EMBO J 29 (10), 1762-73. 6. Xu, P. et al. (2014) Innate antiviral host defense attenuates TGF-beta function through IRF3-mediated suppression of Smad signaling. Mol Cell 56 (6), 723-37. 7. Meng, F. et al. (2021) Induced phase separation of mutant NF2 imprisons the cGAS-STING machinery to abrogate antitumor immunity. Mol Cell 81 (20), 4147-4164 e7.  论文作者介绍  徐平龙 教授 徐平龙,浙江大学生命科学研究院教授。长期从事核酸天然免疫识别的信号机制、调控及其生理病理功能研究,发现了核酸识别的蛋白质合成、蛋白液相分离、线粒体动态、细胞分化等生物学功能,鉴定了非经典cGAS-STING-PERK信号通路,提出了原癌基因、血糖浓度、营养微环境、相分离等控制核酸识别免疫应答的学术理论。研究进展以通讯作者发表于Nature Cell Biology (2022, 2019, 2017)、Molecular Cell (2022, 2021, 2020, 2014)、Cell Host & Microbe、Genes & Development等知名学术期刊,并连续10次被国际专家在Nature Cell Biology和Molecular Cell撰写专文或者在Cancer Discovery、Science Signaling、Cancer Research等知名期刊亮点报道。曾获国家杰出青年科学基金、国家自然科学基金重点项目等资助,并获吴瑞纪念基金会-顾孝诚讲座奖、普洛麦格细胞生物学创新奖、浙江大学优博导师(2018,2019,2020)、浙江大学求是特聘教授等荣誉。实验室网页:http://lsi.zju.edu.cn/25439/list.htm 相关论文信息 相关研究发表在Cell Press细胞出版社旗下期刊Trends in Cell Biology,点击“阅读原文”或扫描下方二维码查看论文 ▌论文标题: Cellular functions of cGAS-STING signaling ▌论文网址: https://www.cell.com/trends/cell-biology/fulltext/S0962-8924(22)00252-5 ▌DOI: https://doi.org/10.1016/j.tcb.2022.11.001 阅读原文 |
【本文地址】