| 应用分享 9 | 您所在的位置:网站首页 › mtdna序列 › 应用分享 9 |
应用分享 9
|
随着生物学研究领域以及检测手段的不断深入,目前已有众多科学家开始聚焦于单一组织内特定细胞系的发育分化研究。通过探索追踪细胞克隆谱系,有助于我们更加深入地了解细胞系的内在发展规律。 尽管目前研究者已开发出多种成功完成体内遗传标记的模式生物,但其中多数方法需要进行检测细胞核 somatic mutations,这会导致诸多应用障碍:大量的错误检测,有限的测序读长,以及无法获取细胞克隆状态信息。 本文作者展示了一种新颖的单细胞测序应用方向,将 scRNA/scATAC assay 用于鉴定 mtDNA 位点突变,并将 mtDNA 突变信息作为遗传标记,用于回溯体细胞克隆的精确发展进程。 尽管人体内的所有细胞都是来源于最初的受精卵,但对于细胞系的发育和分化过程,例如不同组织中细胞个体动态如何协同调控病理进程,我们仍缺乏深刻认识。以往研究者使用遗传标记工具来追溯细胞系的发展进程,例如荧光蛋白,可移动的转录元件,高度多样性的 DNA 条码文库,或者 CRISPR 基因剪刀等。然而遗传标记手段局限于体外研究,无法应用到体内阶段。而现有的谱系回溯手段又仅有 SNVs,CNVs 和 STRs 等方法,可在子代细胞中检测但在旁系细胞系中无法实现有用信息的有效获取。同时单个细胞核的全基因组测序由于成本高昂,检测错误率高,并且测序量极其庞大,不适用于细胞谱系的发展研究。 近年来单细胞测序领域的技术突破,为不同细胞群间的异质性表达研究提供了可能。与此同时研究者们发现,线粒体 DNA 提供了优异的检测对象:mtDNA 基因组大小适中(16.6-kb),拷贝数量众多(100~1000 份),体细胞突变率较之于核 DNA 更高(~10-100 倍),以及其在细胞系繁殖发育过程中具有随机分配特性。基于以上特点,来自 Harvard 和 MIT 博德研究所的科学家们认为 mtDNA 突变信息可以作为细胞异质性的一种天然内在标记。上述信息结合单细胞测序技术,有望用于研究细胞系克隆的动态发展进程。 Broad Institute of MIT and Harvard:MIT 和 Harvard 博德研究所成立于 2004 年,此时正值于新世纪初人类完成了生物学领域最伟大的成就——人类基因组计划。由于人类疾病发生案例和病理原因越来越复杂,传统的分子医学研发方式无法有效的应对新的健康挑战,MIT 和 Harvard 的学术领导者们决定整合各方资源,成立一所全新的研究机构,广泛吸纳生物学、化学、医药学、信息科学和工程学等领域的优异人才,全力解析人类基因组中所蕴藏的海量遗传编码信息。目前博德研究所汇聚了三千多位科学家,研究领域涉及癌症、心血管疾病、传染性疾病以及精神类疾病,致力于将基因组计划成果转化为安全有效的临床治疗方案。 ▊ ATAC-Seq 测序 mtDNA 准确鉴定克隆谱系发展 为验证 mtDNA 表型变化是否可以准确鉴定克隆谱系,文章作者以 TF1 cell line 为基础,从初始细胞株经过 8 次迭代扩增,得到 65 个亚克隆系,以此建立原理验证实验。 通过 single-cell assay for transposase accessible chromatin-sequencing (scATAC-seq) 测序结果可以得知,mtDNA 突变结果可以从亲代细胞遗传至子代细胞中,其中绝大多数突变为 C→T 突变型。在第一代克隆扩增过程中既已存在一些共有的体突变结果(见图 Fig-1D, 8003 C→T 突变点),在最后的亚克隆系中,这些独特的点突变结果最终会被保留,并被传递至子代细胞中。与此同时,一些新的突变信息也会伴随着克隆扩增过程而出现,并持续传递到子代样本中。
▊ 单细胞测序可成功应用于 mtDNA 异质性检测 由于 mtDNA 较小的基因组长度,在正常的细胞活动中,其可被完全转录,研究者由此猜测可用单细胞测序方法检测 mtDNA 异质性。作者挑选了三株 TF1 细胞克隆系 (clones C9, D6, and G10),分别使用 bulk ATAC, scATAC, bulk RNA, scRNA 以及 sc-mtDNA-seq 检测 mtDNA 突变结果,以此来推测细胞克隆系的发展进程。
从测序结果可知,五种测序方法得到的检测结果保持了高度的一致性。其中,scATAC 和 sc-mtDNA-seq 的检测结果具有更好的 mtDNA 序列一致性和检测覆盖率。同时每一种检测结果均可按 allele 信息将多达 95.4% 的前述细胞系聚类为独立的克隆株,其最低异质性检测限可达到 3.8%,从而精确地推断不同克隆株间的遗传关联信息。 ▊ mtDNA 突变克隆成功匹配 Lentiviral 遗传条码 为保证 mtDNA 异质性可以准确用作克隆识别的核酸突变标志物,研究者引入了常用的遗传标记 lentiviral barcode 作为对照。通过将 mNeonGreen 基因 UTR 区域插入一段 30-bp 的随机核酸序列,构建一组 Perturb-seq lentiviral 核酸序列物,作者借助于 mNeonGreen 荧光蛋白的表达变化,使用流式分选方法获得了 25 株 TF1 细胞克隆,并对上述克隆进行了 bulk ATAC 和 scRNA 测序,以此得到 20 组 mtDNA 突变结果。从 Fig-3D 可知,mtDNA 突变信息与 lentiviral barcode 高度吻合,共同指向了来源于亲代的特异性遗传突变类型。
▊ mtDNA 突变异质性伴随 HSPCs 扩增稳定传递 接下来作者继续研究了在人原代细胞中,mtDNA 突变结果能否持续繁殖传递。作者筛选了两名志愿者,从中分选收集 CD34+的 hematopoietic stem and progenitor cells (HSPCs),由此获得 65 株红系和髓系克隆,并对其中 935 个单细胞进行了 scRNA 测序。与预期结果一致,测序结果可被聚类为两种主要类型的克隆系。同时,mtDNA 突变结果可进一步地将上述细胞归类为更加精确的亚克隆系。
▊ mtDNA 突变信息预测人体细胞克隆亚型 在前述研究结果的基础上,作者继续探究了 mtDNA 突变信息是否可用于人体内免疫细胞的克隆亚型预测。 TCR 重排结构被广泛认为是免疫细胞克隆亚型的天然识别标志物,作者从肺癌以及肝癌组织中分离得到相应的 tumor infiltrating T lymphocytes,并使用 mtDNA 测序方法进行检测。如图所示,具有相同 TCR 分子结构的淋巴细胞同时也具有特异性的 mtDNA 突变结果。更进一步地,在同样的 TCR 克隆中,细胞克隆亚型还可依据 mtDNA 突变信息做更深入的分类。在经历了刺激和增殖扩增后,这些突变结果还会继续不断繁殖传递。与此同时,即使在不同 TCR 克隆中,也能发现存在一些相同的突变信息,表明这些突变位点来源于同一组 V(D)J 结构重排的共同祖先细胞,进一步证明了 mtDNA 可用作体内研究的克隆标志物。
在血液细胞中验证了 mtDNA 突变信息的适用性后,作者紧接着研究了在实体组织中 mtDNA 序列突变的有效性。研究者从病人体内提取了结肠癌组织以及邻近健康组织细胞,经过克隆和测序后,发现了 11 组特异性 mtDNA 突变结果仅存在于肿瘤细胞中。在 228 份样本中,依据突变结果可以将其中 45% 的细胞归类到 12 个特异性亚群中,证实了克隆异质性的存在。进一步地,按细胞表面标志物分来,上述测序结果还可以继续归类出以下结果:93% 表达 LGR5 marker 的肿瘤细胞表现有 9000 T→C 位点突变。并且,增殖 marker MKI67 在上述细胞亚群中表达量显著升高,这一结果又有助于解释这些群体符合肿瘤组织的发展特性。
▊ 结论和亮点 1. mtDNA 基因组个头较小,突变率高且拷贝数较多,基因异质性可伴随随机分配的繁殖特点在子代细胞中稳定传递,因此可以用作克隆标志物。2. 相比于以体细胞 SNV,CNV 和 STR 为检测手段的传统细胞谱系研究方法,mtDNA 突变异质性更适合用于克隆谱系回溯:较低的测序成本,极大的测序通量,可直接应用于人体组织研究,可结合其他实验方案表征细胞转录组学。3. 作者设计了一套以 scRNA 测序结果为基础的突变检测方案,其异质性变化检测限可以低至 5%,可实现对克隆亚型鉴定的 95% 准确度。4. 本文实验方案使用了 Sony SH800S 来分选单细胞,为单细胞克隆以及单细胞 DNA/RNA 文库的建立提供了坚实了基础,有力确保了后续实验过程中的突变测序结果的准确性。5. 某些种类细胞内的细胞器在外界应激条件下,可能会发生胞间水平转移,这一过程的具体机制目前仍不清楚,故而线粒体的横向转移对提高突变鉴定的结果准确性仍有一定的干扰。 ▊ 参考文献 Ludwig et al., Lineage Tracing in Humans Enabled by Mitochondrial Mutations and Single-Cell Genomics, Cell (2019), https://doi.org/10.1016/j.cell.2019.01.022 图片来源:索尼生物 编辑: z翟某某 来源:丁香园 |
【本文地址】
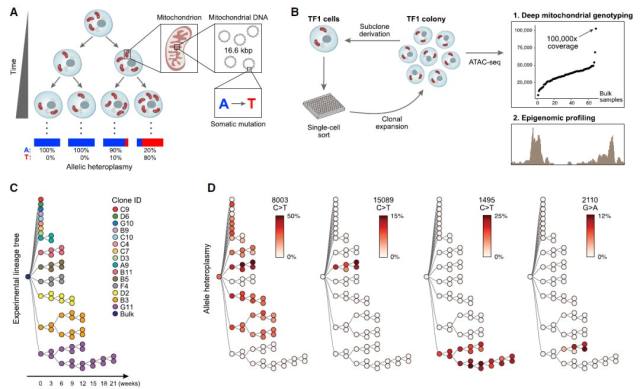 Fig-1. Mitochondrial Mutations Are Stably Propagated in Human Cells In Vitro
Fig-1. Mitochondrial Mutations Are Stably Propagated in Human Cells In Vitro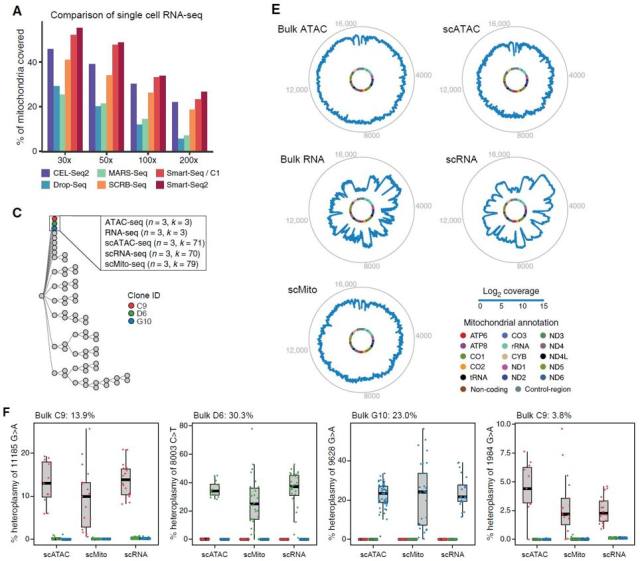 Fig-2. Mitochondrial Mutations Are Detected Using Single-Cell Genomics
Fig-2. Mitochondrial Mutations Are Detected Using Single-Cell Genomics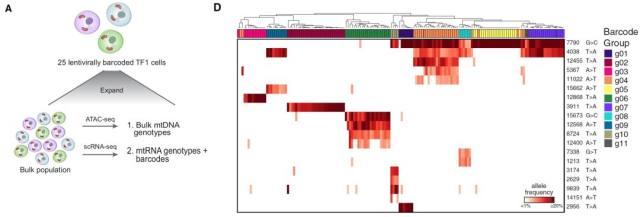 Fig-3. Validation of Mitochondrial Mutations as Clonal Markers in Single Cells Using Lentiviral Barcoding
Fig-3. Validation of Mitochondrial Mutations as Clonal Markers in Single Cells Using Lentiviral Barcoding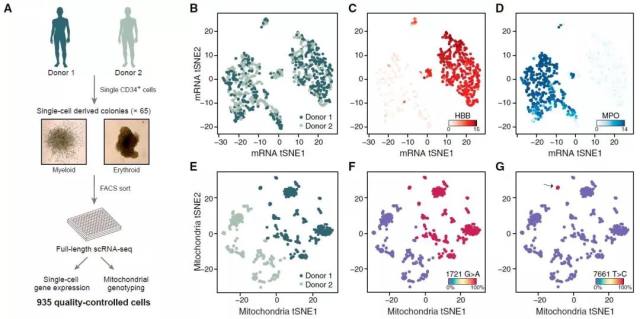 Fig-4. Mitochondrial Mutations Are Stably Propagated in Primary Hematopoietic Cells
Fig-4. Mitochondrial Mutations Are Stably Propagated in Primary Hematopoietic Cells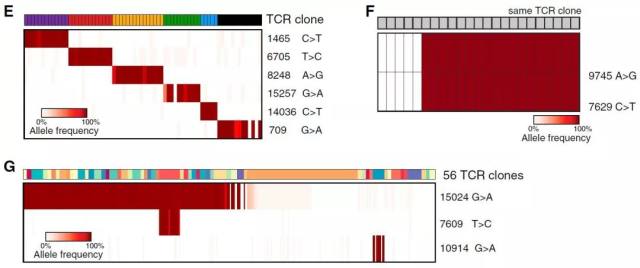 Fig-5. Mitochondrial Mutations Identify Clonal Contributions in Polyclonal Mixtures of Human Cells
Fig-5. Mitochondrial Mutations Identify Clonal Contributions in Polyclonal Mixtures of Human Cells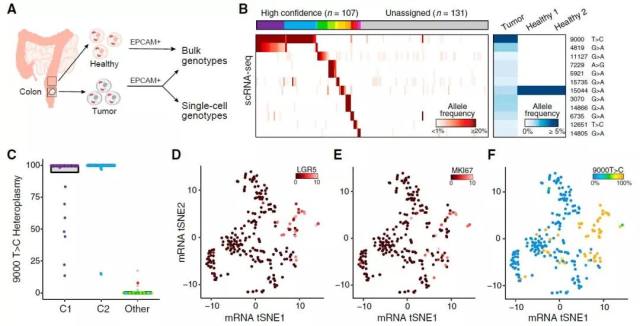 Fig-6. Application of Mitochondrial Mutation Tracking in Human Cancer In Vivo
Fig-6. Application of Mitochondrial Mutation Tracking in Human Cancer In Vivo