| Cancer Cell最新综述:新辅助免疫检查点阻断疗法 | 您所在的位置:网站首页 › icb医学 › Cancer Cell最新综述:新辅助免疫检查点阻断疗法 |
Cancer Cell最新综述:新辅助免疫检查点阻断疗法
|
原创 Cell Press CellPress细胞科学 收录于合集#Cell Press论文速递 469 个 #Cancer Cell 30 个  生命科学 Life science 2023年8月17日,Cell Press细胞出版社期刊Cancer Cell发表一篇题为“Neoadjuvant immune checkpoint blockade: A window of opportunity to advance cancer immunotherapy”的新综述。 在治疗癌症患者的新方法中,很少有像新辅助免疫检查点阻断疗法(neoadjuvant immune checkpoint blockade)那样迅速起效。癌症新辅助治疗是在对治疗无效的患者实施治愈性手术之前进行的,传统新辅助化疗和放疗的主要目的是缩小肿瘤体积,提高手术切除率。然而,最新科学证据表明新辅助免疫疗法可以促进肿瘤特异性 T 细胞克隆,并对其进行转录修饰,从而增强瘤内和全身的抗肿瘤免疫力。它还提供了一个独特的“机会窗口”,通过研究免疫检查点阻断疗法(immune checkpoint blockade, ICB)反应和耐药机制并确定新的耐药生物标志物,将有助于完善长期临床结果预测和开发新的、更高效的 ICB 联合疗法。本文中,我们将探讨相关领域临床和科学知识的进展,并介绍与新辅助免疫治疗相关的一些重要的新原则。 ▲长按图片识别二维码阅读原文 介绍 新辅助免疫检查点阻断疗法正在不同癌症类型中进行临床试验,过去两年已有两种疗法获得了美国食品及药物管理局(FDA)的批准。新辅助癌症疗法是在对治疗无效的患者进行手术之前所实施的策略,新辅助免疫疗法除了能提高手术切除原发肿瘤的可能性外,还能进一步增加治疗效果,其能进一步利用原发肿瘤作为免疫系统识别的抗原来源,从而促使免疫系统识别肿瘤。除了增强原发肿瘤的手术切除能力外,新辅助免疫疗法进一步利用原发肿瘤作为免疫系统识别的抗原源,诱导或增强全身抗肿瘤免疫,以靶向和消除可能会成为术后复发的远端微小转移灶。虽然新辅助免疫疗法,如白细胞介素-2、癌症疫苗和抗CTLA-4等已在过去几十年的小规模试验中进行了试验,但随着PD-1通路阻断疗法的出现,无论是单独应用还是联合治疗,都加速了该领域的发展(图1)。从第一篇发表的关于非小细胞肺癌(NSCLC)新辅助抗PD-1单药治疗的报道到FDA首次批准新辅助抗PD-1/化疗联合治疗三阴性乳腺癌(TNBC)只过去了三年。 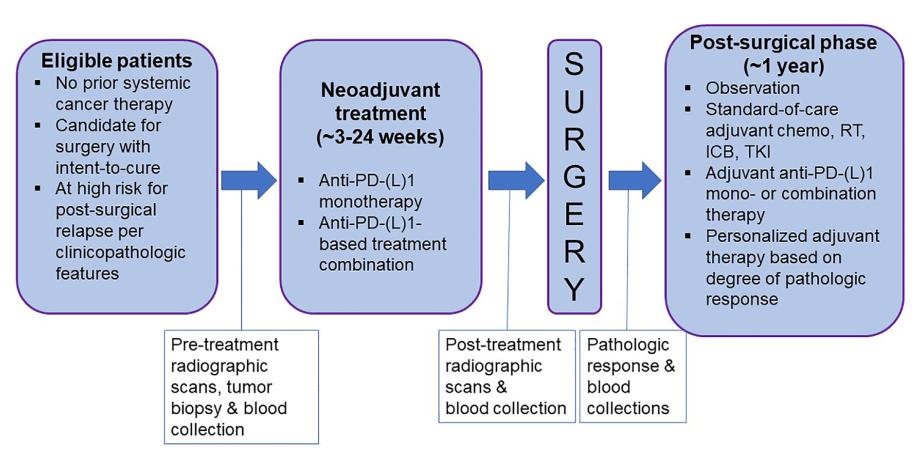 图1:新辅助免疫检查点阻断的治疗范例。入组新辅助免疫检查点阻断临床试验的患者通常对其他全身性癌症疗法是初治的,并且具有被外科专家认为可能可切除以治愈的癌症,但具有与复发高风险相关的临床病理学特征。根据癌症类型,新辅助治疗期可以在约3至24周的范围内,随后进行外科手术,该外科手术可以是最初计划的手术,或者根据肿瘤消退的临床/放射学证据进行定制。在手术标本中确定病理学反应。手术后,患者可进入观察期,接受标准护理或实验性辅助疗法,或接受针对其病理反应程度定制的辅助疗法。在新辅助ICB之前和之后收集的血液和组织用于支持生物标志物发现的多组学相关研究。化疗、化疗;ICB,免疫检查点阻断;RT,放射治疗;TKI,酪氨酸激酶抑制剂。 在某些特定的肿瘤类型中,使用ICB方案可以在相当一部分患者中实现病理层面上的完全缓解(pCR),即没有残留肿瘤细胞的组织学证据。因此,如果ICB导致肿瘤特异性T细胞的系统激活,并且切除组织中的病理反应反映了对外周微转移疾病的系统免疫反应,那么可以预期病理反应与生存结果之间存在相关性。的确,在TNBC和NSCLC的两个FDA批准研究中观察到了pCR和生存期(EFS,治疗开始后无疾病进展或死亡)的改善,这可能支持了新辅助ICB的假定免疫机制,并验证了病理反应作为长期临床预后的早期替代终点。这些发现还表明,病理反应不良可能需要额外的辅助(术后)治疗。 新辅助ICB除了能获得临床益处外,这种治疗方法还能为ICB反应和耐药机制的详细相关免疫学分析提供丰富的资源。首次,大量的活体肿瘤组织(有时还包括肿瘤引流淋巴结和周围正常组织)可用于对病理响应者与非响应者进行比较分析。特别是,高维和超高维的蛋白质组学、转录组学、表观遗传学以及BCR和TCR重排分析平台可以对肿瘤治疗中的每一种细胞类型进行单细胞分析。这些平台包括高维流式细胞术和单细胞RNA测序、ATAC测序和TCR测序。除了T细胞、B细胞和髓系细胞外,还能对基质细胞进行分析,生成包含大量信息的公开可用数据库。最后,对完整肿瘤切片进行高维空间蛋白质组学和转录组学分析也提供了额外的信息。解析和挖掘这些丰富的数据集需要复杂的计算分析平台。除了基础研究发现外,预计这些科学努力将有助于指导新辅助免疫疗法组合的持续改进,造福患者。 新辅助ICB是临床研究中的一个多样而强大的领域,在数十种癌症中有数百项正在进行或计划中的临床试验。本文将重点关注其在一些癌症类型中的临床进展,如NSCLC、TNBC以及皮肤和胃肠恶性肿瘤,这些进展具有广泛的意义,可以有效地将这种治疗方法应用于其他癌症类型。我们还将探讨在新辅助治疗框架内科学地应用多组学研究,以更好地理解驱动ICB响应和耐受的免疫学机制。 肺癌 在过去的10年里,晚期NSCLC的治疗手段发生了巨大变化,自2010年以来,已经批准了25种以上的新药物,主要是靶向治疗和免疫检查点抑制剂(ICB)。然而,在2020年批准用于EGFR突变的NSCLC的辅助治疗-奥西美替尼之前,对于可手术切除的肺癌的全身治疗已经有近15年的时间几乎没有取得任何进展。NSCLC的手术后预后是所有常见癌症中最差的,仅有50%的II期(原发肿瘤≥4厘米和/或涉及最近的淋巴结)或IIIA期(大肿瘤和/或涉及更远的淋巴结)患者在接受了手术后预计能够存活五年。与单纯手术相比,辅助顺铂为基础的化疗在五年内可以提供约5%的总体生存率(OS)优势;然而,这种有限的益处限制了其在临床中的常规使用。PD-1通路阻断抗体,无论是作为单药治疗还是与化疗和/或不同的免疫检查点抑制剂(抗CTLA-4)联合使用,已成为大多数无法手术切除且缺乏可靶向驱动基因的晚期NSCLC的标准治疗。此外,对于无法手术切除的III期疾病,在放化疗后使用抗PD-L1(达伐单抗)疗法,临床上称为“巩固治疗”,可以提高长期生存率。来自多个3期试验的五年随访结果表明,约有10%的晚期NSCLC患者在初始系统治疗中应用抗PD-(L)1后能获得长期无进展生存(PFS),即有效治愈。 对于可切除的肺癌,新辅助化疗与辅助化疗相比,益处同样有限,但在耐受性、剂量强度和通过病理评估手术标本对治疗反应进行体内评估方面具有潜在优势。第一项报道的任何癌症类型的新辅助PD-1通路阻断临床试验是针对可切除的NSCLC。21名患者在临床I期B-IIIA期NSCLC手术前约4周接受尼伐单抗治疗,不强制要求辅助治疗。治疗耐受性良好,除一名患者外,所有患者均接受了完全手术切除。尽管治疗时间短暂,但45%接受切除的患者在手术标本中具有原发肿瘤的主要病理响应(MPR,切除标本中残留活性肿瘤≤10%)。深入转化分析显示,肿瘤和外周之间的T细胞克隆迅速膨大,包括在具有病理完全缓解(pCR)的患者中的突变相关新抗原(MANA)特异性克隆。事实上,这些克隆于4周内在血液中的迅速扩张和收缩类似于对病毒感染的急性反应。这些发现与新辅助ICB可能在肿瘤仍然存在的情况下激活全身抗肿瘤免疫的假设一致。值得注意的是,尽管术前肿瘤成像展现出最小的放射学反应甚至是出现了明显的肿瘤生长,但在一些患者中观察到了显著的病理学反应。这揭示了随后在其他癌症类型中的新辅助ICB研究中再现的重要主题,即ICB诱导的肿瘤组织回归可能超过了放射学回归。这项小型试验的五年随访结果显示,具有MPR的患者中没有发生活动性癌症或与癌症相关的死亡案例,因此令人鼓舞。 在很多已经被报道的2期临床试验中,有几项关键研究探索评估了新辅助抗PD-1联合化疗或抗CTLA-4的治疗方案效果。在NADIM和NADIM-2试验中,可切除的III期非小细胞肺癌患者接受标准新辅助卡铂-紫杉醇化疗,同时选择性地接受尼伐单抗辅助治疗,持续6-12个月。单臂试验NADIM纳入了46名患者,结果显示出意向治疗(ITT)人群中有57%的显著pCR率。36个月的总生存率为82%。NADIM-2试验随机将患者分为接受9周新辅助化疗与尼伐单抗或仅接受化疗的两组,随后再接受6个月的辅助尼伐单抗治疗。pCR终点从仅化疗组的7%提高到化疗免疫治疗组的37%,而关键的OS终点从24个月的63%提高到85%(风险比0.40,95%置信区间0.17-0.93;p=0.034)。同时,两项临床试验结果显示,当新辅助抗PD-1与抗CTLA-4联合使用时,其可能会增强疗效,报道的pCR率为33-38%(而仅有新辅助尼伐单抗治疗组为10%),但其有增加毒性的风险。最近,NEOSTAR平台试验报道了将新辅助尼伐单抗和伊匹单抗(抗CTLA-4)与化疗联合使用的结果。当在没有肿瘤EGFR或ALK突变的患者中添加伊匹单抗到新辅助尼伐单抗加化疗方案中时,MPR率提高到63%(而新辅助尼伐单抗加化疗方案的MPR率为41%),并且效应记忆CD8+ T细胞、B细胞和髓系细胞以及三级淋巴结构(TLS)的标志物也有所增加。 在此基础上,CheckMate 816随机性3期临床试验纳入了358例临床I期到IIIA期非小细胞肺癌患者,他们在进行明确的手术切除之前接受了约12周的新辅助化疗±尼伐单抗。无需辅助治疗。该研究的共同主要终点是pCR和EFS。在新辅助化疗方案中,尼伐单抗加化疗组有更多患者完成了原定计划的新辅助治疗过程(94% vs. 85%),并进行了明确的手术切除(83% vs. 75%)。添加尼伐单抗到新辅助化疗中没有增加治疗相关毒性或手术并发症,并且患者在化疗免疫治疗后需要进行更少的广泛手术。ITT人群中的pCR率显著增加,从仅化疗组的2.2%增加到化疗免疫治疗组的24%(比值比13.94,99%置信区间3.49-55.75;p10%)的肿瘤亚组中更明显,其中FLOT + atezolizumab的病理学缓解率为67%,而单独FLOT的病理学缓解率为39%。虽然这些初步结果需要进一步确认,但它们表明肿瘤PD-L1表达可能是选择胃食管癌患者进行新辅助免疫治疗的有用生物标志物。 胰腺导管腺癌 胰腺导管腺癌(PDAC)是一种显著的免疫耐受性肿瘤,其中免疫疗法迄今未能在任何疾病背景中最终显示临床益处,并且OS仍然令人沮丧(5年存活 |
【本文地址】