| 这个您得知道 | 您所在的位置:网站首页 › gmp中电子数据管理规定 › 这个您得知道 |
这个您得知道
|
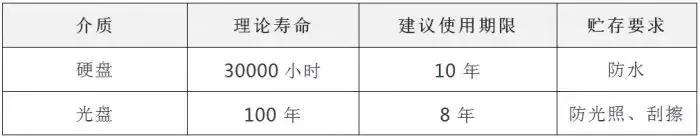
5.4关系型数据库是同时存放数据及其关系的数据库,这些数据库通常由应用程序提供备份功能或自动备份功能,对于这类数据库应采用完全备份的方式进行备份,备份后的文件复制在备份磁盘上。 5.5备份周期通常可以设定为一个月,如果程序自动备份,异地备份的周期可为一年。 5.6可通过备份前后文件或文件夹的大小、文件数量来核查被备份的文件或文件夹的完整性,并进行登记,表格见附件1。 5.7每半年应对之前的备份介质进行一次检查,应随机抽取至少一份备份介质,在该备份介质上调用至少1个备份数据,并打印相关报告,作为附件并登记,检查表格见附件2。 5.8存放备份数据的介质必须具有明确的标识;标识必须使用统一的命名规范,注明介质编号、介质的启用日期、保留期限和系统管理员等重要信息。 5.9本公司数据备份的介质通常选择光盘或移动硬盘,其使用和储存条件为:
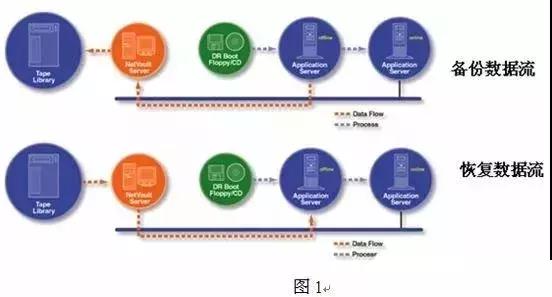
5.10如因系统或设备升级等原因,原记录和数据不再发生变化,可以将记录和数据转移到另外的位置或系统,同时保存支持这些记录和数据的应用程序,进行存档备份处理。存档备份的数据应该可以很容易地获取,以用于商业目的或监管目的。 备份文件的保存时间至少为产品效期后一年,出口的原料药保存时间为该批产品销售后三年。过期或不能使用的备份媒介应通过受控的方式进行销毁或处置,由数据使用部门和质量管理人员现场见证销毁或处置过程,并提供有签名的证明文件。 5.11系统出现故障或损坏时,可以由系统管理员调取备份的电子数据进行恢复。未及时进行备份的数据,经质量监督管理部门调查分析后,决定是否重新检验。包括系统故障和数据错误在内的所有事故都应当被记录和评估,重大的事故应当进行彻底调查,识别其根本原因,并采取相应的纠正措施和预防措施。 5.12在备份、归档和恢复过程中,出现的错误应详细记录在备份日志中,必要时报告偏差,并进行调查处理。 6.附件:
附件1 电子数据备份记录
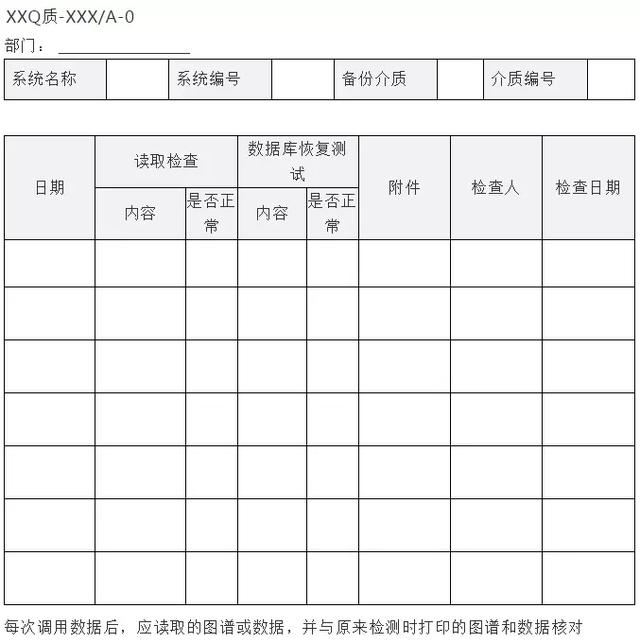
附件2 电子数据备份检查记录
编辑整理:德斯特cGMP 版权及免责声明:本公众号所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系德斯特删除。文章版权归原作者及原出处所有。本公众号拥有对此声明的最终解释权。
德斯特cGMP团队一直致力于国际GMP认证咨询;针对美国GMP认证, EU-GMP认证, PIC/S认证, WHO认证以及中国GMP认证,可为客户提供完整的GMP认证解决方案;同时,在产品注册和产品技术转移,以及新建项目的设计、验证服务可提供专业的咨询服务。返回搜狐,查看更多 |
【本文地址】