| CAR | 您所在的位置:网站首页 › ealga阴性 › CAR |
CAR
|
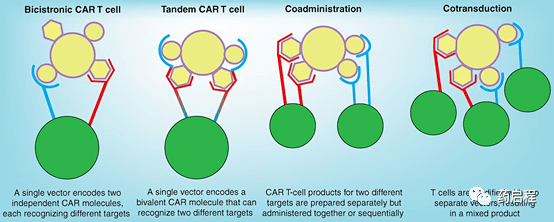
在西雅图儿童研究所 (SCRI) 的一项针对B-ALL的类似CD19-4-1BB-ζ CAR的临床试验中,40名获得CR的患者中有7名 (18%) 后来因CD19缺失而复发(10)。 NCI在儿科患者中进行的CD19-CD28-ζ CAR试验的特点是T细胞持续时间较短,患者经常在CAR治疗后接受造血干细胞移植 (HSCT),但12名达到最小残留的患者中有2名疾病 (MRD) 阴性反应也发展为CD19阴性 B-ALL(患者均未接受 HSCT;参考文献 9)。一份包含NCI研究扩展队列的摘要形式的随访报告表明,CAR后MRD阴性的28名患者中有5 名 (18%) 最终复发,CD19表达降低,包括一些在HSCT后复发的患者 (20)。 来自成人B-ALL CAR后复发的数据很少:Fred Hutchinson 癌症中心 (FHCC) 的CD19-4-1BB-ζ CAR的I期试验发现29名患者中有2名 (7%) CD19 阴性复发谁获得了CR (11)。 B-ALL的CD19 CAR试验中CD19阴性复发率的总结见表 1,但在比较不同研究时应谨慎,因为它们在随访期间差异很大。 总之,虽然CD19阴性逃逸是B-ALL的CD19-CAR治疗后复发的主要原因,但这种现象的真实发生率尚未确定,预测CD19阴性复发可能性增加的因素知之甚少.尽管如此,随着CD19 CARs和blinatumomab的CD19定向免疫疗法的应用增长,很明显CD19阴性B-ALL的临床影响也会增加。 表 1. ALL 的 CD19 CAR 试验中抗原逃逸的总结 (2)抗原丢失的机制 鉴于CD19 CAR在儿科B-ALL中的大量临床经验,大多数关于抗原丢失机制的数据来自这些试验中患者样本的研究 。迄今为止,已发表的数据表明CD19丢失是通过两种不同的机制发生的:抗原逃逸或谱系转换。 谱系转换是临床试验中观察到的CD19丢失的另一种机制 (33)。最常见于MLL重排的患者,例如 B-ALL 婴儿,当白血病表型响应 CD19 定向免疫疗法从淋巴样变为髓样时,就会发生谱系转换。进化的白血病群体不仅不再表达 CD19,而且还获得了AML的其他表型特征。这在2名在SCRI试验中接受CD19 CAR治疗的MLL重排ALL儿科患者和一名成人在FHCC的CD19 CAR试验中观察到 (11)。此外,Jacoby 及其同事在小鼠白血病中模拟了这种现象,他们证明 CD19 CAR 在依赖 E2a:PBX 转基因的小鼠 ALL 模型中诱导谱系转换,与MLL重排一样,它可以驱动淋巴或髓系肿瘤 (36)。使用 blinatumomab 进行 CD19定向治疗后,MLL重排和非重排患者也发生了谱系转换 (38-40)。类似地,已经报道了一例在CD19 CAR治疗后转化为克隆相关浆母细胞淋巴瘤的 CLL 病例 (41)。 (3)克服抗原损失的策略 描述CD19抗原丢失所涉及的多种机制表明,创建CAR以靶向CD19上的替代表位可能无效,因为许多例子都涉及CD19表面表达的丢失。数据还表明,无论是 CD19-CAR 还是 blinatumomab 介导的 T 细胞杀伤,都不能有效诱导对B-ALL上共存免疫原性靶标的免疫反应,有时也称为“表位扩散”。这可能反映了B-ALL中相对较低的肿瘤突变负荷,这可能限制了该疾病的固有免疫原性。 将CAR T细胞与放射 (46)、检查点抑制 (47-49)、疫苗 (50, 51) 或其他免疫激动剂 (34, 52) 结合使用可能会导致表位扩散,有助于对抗免疫逃逸,我们预计随着该领域的成熟,此类研究将会出现。 克服CAR T细胞治疗后抗原丢失的另一种方法是同时针对癌细胞上的一种以上抗原,鉴于CD22 CAR T细胞也已显示出显着的临床疗效,这种方法对 B-ALL 很有说服力 (53)。有多种方法可以设计具有多特异性的 T 细胞产品(图 2)。针对不同 CAR 分别转导的 T 细胞产物可以同时或依次给药(“共同给药”;图 2;参考文献 54),或者可以在细胞生产过程中组合两种CAR的载体,以实现与某些细胞的混合产物单个 CAR 呈阳性,其他两种 CAR 呈阳性(“共转导”;图 2)。这些方法的缺点是生产多个载体的成本高,输注产品的异质性,这会使临床分析复杂化。
图 2 工程化CAR T细胞多特异性。 03 抗原密度降低 (1)临床数据 认识到单一抗原靶向在许多儿科B-ALL病例中不太可能成功,我们开发了一种靶向CD22的CAR,CD22 是另一种在淋巴母细胞上广泛表达的B细胞抗原(63)。在B-ALL中该CAR的首次临床试验中,我们观察到 CD19 阴性和 CD19 阳性疾病患者的高缓解率。然而,获得CR的12名患者中有8名 (67%) 在CD22-CAR输注后12个月内复发,在复发时,7名患者的CD22表达仍保留,尽管水平低于CD22-CAR时观察到的水平治疗。CD22表达的减少未伴随基因组水平的任何检测到的突变或CD22 mRNA的表达减少,表明CD22表达的下调发生在转录后水平。在一些患者中,在骨髓中发现了CD22-low淋巴母细胞和持久性抗CD22-CAR T细胞,表明CAR无法有效消除CD22-low细胞 (53)。 这通过产生具有可变 CD22表达水平的白血病细胞系得到进一步证明,并直接证明CD22 CAR在异种移植模型中产生细胞因子和控制肿瘤细胞的能力非常依赖于CD22的表面表达水平。 然而,这种逃逸机制与有关CAR T细胞激活要求的大量新兴数据一致。我们和其他人已经证明需要高靶抗原密度,以便CAR完全激活并发挥体内活性(64-66)。 认识到CAR需要高抗原表达才能发挥重要作用,这对这些实体瘤疗法的未来发展具有许多意义。鉴于几乎所有计划进行CAR T细胞临床试验的实体瘤靶点都是异质表达的,随着靶向实体瘤的单特异性CAR变得更加有效,临床成功可能会受到限制快速选择抗原低变异。用于AML的CAR面临类似的障碍。或者,CAR T细胞对高抗原密度的需求也开启了基于恶性和非恶性组织之间差异靶抗原密度的治疗窗口的可能性。 此外,Ahmed及其同事此后使用递增剂量的HER2-CD28-ζ CAR T细胞治疗肉瘤患者,并证明了安全性和临床疗效的初步迹象,包括在其骨髓横纹肌肉瘤患者中获得CR(82,83)。总之,临床经验与模型最一致,即肿瘤和正常组织之间 HER2靶抗原的差异表达为安全性提供了治疗窗口,这与对高抗原密度以获得体内最佳CAR活性的新认识一致。 (2) 克服低抗原密度 对于肿瘤和正常组织之间靶抗原差异表达较高的合适靶点,我们预测通过改造CAR T 细胞以响应较低的抗原密度,CAR疗法的疗效将得到增强。 一种方法是用增加靶抗原表达的药剂治疗患者。在临床前研究中,这种方法已采用全反式视黄酸来增加AML中叶酸受体 β 的表达(84),并且NCI的研究人员发现苔藓抑素可以增加白血病细胞上CD22的表达,这可能导致 提高CD22 CAR的功效或预防CD22低变体的生长 (85, 86)。 04 结论 B 细胞恶性肿瘤的临床经验表明,CAR T细胞有可能改变癌症免疫治疗的格局。然而,抗原阴性和抗原低的肿瘤变异体的出现表明,与所有抗癌药物一样,CAR可能需要组合方法来治愈大部分患者。在血液系统恶性肿瘤中,谱系来源的抗原以高水平表达并且可以被CAR有效靶向,而在实体瘤中,大多数可行抗原的表达水平较低且更加异质。重新设计CAR在较低抗原水平下的多特异性和活性将是一个重要的研究领域,因为社区试图增强CAR T细胞的效力以及它们可以提供具有临床意义的影响的疾病的广度。 请注明:姓名+研究方向! 版 权 声 明 本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系([email protected]),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。 返回搜狐,查看更多 |
【本文地址】